Il diabete mellito di tipo 2 progressivo è caratterizzato da una continua diminuzione della secrezione endogena di insulina. L’insulina è ancora un farmaco antidiabetico provato e molto efficace. La scelta della terapia insulinica si basa su diversi fattori, come lo stadio del diabete, il controllo metabolico e le risorse del paziente. Inizialmente, la grande maggioranza dei diabetici di tipo 2 può essere trattata con la terapia insulinica basale. Presenta il rischio più basso di ipoglicemia e di aumento di peso rispetto ad altri regimi insulinici (terapia insulinica prandiale, terapia insulinica mista). Nella pratica clinica, la combinazione di insulina e analoghi del GLP 1 sta diventando sempre più popolare.
Dal punto di vista patogenetico, il diabete mellito di tipo 2 è caratterizzato da insulino-resistenza e da una progressiva restrizione della secrezione di insulina. Di conseguenza, in genere si riscontrano elevati livelli di glucosio a digiuno e picchi di glucosio postprandiale. Per mantenere un adeguato controllo metabolico, la maggior parte dei pazienti richiede quindi una terapia insulinica durante il decorso della malattia. La terapia insulinica viene spesso iniziata o considerata troppo tardi. [1,2]Le ragioni sono molteplici e comprendono la paura degli effetti collaterali (aumento di peso, ipoglicemia) e numerosi altri fattori (ad esempio, l’inibizione all’autoiniezione, la paura di compromettere la qualità di vita, ecc.
Da un punto di vista puramente terapeutico, l’insulina offre numerosi vantaggi: L’insulina è il farmaco antidiabetico con la maggiore efficacia terapeutica ed è facilmente controllabile, non ha un potenziale di interazione rilevante con altri farmaci, non è controindicata nemmeno nell’insufficienza cardiaca, renale o epatica più grave e inoltre ha un effetto positivo sui lipidi plasmatici [3]. Gli effetti collaterali, come l’ipoglicemia e l’aumento di peso, possono spesso essere ben controllati o in gran parte evitati con una formazione adeguata e l’aggiustamento della dose o la scelta del regime terapeutico appropriato (ad esempio, la combinazione con gli agonisti del recettore GLP 1). La terapia insulinica moderna, quindi, rappresenta ancora un’opzione terapeutica molto efficiente e moderna nel concetto di trattamento multimodale per i diabetici di tipo 2.
Questo articolo si propone di fornire una panoramica aggiornata e pratica sulla terapia insulinica nelle persone con diabete mellito di tipo 2.
Valori target di HbA1c e algoritmi terapeutici
L’intervallo target di HbA1c viene impostato individualmente per ogni paziente. Vengono presi in considerazione diversi fattori, come l’età o l’aspettativa di vita, le comorbidità e il rischio di ipoglicemia [4]. L’importanza di un buon controllo metabolico per quanto riguarda lo sviluppo e la progressione delle sequele microvascolari, come la retinopatia o la nefropatia diabetica, è indiscutibile. D’altra parte, l’influenza di un buon controllo della glicemia sulle complicanze macrovascolari non è ancora stata chiarita in modo definitivo. Sebbene lo studio UKPDS abbia mostrato un certo beneficio del controllo glicemico precoce e buono sugli esiti cardiovascolari a distanza di anni [5], lo studio non ha mostrato alcun beneficio del controllo glicemico precoce e buono sugli esiti cardiovascolari a distanza di anni. Tuttavia, negli studi successivi (ADVANCE, ACCORD, VADT), condotti principalmente su pazienti con diabete di lunga data, il controllo glicemico intensivo che mira a livelli di HbA1c inferiori al 7% non ha ridotto la mortalità cardiovascolare [6–8]. In generale, la maggior parte delle società professionali specifica un’HbA1c intorno o inferiore al 7%, ma con l’opzione di valori target di HbA1c più alti (ad esempio, pazienti anziani con comorbidità) o più bassi (ad esempio, pazienti più giovani con una breve durata del diabete e un basso rischio di ipoglicemia).
Nelle attuali raccomandazioni ADA/EASD per il trattamento dell’iperglicemia nei pazienti con diabete di tipo 2, il trattamento con insulina di base risulta essere un’opzione terapeutica con la maggiore potenza terapeutica, al pari dei farmaci antidiabetici orali. Poiché la terapia insulinica ha potenziali effetti collaterali, ma comporta anche un impegno in termini di formazione e di applicazione del farmaco, nella pratica ha senso soppesare l’indicazione alla terapia insulinica rispetto alle altre opzioni terapeutiche antidiabetiche, tenendo conto della potenza e degli effetti collaterali.
Indicazioni per la terapia insulinica
Oltre alle indicazioni dipendenti dal metabolismo (deterioramento del controllo metabolico in combinazione doppia o tripla con antidiabetici orali con aumento dell’HbA1cvalore), ci sono diverse situazioni indipendenti dal metabolismo in cui la terapia insulinica ha senso (Tab. 1). Spesso, nella situazione acuta con iperglicemia pronunciata (“glucotossicità”), oltre ai sintomi corrispondenti con poliuria e polidipsia, si verifica una sorta di “rigidità secretoria” della secrezione di insulina e una diminuzione dell’azione dell’insulina. In questo caso, la terapia insulinica – che spesso è necessaria solo temporaneamente – aiuta ad abbassare la glicemia in modo rapido ed efficiente, in modo che la funzione delle cellule beta e la resistenza all’insulina migliorino di nuovo. Inoltre, è stato dimostrato che nei pazienti con diabete mellito di tipo 2 di nuova diagnosi, una terapia insulinica precoce e intensificata (rispetto agli antidiabetici orali) porta a un recupero significativamente migliore della funzione delle cellule beta e a una remissione glicemica più lunga [9]. In una percentuale considerevole di pazienti, il diabete mellito di tipo 1 non si manifesta se non dopo i 35 anni [10], e fino al 14% di tutti i pazienti che si presentano fenotipicamente come diabetici di tipo 2 hanno autoanticorpi rilevabili delle cellule dell’isolotto come espressione di una patogenesi autoimmune del diabete [11]. Se ci sono indicazioni di una carenza assoluta di insulina o di diabete mellito di tipo 1, l’inizio della terapia insulinica è indicato anche in questa situazione.

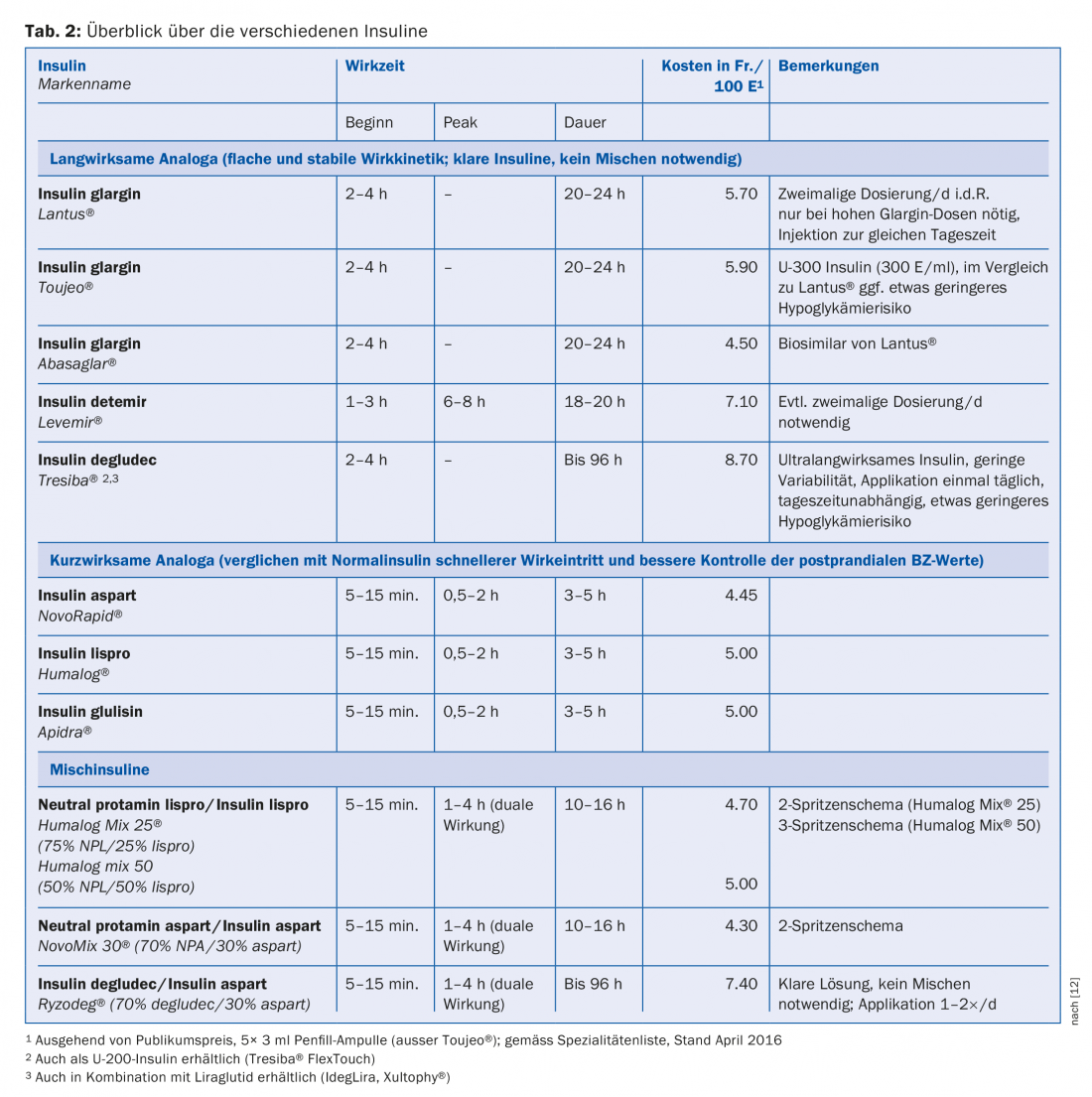
I diversi tipi di insulina
In base alla loro durata d’azione, le insuline si dividono in insuline ad azione rapida (prandiali), insuline ad azione lunga (basali) e insuline miste [12]. In un confronto diretto, non ci sono differenze nella riduzione dell‘HbA1c tra gli analoghi dell’insulina e le insuline normali o NPH. Tuttavia, nella vita di tutti i giorni e per aspetti pratici (applicazione, intervallo iniezione-mangime più breve, migliore controllo dei valori glicemici postprandiali, minor rischio di ipoglicemia), gli analoghi dell’insulina si sono affermati per la terapia sia basale che prandiale. Gli analoghi si differenziano dall’insulina umana per una struttura molecolare modificata. Sostituendo alcuni aminoacidi o aggiungendo acidi grassi, si modificano le proprietà farmacodinamiche e farmacocinetiche, come la durata d’azione o l’inizio dell’azione. La tabella 2 mostra una panoramica degli analoghi dell’insulina (comprese le insuline miste) oggi frequentemente utilizzati.
Informazioni generali sull’attuazione pratica della terapia insulinica
La terapia insulinica ideale normalizza i livelli di glucosio nel sangue pre e postprandiali senza provocare ipoglicemia o aumento di peso. I regimi insulinici conosciuti (tab. 3) si differenziano per complessità e impegno per il paziente.
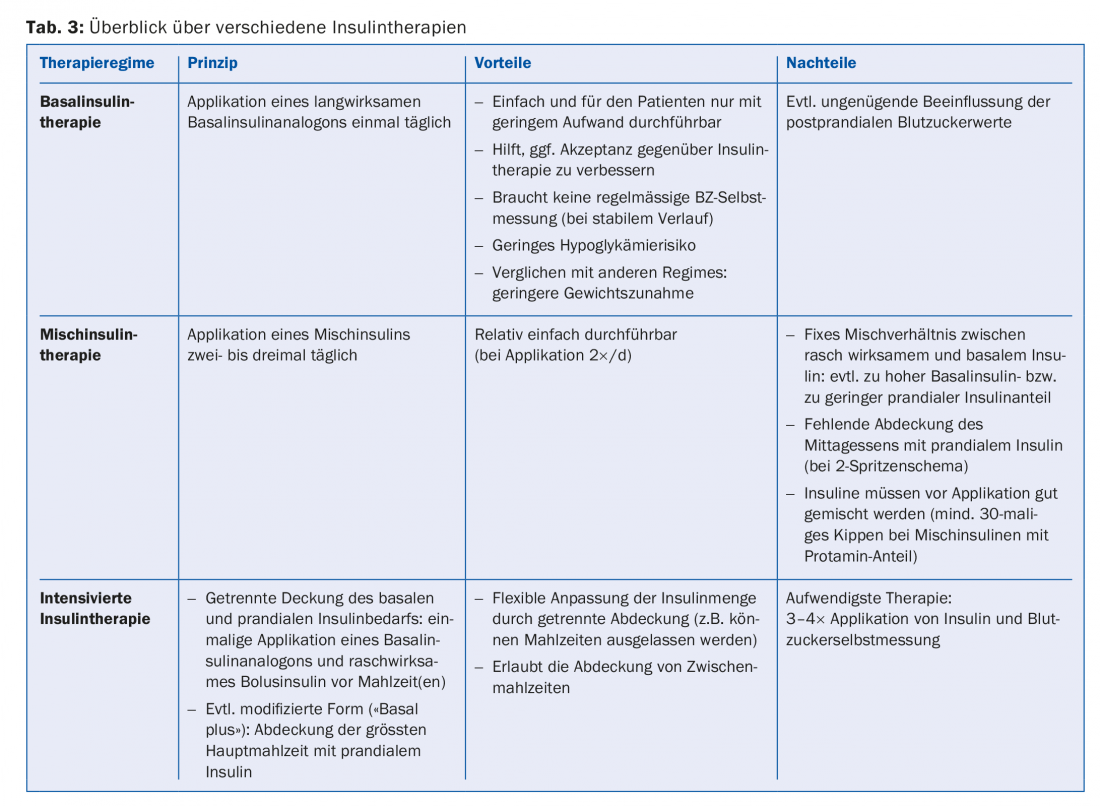
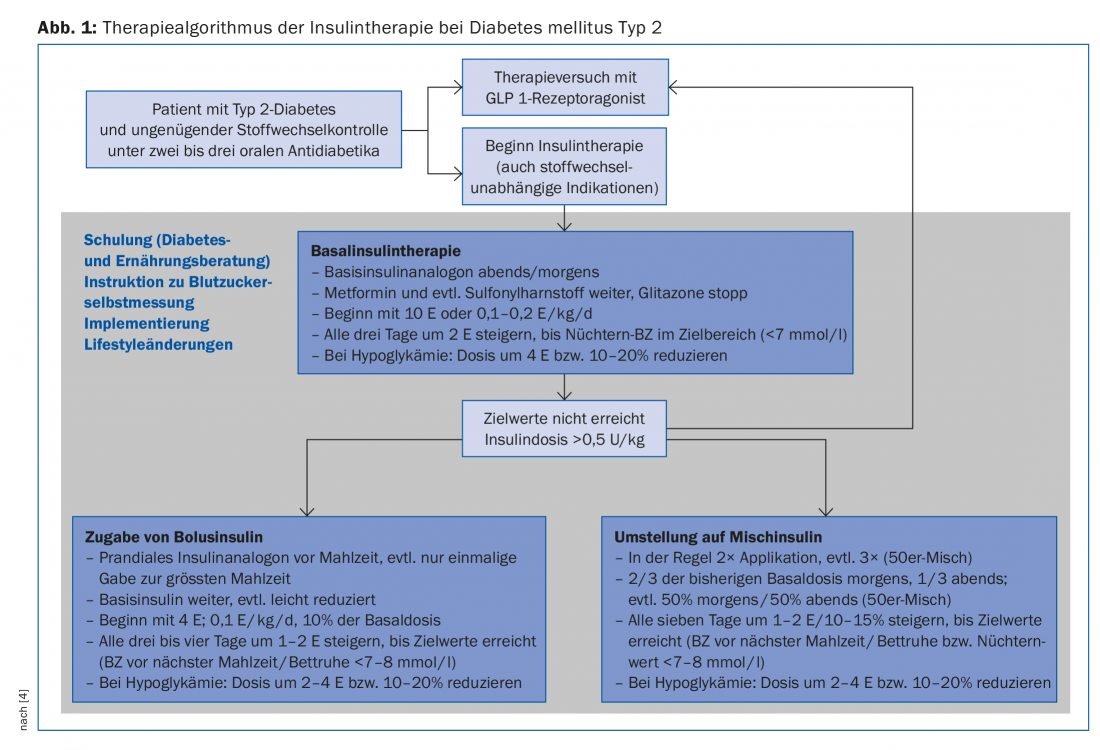
In una prima fase, quindi, si sceglie di solito una terapia insulinica basale, che viene intensificata solo se non si raggiungono i valori target o se la terapia insulinica si deteriora di nuovo (Fig. 1).
La motivazione o l’aderenza alle terapie iniettabili per il diabete è fondamentale per il successo del trattamento. La terapia insulinica spesso comporta un cambiamento drastico del concetto di trattamento per il paziente; la terapia deve essere adattata alle risorse specifiche del paziente e richiede una notevole formazione da parte di un team interdisciplinare.
Gli effetti collaterali possono peggiorare significativamente l’aderenza e devono essere evitati il più possibile fin dall’inizio e discussi con il paziente già prima dell’inizio della terapia. Il rischio di ipoglicemia può essere ridotto in modo decisivo attraverso l’aggiustamento della dose e la formazione (ad esempio, la prevenzione delle situazioni a rischio, la riduzione della dose di insulina dopo uno sforzo fisico, la titolazione lenta della dose). L’aumento di peso è da un lato espressione del miglioramento del controllo metabolico (riduzione della glucosuria), ma può avere anche altre ragioni, ad esempio l’assunzione di spuntini per prevenire l’ipoglicemia. Nella pratica clinica, questo effetto collaterale è probabilmente uno dei motivi più frequenti di fallimento della terapia insulinica o uno dei fattori più importanti per cui la terapia insulinica viene rifiutata o iniziata troppo tardi. Le terapie di combinazione con le terapie antidiabetiche più recenti – oltre a sottolineare l’importanza dei cambiamenti dello stile di vita in questa situazione – possono avere un ulteriore effetto di supporto in questo caso.
Terapia insulinica basale
La terapia di gran lunga più semplice da eseguire è la terapia insulinica basale (Fig. 2), che viene eseguita come terapia aggiuntiva alla terapia esistente con farmaci antidiabetici orali. I farmaci antidiabetici orali – con l’eccezione dei glitazoni – vengono solitamente superati; in particolare, la combinazione con la metformina ha un effetto di risparmio insulinico [13]. Le sulfoniluree aiutano a controllare i livelli postprandiali di glucosio nel sangue, ma possono aumentare il rischio di ipoglicemia se associate all’insulina. Inoltre, diventano sempre più inefficaci con l’aumento della durata del diabete e la diminuzione della funzione delle cellule beta.
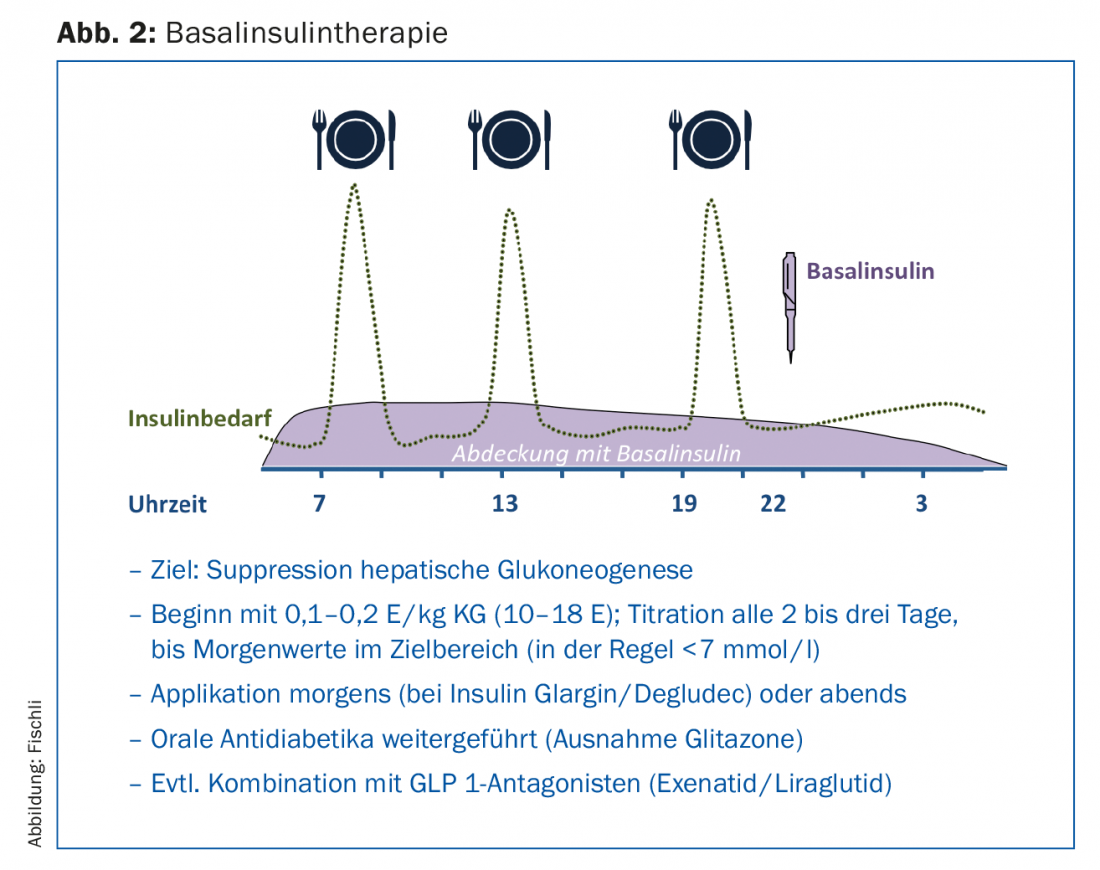
L’applicazione di un analogo dell’insulina basale a lunga durata d’azione inibisce principalmente la gluconeogenesi epatica e quindi riduce i livelli elevati di glucosio nel sangue a digiuno e i livelli nella fase post-assorbitiva. Con valori di HbA1c superiori all’8,5%, i valori elevati di glicemia a digiuno influenzano in particolare la situazione metabolica [14], motivo per cui la terapia insulinica basale migliora in modo decisivo il controllo della glicemia anche in queste situazioni. Negli studi, glargine [15] o insulina detemir [16] in combinazione con metformina hanno raggiunto un valore di HbA1c inferiore al 7% in circa due terzi dei pazienti. Al momento del dosaggio, occorre notare che l’insulina viene aumentata gradualmente fino a raggiungere i valori target (strategia “treat to target”). Questo aumento può essere effettuato dal paziente stesso con una formazione adeguata (Fig. 1).
Rispetto alla terapia insulinica prandiale o mista, la terapia insulinica di base offre i vantaggi di un minor aumento di peso e il minor rischio di ipoglicemia [17]. Soprattutto per i conducenti di veicoli a motore, quest’ultimo punto è fondamentale. Nel 2015, un gruppo di lavoro interdisciplinare ha rivisto le linee guida sull’idoneità alla guida e sulla capacità di guida nel diabete mellito [18]. Le persone senza fattori di rischio (cioè nessun disturbo di sensibilizzazione all’ipoglicemia e nessuna storia di ipoglicemia grave) che vengono trattate esclusivamente con un analogo dell’insulina basale (ad esempio, insulina glargine o detemir) hanno un rischio complessivamente basso di ipoglicemia, motivo per cui la misurazione di routine della glicemia prima di ogni viaggio in auto non è più necessaria.
Combinazione con altri farmaci antidiabetici
La combinazione della terapia insulinica con gli inibitori della DPP IV o gli agonisti del recettore GLP 1 è possibile e offre diversi vantaggi [19]. La combinazione di insulina e analogo del GLP 1 sta diventando sempre più popolare. La sequenza, cioè quale classe di sostanze viene data per prima, non ha molta importanza. L’insulina basale può essere iniziata per prima, oppure l’insulina può essere combinata con gli agonisti del recettore GLP 1 come terapia aggiuntiva.
Dal punto di vista farmacologico, entrambe le sostanze hanno un effetto ipoglicemizzante e sinergico attraverso meccanismi diversi [20]. Tuttavia, l’influenza dell’agonista del recettore GLP 1 sulla regolazione centrale dell’appetito e della sazietà aiuta a prevenire l’aumento di peso in caso di terapia insulinica. Un numero sempre maggiore di dati supporta anche i benefici di tale terapia combinata in termini di progressione del peso, controllo metabolico e rischio di ipoglicemia [21].
In Svizzera, exenatide (Byetta®) e liraglutide (Victoza®) sono approvati per la combinazione con l’insulina di base; liraglutide è disponibile anche come combinazione fissa con insulina degludec (Xultophy®). Il più recente dulaglutide monosettimanale (Trulicity®) è approvato in combinazione con l’insulina prandiale. L’ultimo gruppo di farmaci antidiabetici, gli inibitori SGLT 2, hanno anche un effetto di risparmio insulinico o di riduzione del peso in combinazione con l’insulina [22].
Intensificazione della terapia insulinica
L’intensificazione o la modifica della terapia insulinica deve essere presa in considerazione se il controllo metabolico si deteriora ulteriormente o gli effetti collaterali (ipoglicemia, aumento di peso) complicano la terapia (Fig. 1). Prima di aggiungere un’insulina prandiale o di passare a un’insulina mista, vale la pena provare un agonista del recettore GLP 1 in combinazione con l’insulina di base.
L’intensificazione della terapia insulinica avviene sia aggiungendo un analogo dell’insulina ad azione rapida prima dei pasti, come un classico regime di bolo di base, sia passando a una terapia insulinica mista. Tuttavia, quest’ultima presenta alcuni svantaggi (tab. 3) e nel confronto diretto con l’insulina di base in bolo, le insuline miste hanno prestazioni peggiori in termini di controllo metabolico [23].
Letteratura:
- Polonsky WH, et al: Resistenza psicologica all’insulina nei pazienti con diabete di tipo 2: la portata del problema. Diabetes Care 2005; 28(10): 2543-2545.
- Nakar S, et al: Transizione all’insulina nel diabete di tipo 2: la concezione errata dei medici di famiglia sulle paure dei pazienti contribuisce alle barriere esistenti. J Diabetes Complications 2007; 21(4): 220-226.
- Romano G, et al.: Terapia con insulina e sulfonilurea nei pazienti con NIDDM. Gli effetti sul metabolismo delle lipoproteine sono diversi anche con un controllo simile della glicemia? Diabete 1997; 46(10): 1601-1606.
- Inzucchi SE, et al: Gestione dell’iperglicemia nel diabete di tipo 2, 2015: un approccio centrato sul paziente: aggiornamento di una dichiarazione di posizione dell’American Diabetes Association e dell’Associazione Europea per lo Studio del Diabete. Diabetes Care 2015; 38(1): 140-149.
- Holman RR, et al: Follow-up di 10 anni del controllo intensivo del glucosio nel diabete di tipo 2. N Engl J Med 2008; 359(15): 1577-1589.
- Gerstein HC, et al: Effetti dell’abbassamento intensivo del glucosio nel diabete di tipo 2. N Engl J Med 2008; 358(24): 2545-2559.
- Patel A, et al: Controllo intensivo della glicemia e risultati vascolari nei pazienti con diabete di tipo 2. N Engl J Med 2008; 358(24): 2560-2572.
- Duckworth W, et al: Controllo del glucosio e complicanze vascolari nei veterani con diabete di tipo 2. N Engl J Med 2009; 360(2): 129-139.
- Weng J, et al: Effetto della terapia insulinica intensiva sulla funzione delle cellule beta e sul controllo glicemico nei pazienti con diabete di tipo 2 di nuova diagnosi: uno studio multicentrico randomizzato a gruppi paralleli. Lancet 2008; 371(9626): 1753-1760.
- Harris MI, Robbins DC: Prevalenza dell’IDDM dell’adulto nella popolazione statunitense. Diabetes Care 1994; 17(11): 1337-1340.
- Laugesen E, et al: Diabete autoimmune latente dell’adulto: conoscenze attuali e incertezze. Diabet Med J Br Diabet Assoc 2015; 32(7): 843-852.
- Wallia A, Molitch ME: Terapia insulinica per il diabete mellito di tipo 2. JAMA 2014; 311(22): 2315-2325.
- Hemmingsen B, et al: Confronto tra metformina e insulina rispetto alla sola insulina per il diabete di tipo 2: revisione sistematica degli studi clinici randomizzati con meta-analisi e analisi sequenziali degli studi. BMJ 2012; 344: e1771.
- Monnier L, et al.: Contributi degli aumenti di glucosio plasmatico a digiuno e postprandiale all’iperglicemia globale diurna dei pazienti diabetici di tipo 2 Variazioni con l’aumento dei livelli di HbA1c. Diabetes Care 2003; 26(3): 881-885.
- Riddle MC, et al: Lo studio treat-to-target: aggiunta randomizzata di glargine o di insulina umana NPH alla terapia orale dei pazienti diabetici di tipo 2. Diabetes Care 2003; 26(11): 3080-3086.
- Hermansen K, et al: Uno studio di 26 settimane, randomizzato, parallelo, treat-to-target, che confronta l’insulina detemir con l’insulina NPH come terapia aggiuntiva ai farmaci orali per abbassare il glucosio nelle persone insulino-naive con diabete di tipo 2. Diabetes Care 2006; 29(6): 1269-1274.
- Holman RR, et al: Efficacia a tre anni dei regimi insulinici complessi nel diabete di tipo 2. N Engl J Med 2009; 361(18): 1736-1747.
- http://sgedssed.ch/fileadmin/files/6_empfehlungen_fachpersonen/61_richtlinien_fachaerzte/Neue-Auto-Richtlinien_SGED_15-11-24_DE-DEFkorr.pdf
- Yki-Järvinen H, et al: Effetti dell’aggiunta di Linagliptin ai regimi di insulina basale per il diabete di tipo 2 non adeguatamente controllato. Diabetes Care 2013; 36(12): 3875-3881.
- Del Prato S: Combinazione a rapporto fisso di insulina basale e agonista del recettore GLP-1: due è meglio di uno? Lancet Diabetes Endocrinol 2014; 2(11): 856-858.
- Eng C, et al: Trattamento combinato di agonista del recettore del glucagone-like peptide-1 e insulina basale per la gestione del diabete di tipo 2: una revisione sistematica e una meta-analisi. Lancet 2014; 384(9961): 2228-2234.
- Nauck MA: Aggiornamenti sugli sviluppi degli inibitori SGLT2 nella gestione del diabete di tipo 2. Drug Des Devel Ther 2014; 8: 1335-1380.
- Giugliano D, et al.: Efficacia degli analoghi dell’insulina nel raggiungimento dell’obiettivo di emoglobinaA1c di <7% nel diabete di tipo 2: meta-analisi di studi controllati randomizzati. Diabetes Care 2011; 34(2): 510-517.
PRATICA GP 2016; 11(5): 8-14