I pazienti con melanoma metastatico non resecabile con mutazione BRAFV600 devono prima essere valutati per l’idoneità all’immunoterapia. Oltre all’inibizione del checkpoint, anche la terapia mirata con inibitori di BRAF-MEK è oggi un’opzione terapeutica consolidata. In Svizzera sono attualmente disponibili tre combinazioni di inibitori BRAF e MEK. Sia in termini di efficacia che di tollerabilità, l’uso combinato ha dimostrato di essere superiore alla monoterapia.
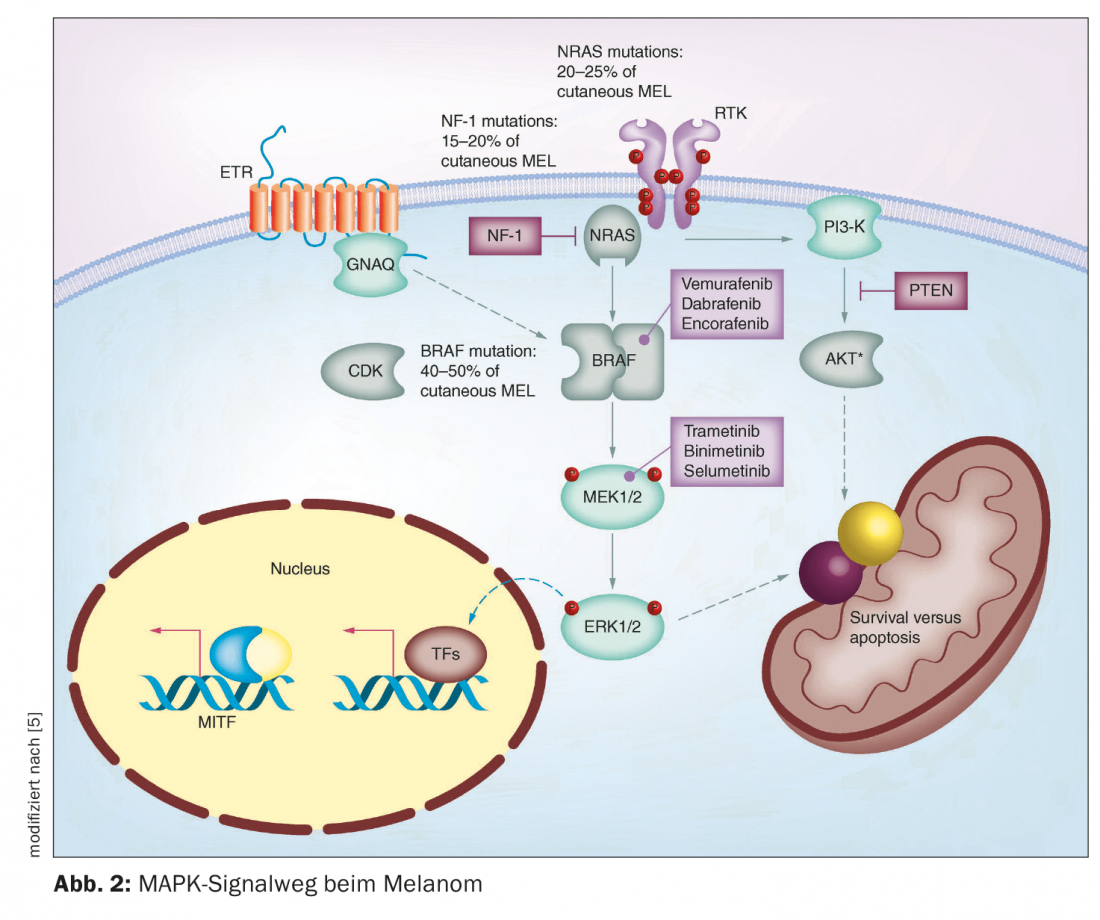
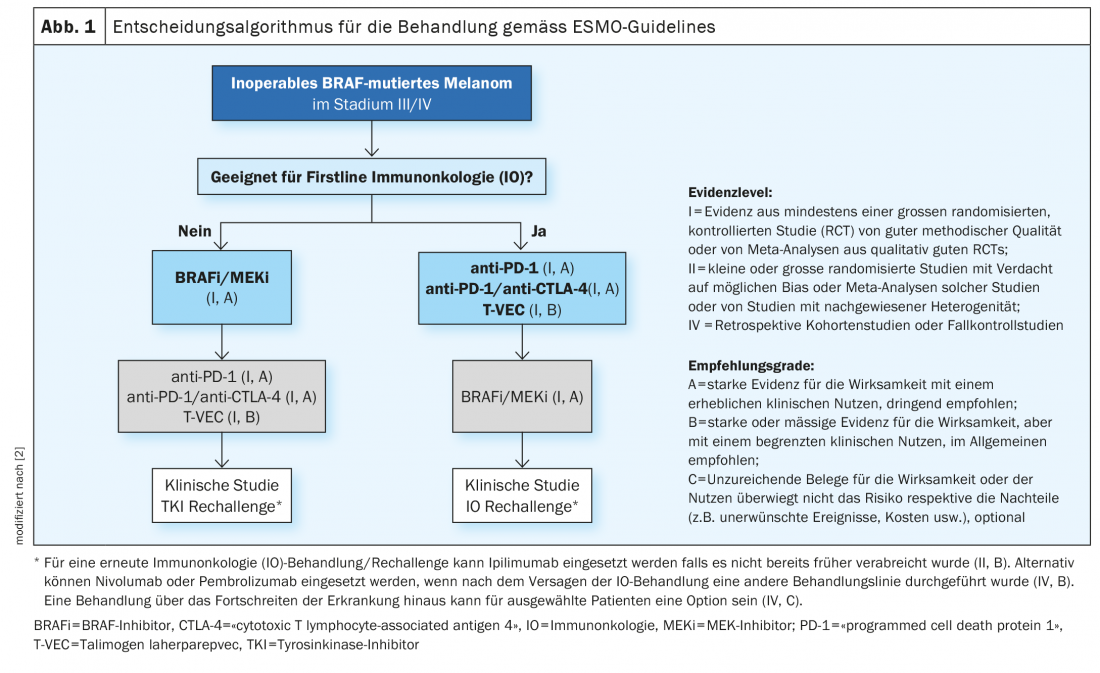
Negli ultimi anni, sono state raggiunte diverse scoperte nel campo della terapia del melanoma maligno. Fino a circa la metà degli anni ’90, erano disponibili solo le chemioterapie. Questi impediscono la crescita o la divisione cellulare in modo relativamente aspecifico e quindi a volte causano effetti collaterali considerevoli [1]. L’approvazione sul mercato di terapie immuno-oncologiche e mirate ha cambiato in modo decisivo le opzioni di trattamento del melanoma metastatico non operabile. Nei pazienti affetti da melanoma con metastasi non resecabili, l’opzione dell’immunoterapia con inibitori del checkpoint deve essere considerata per prima. Se i pazienti sono idonei per l’immunoterapia, le attuali linee guida ESMO raccomandano l’immunoterapia con inibitori del checkpoint come terapia di prima linea (Fig. 1) [2]. Nel melanoma metastatico non resecabile mutato in BRAF, tuttavia, è possibile utilizzare anche una terapia mirata con inibizione di BRAF/MEK. Sia l’inibizione del checkpoint che la terapia mirata presentano vantaggi e svantaggi [3]. Prof. Dr. med. Reinhard Dummer, Vice Capo del Dipartimento. Direttore della Clinica Dermatologica e Responsabile del Centro Tumori della Pelle dell’Ospedale Universitario di Zurigo, ha riassunto i fatti importanti sull’inibizione di BRAF/MEK in occasione delle Giornate di Formazione in Dermatologia di quest’anno [4]. Questa terapia combinata mirata inibisce la via di segnalazione della “proteina chinasi attivata dal mitogeno” (MAPK), che viene continuamente attivata nelle mutazioni BRAFV600 (Fig. 2) [5].
Analisi di mutazione per il rilevamento di uno stato di mutazione BRAFV600E/K
Lo stato di mutazione BRAFV600E/K è un prerequisito per l’uso degli inibitori BRAF/MEK. BRAF è la mutazione più comune nel melanoma, che si verifica in genere nei pazienti più giovani. Spesso si tratta di pazienti che hanno molti nevi. In particolare, i nevi melanocitici più piccoli e acquisiti hanno una frequenza molto elevata di mutazioni BRAF, afferma il Prof. Dummer. Nel melanoma localmente avanzato o metastatico di stadio III e IV, è necessario eseguire una diagnosi di patologia molecolare per determinare lo stato di BRAF. [6]. L’analisi della mutazione BRAF può essere eseguita su materiale bioptico o su punzoni delle aree cutanee interessate, nonché su materiale tumorale fissato e incorporato in paraffina [7]. Utilizzando la tecnica della PCR, le regioni rilevanti del gene BRAF possono essere amplificate dal DNA genomico e analizzate mediante sequenziamento del DNA [8]. Secondo la Classificazione Genomica del Melanoma Cutaneo, si può fare una suddivisione in quattro sottotipi, che hanno diverse prevalenze: Melanoma con mutazione BRAF (50%), mutazione N-Ras, K-Ras o H-Ras (25%), mutazione NF1 (15%) e melanoma triplo wild-type (10%) [9]. Il gene BRAF codifica per la serina-treonina-proteina chinasi BRAF. Questo svolge un ruolo nella regolazione della crescita cellulare attraverso le vie di segnalazione della MAP chinasi e di Ras-Raf. Una mutazione con scambio dell’amminoacido valina in posizione V600 con la glutammina (V600E) o con la lisina (V600K) nella proteina BRAF aumenta costitutivamente l’attività della chinasi BRAF [7]. Di conseguenza, viene attivata in modo permanente una cascata di segnalazione, che porta a una crescita cellulare incontrollata.
Quali terapie con inibitori BRAF/MEK sono disponibili in Svizzera?
Prima che le combinazioni di inibitori BRAF e MEK arrivassero sul mercato, gli inibitori BRAF sono stati testati per la prima volta negli studi clinici come monoterapia rispetto alla chemioterapia. Gli inibitori della chinasi sono risultati di gran lunga superiori, con un hazard ratio (HR) di 0,37 a favore di dabrafenib e 0,38 a favore di vemurafenib. “Questo significa un miglioramento di oltre il 60% dell’intervallo libero da progressione con questi inibitori. Si tratta di una differenza enorme”, ha spiegato il Prof. Dummer. Il passo successivo è stato quello di combinare gli inibitori BRAF e MEK negli studi clinici. La somministrazione aggiuntiva di un inibitore MEK a un inibitore BRAF dovrebbe prevenire lo sviluppo precoce della resistenza attraverso la riattivazione della cascata MAPK e l’attivazione paradossale di queste vie di segnalazione nelle cellule sane senza mutazione del gene BRAF [10].
Sono stati condotti studi clinici, in ogni caso secondo il principio della monoterapia rispetto alla terapia combinata, dove si è sempre riscontrato un chiaro vantaggio a favore dell’applicazione combinata. Le terapie combinate BRAF-i/MEK-i hanno una tollerabilità simile o migliore rispetto alla monoterapia con BRAF-i, spiega il relatore [4]. Attualmente, in Svizzera sono disponibili tre combinazioni BRAF-i/MEK-i: Dabrafenib/trametinib, vemurafenib/cobimetinib, encorafenib/binimetinib. “Per il triplo trattamento, utilizziamo principalmente vemurafenib/cobimetinib. Per i pazienti che diventano progressivi direttamente dopo l’immunoterapia, encorafenib/binimetinib e nel contesto adiuvante, abbiamo dati molto buoni per dabrafenib/trametinib”, spiega il Prof. Dummer e aggiunge: “Abbiamo anche risultati molto buoni per la combinazione dabrafenib/trametinib per le metastasi cerebrali” [4].

Encorafenib ha proprietà farmacologiche benefiche
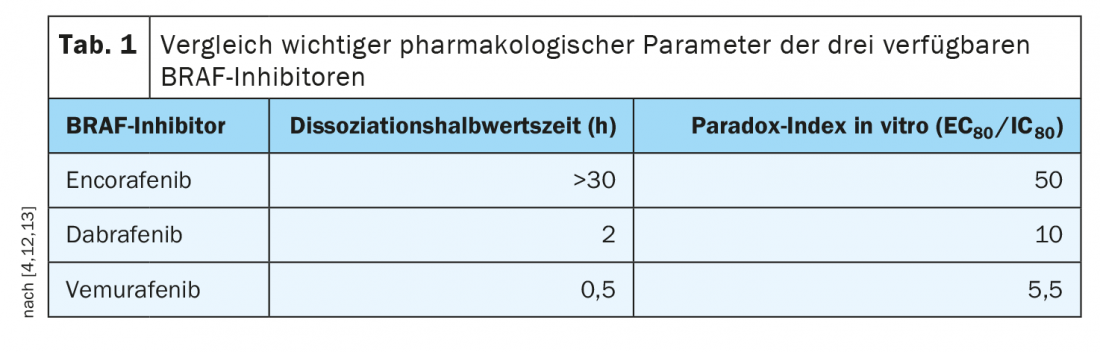
I profili di tollerabilità delle diverse terapie combinate differiscono un po’; questo dovrebbe essere discusso con i pazienti. Per esempio, è dimostrato che il rischio di piressia (febbre) e fotosensibilità è minore con encorafenib/binimetinib, e c’è una buona esperienza di utilizzo a lungo termine. Mentre con vemurafenib l’inibizione del percorso è strettamente correlata al livello sierico, con encorafenib il livello sierico può diminuire ma l’inibizione rimane. Questo si estende per più di 30 ore. Questa emivita di dissociazione particolarmente lunga di encorafenib (Tab. 1), significa un blocco stabile della via di segnalazione e questo è clinicamente rilevante, sottolinea il Prof. Dummer [4]. Inoltre, i valori dell’indice Paradox, che misura gli effetti collaterali sulle cellule sane (cioè quelle senza mutazione del gene BRAF), erano favorevoli per encorafenib, ha detto il relatore. L’uso combinato di encorafenib con l’inibitore MEK binimetinib consente un aumento della dose di encorafenib e un ulteriore incremento dell’efficacia. “Poiché l’inibitore MEK migliora la tollerabilità, la dose di encorafenib può essere aumentata in combinazione con binimetinib”, spiega il Prof. Dummer [4]. Questo è stato studiato nello studio di fase III COLUMBUS a tre bracci [11]. Questo confronto tra encorafenib 450 mg (1×/d) più binimetinib 45 mg (2×/d) con encorafenib 300 mg (1×/d) più vemurafenib 960 mg (2×/d). Sono stati inclusi in totale 577 pazienti con melanoma avanzato/metastatico BRAFV600-mutato di nuova diagnosi o con progressione dopo l’immunoterapia di prima linea. La terapia combinata mirata di encorafenib più binimetinib (COMBO450) si è dimostrata significativamente superiore alla monoterapia con vemurafenib o encorafenib, con una PFS mediana di 14,9 mesi. Per quanto riguarda i rischi di effetti collaterali, ora si sa che la retinopatia associata a MEK-i è completamente regressiva e non c’è alcun danno permanente alla retina anche con l’uso a lungo termine, dice il Prof. Dummer. Se i pazienti sperimentano effetti collaterali, questi possono essere trattati localmente con agenti antinfiammatori e di solito scompaiono dopo poco tempo.
Congresso: Giornate di formazione dermatologica di Zurigo
Letteratura:
- “Präzisionsonkologie – Entwicklung der medikamentösen Krebstherapie bis hin zur personalisierten Krebstherapie”, Dr. Thomas Kubin, www.kliniken-suedostbayern.de/files/PDF-Dokumente/oz/Newsletter_OnkoKrebszentr_3_2021_web.pdf, (ultimo accesso 14.09.2022)
- Michielin O, et al: Melanoma cutaneo: Linee guida di pratica clinica ESMO per la diagnosi, il trattamento e il follow-up. Ann Oncol 2019; 30(12): 1884-1901.
- Reschke R, et al: Comprensione della terapia e qualità della vita correlata alla salute nei pazienti con melanoma in stadio III/IV trattati con nuove terapie adiuvanti. J Dtsch Dermatol Ges 2021; 19(2): 215-222.
- “Cosa devono sapere i dermatologi sugli inibitori di BRAF e MEK nel melanoma?”, Prof. Reinhard Dummer, MD, Giornate di formazione in dermatologia di Zurigo, 16/17 giugno 2022.
- Koelblinger P, Dornbierer J, Dummer R: Una revisione di binimetinib per il trattamento del melanoma cutaneo mutante. Future Oncol 2017; 13(20): 1755-1766.
- Hoffmann M, Özdemir B: Melanoma maligno : terapia adiuvante: stato dell’arte, DERMATOLOGIE PRAXIS 2022; 32(1): 11-16.
- “Analisi delle mutazioni del melanoma maligno – la via per una terapia personalizzata”, www.wisplinghoff.de/fileadmin/user_upload/Redakteure/Drucksachen/Laborinformationen/LabInfo_Mutationsanalyse_des_malignen_Melanoms_web.pdf, (ultimo accesso 14.09.2022)
- “Determinazione dello stato di mutazione BRAF”, www.ukaachen.de/fileadmin/files/institute/pathologie/Bestimmung_des_BRAF-Mutationsstatus_v2022.pdf, (ultimo accesso 14.09.2022)
- Akbani R, et al: Classificazione genomica del melanoma cutaneo. Cellula 2015; 161(7): 1681-1696.
- Hermann RM, Christiansen H: Melanoma metastatico BRAF-mutato: primi dati sull’efficacia a lungo termine delle terapie mirate. Radiation Oncol 2019; 195: 940-942.
- Dummer R, et al: Encorafenib più binimetinib rispetto a vemurafenib o encorafenib nei pazienti con melanoma BRAF-mutante (COLUMBUS): uno studio multicentrico, in aperto, randomizzato di fase 3. Lancet Oncol 2018; 19(5): 603-615.
- Koelblinger P, Thuerigen O, Dummer R: Sviluppo di encorafenib per il melanoma avanzato BRAF-mutato. Curr Opin Oncol. 2018;30(2): 125-133.
- Adelmann C, et al.: Profili comparativi degli inibitori BRAF: l’indice di paradosso come predittore di tossicità clinica. Oncotarget 2016; 7: 30453-30460.
PRATICA DERMATOLOGICA 2022; 32(5): 43-45