Analogamente alla linea guida S3 del DKG 2014, si possono formulare raccomandazioni a seconda della fase. Stadio I: in questo caso, la sola escissione mesorettale totale (TME) è standard. Stadio II e III: la radio(chemio)terapia preoperatoria è standard nel trattamento del cancro rettale localmente avanzato. Questa terapia dimezza il tasso di recidiva locale, indipendentemente dalla procedura chirurgica. Se la terapia a lungo termine è pianificata come radiochemioterapia, la chemioterapia deve essere a base di 5-FU. La radiochemioterapia a lungo termine porta al ridimensionamento e al downstaging e quindi consente una migliore operabilità.
Nel trattamento multimodale del cancro del retto, la radiochemioterapia/radioterapia a breve termine è parte integrante negli stadi II e III. Negli ultimi decenni, si è passati dal trattamento adiuvante a quello neoadiuvante, per ridurre al minimo gli effetti collaterali e i tassi di recidiva locale.
Classificazione
La definizione internazionale è la seguente: I tumori localizzati a 16 cm o meno dalla linea anocutanea, misurati con l’endoscopio rigido, sono classificati come carcinomi rettali. Si divide in terzo inferiore: 0-6 cm, terzo medio: 6-12 cm e terzo superiore 12-16 cm.
Fattori di rischio
L’obesità, la mancanza di esercizio fisico e il fumo sono considerati fattori di rischio per lo sviluppo del cancro rettale. Ci sono anche prove che le diete a basso contenuto di fibre e ad alto contenuto di grassi aumentano l’incidenza del cancro al retto. Ad oggi non è possibile raccomandare misure dietetiche specifiche [1,2].
Qualsiasi adenoma confermato istologicamente aumenta il rischio di cancro del colon-retto, soprattutto gli adenomi multipli (≥3) o gli adenomi grandi (>1 cm).
Anche i parenti di primo grado con cancro del colon-retto sono un fattore di rischio. In questo caso, i parenti dovrebbero sottoporsi a uno screening del cancro colorettale dieci anni prima del paziente indice.
La colite ulcerosa comporta una maggiore probabilità di sviluppare il cancro del colon-retto rispetto alla popolazione normale. Le raccomandazioni corrispondenti per la diagnosi e la terapia sono disponibili in una linea guida S3 [3].
Screening del cancro all’intestino
Lo screening del cancro all’intestino è generalmente raccomandato a partire dai 50 anni. La colonscopia completa ha la massima sensibilità e specificità per trovare carcinomi e adenomi e dovrebbe quindi essere utilizzata come procedura standard [3]. Non ci sono limiti di età superiori chiari [4]. Si devono prendere in considerazione anche le malattie concomitanti [5].
Diagnostica
La risonanza magnetica e l’endosonografia sono considerate la diagnostica per immagini di scelta per valutare lo stato nodale preoperatorio e l’estensione del tumore primario. Un problema fondamentale è la potenziale “sovrastadiazione” nella diagnostica preoperatoria, soprattutto quando si valuta lo stato nodale. Una possibile metastasi viene chiarita mediante l’imaging trasversale. La conferma istologica avviene mediante biopsia durante la rettoscopia.
Concetti di terapia
La terapia multimodale del cancro del retto è interdisciplinare. La posizione del tumore ha un’influenza. La terapia del carcinoma rettale nel terzo inferiore e medio è ampiamente standardizzata [3], mentre la terapia del carcinoma rettale nel terzo superiore è uguale a quella del carcinoma rettale nel terzo medio e inferiore o analoga a quella del carcinoma del colon [3]. Quest’ultimo aspetto è supportato dai risultati dello studio TME, che non aveva mostrato alcun beneficio significativo dalla radioterapia nel terzo superiore (10-15 cm dall’anocutanea) rispetto alla sola chirurgia [6]. Lo studio tedesco CAO/ARO/AIO-94, invece, non ha mostrato differenze per quanto riguarda il tasso di recidiva locale nei rispettivi terzi, per cui, analogamente, il trattamento di tutti i carcinomi rettali sarebbe lo stesso [7].
Radio/radiochemioterapia neoadiuvante
L’indicazione alla radioterapia deve essere data a partire dallo stadio preoperatorio uT3 o da qualsiasi stadio N+ (stadio UICC II e III). In linea di principio, la radiochemioterapia neoadiuvante , eventualmente la sola radioterapia a breve termine, è raccomandata per ogni paziente in questa situazione [3]. Un’analisi Cochrane pubblicata nel 2011, che ha incluso 9410 pazienti e dodici studi randomizzati, ha dimostrato una riduzione del 50% del rischio relativo di recidiva locale con la radioterapia neoadiuvante a breve termine e anche con la radiochemioterapia neoadiuvante rispetto alla sola escissione mesorettale totale (TME) negli stadi II e III secondo l’UICC.
[8].
Irradiazione a breve termine vs. irradiazione a lungo termine
Il regime a breve termine 5× 5 Gy non porta alla contrazione del tumore. La tossicità tardiva tende ad aumentare rispetto alla sola chirurgia o al trattamento a lungo termine. L’operazione viene eseguita dopo la radioterapia a breve termine, una settimana dopo il completamento della radioterapia. Questa opzione di trattamento riduce quindi l’intervallo pre-trattamento. In caso di chemioterapia intensiva pianificata, ad esempio in presenza di metastasi linfonodali estese o di metastasi a distanza, questo concetto non comporta quindi un ritardo nella terapia sistemica [3]. La radioterapia a breve termine può essere presa in considerazione anche se il downstaging non è desiderato o necessario, ad esempio nel caso di tumori T3 N0 che possono essere operati bene [3,9,10].
Uno studio polacco aveva dimostrato una risposta significativamente migliore con il trattamento a lungo termine nel confronto tra irradiazione preoperatoria a lungo termine e irradiazione a breve termine, sia in termini di downstaging e di ridimensionamento, sia in termini di conservazione dello sfintere e di resezione R0 [11].
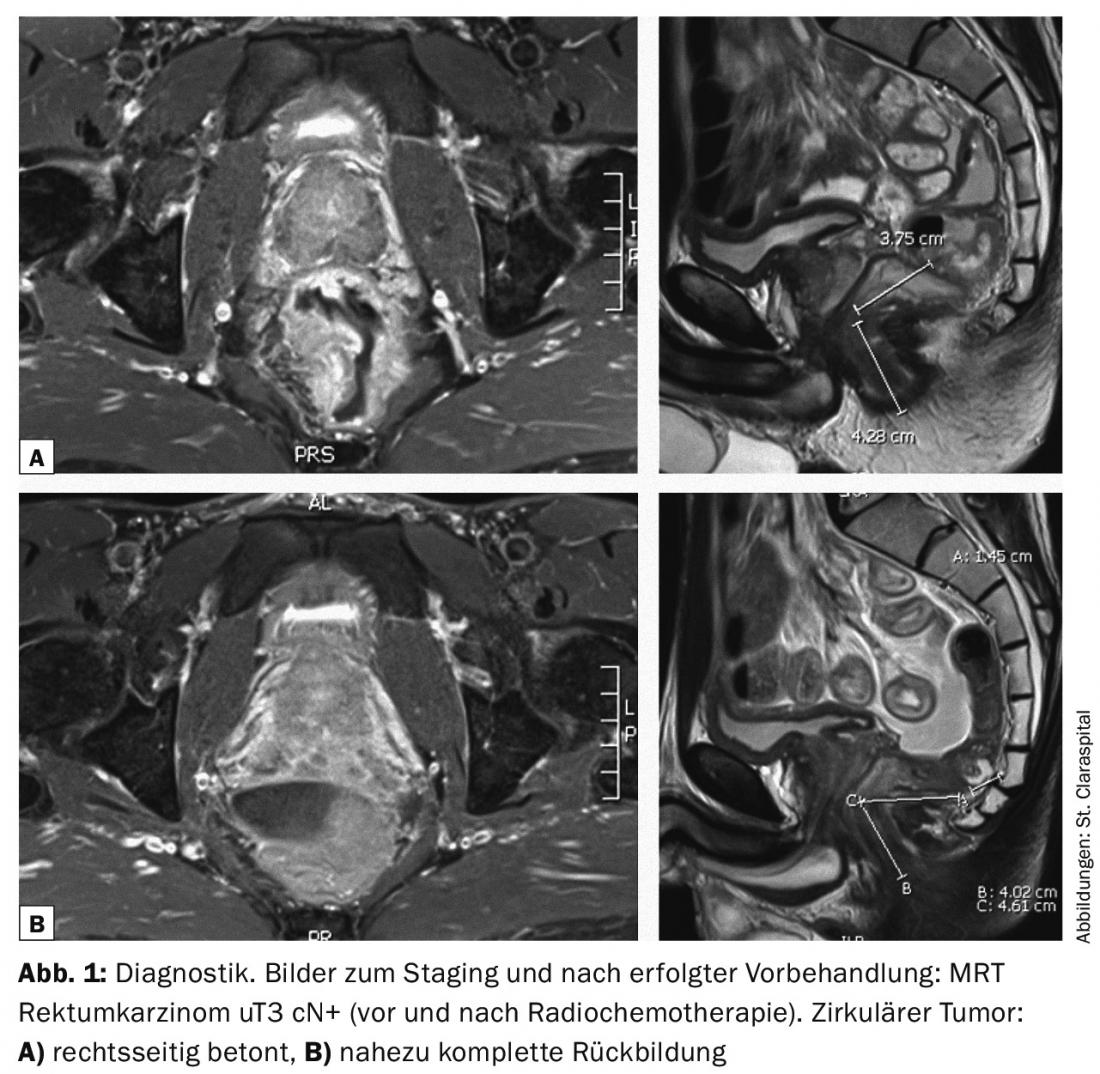
La radiochemioterapia preoperatoria a lungo termine, della durata di cinque o cinque settimane e mezzo, mira quindi a ridurre il tumore (Fig. 1 e 2 ) e quindi a migliorare l’operabilità; nel caso di tumori rettali profondi, mira anche a preservare lo sfintere [3]. L’operazione viene poi eseguita qui a intervalli di sei-otto settimane. Anche intervalli più lunghi dopo il trattamento preoperatorio sembrano ragionevoli.

La radiochemioterapia neoadiuvante dovrebbe essere con 5-FU
essere basato [3]. Due grandi studi hanno analizzato il beneficio aggiuntivo della chemioterapia rispetto alla radioterapia neoadiuvante, entrambi con 5-FU. Studi recenti hanno combinato la capecitabina con l’oxaliplatino e/o l’irinotecan e non hanno mostrato alcun beneficio aggiuntivo con un aumento della tossicità [12–14].
Radio/radiochemioterapia adiuvante
La radiochemioterapia postoperatoria , che è stata raccomandata per molti anni, mostra una maggiore tossicità e una minore efficacia rispetto ai metodi preoperatori [15]. Di solito viene presa in considerazione solo se viene rilevato uno stadio tumorale più elevato dalla chirurgia primaria, quindi con l’indicazione alla radio-chemioterapia [3].
La sola radiazione postoperatoria riduce il tasso di recidiva locale, ma non ha alcun effetto sulla sopravvivenza globale [16].
La sola chemioterapia postoperatoria, in caso di controindicazioni alla radioterapia (ad esempio, precedente irradiazione della prostata o in caso di irradiazione st.n. di tumori ginecologici), riduce anche il rischio di recidiva, ma è inferiore alla radiochemioterapia combinata postoperatoria [17].
Volume e dosaggio target
La posizione di irradiazione in posizione prona offre spesso dei vantaggi rispetto alla posizione di irradiazione in posizione supina, grazie alla migliore protezione dell’intestino tenue nella “ventroposizione”/spostamento dell’intestino tenue nell’incavo della tavola perforata (Fig. 3). Bisogna anche assicurarsi che la vescica sia ben riempita, perché questo può anche consentire lo spostamento dell’intestino tenue in senso craniale.

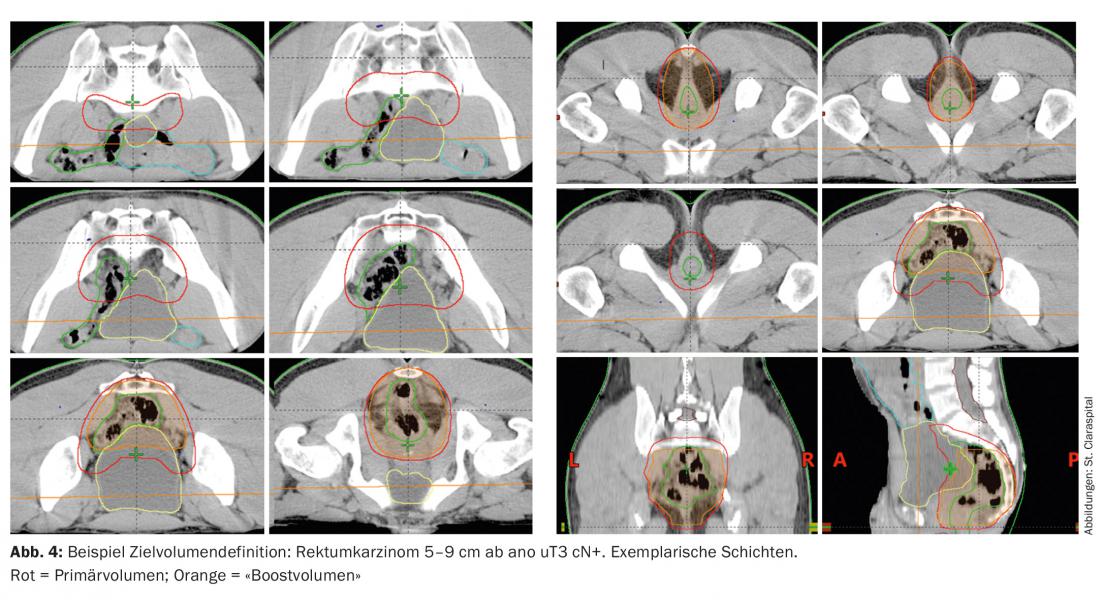
Il volume target comprende l’intero tumore, incluso il mesoretto con i linfonodi presacrali e iliaci (definizione del volume target Fig. 4). Nel caso di tumori del retto superiore e medio, lo sfintere deve essere escluso per evitare insufficienze post-terapeutiche e incontinenza [3]. In caso di tumori profondi e di infiltrazione della pelle, si deve prendere in considerazione l’irradiazione dei linfonodi inguinali, poiché in questo caso l’infiltrazione linfonodale può verificarsi nella regione inguinale.
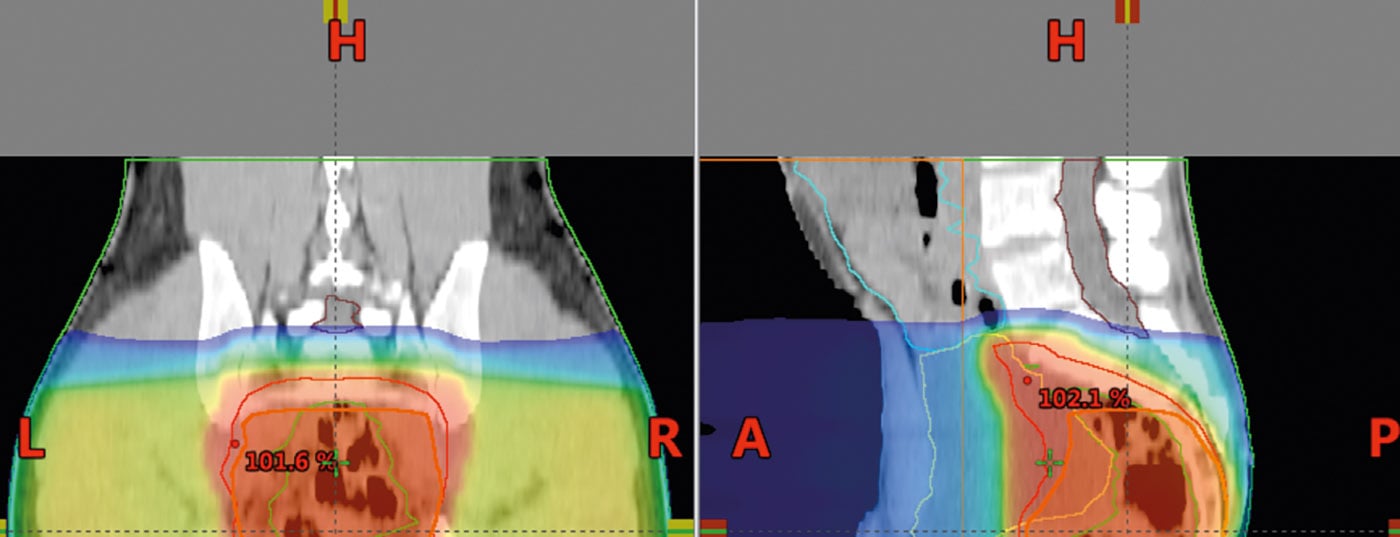
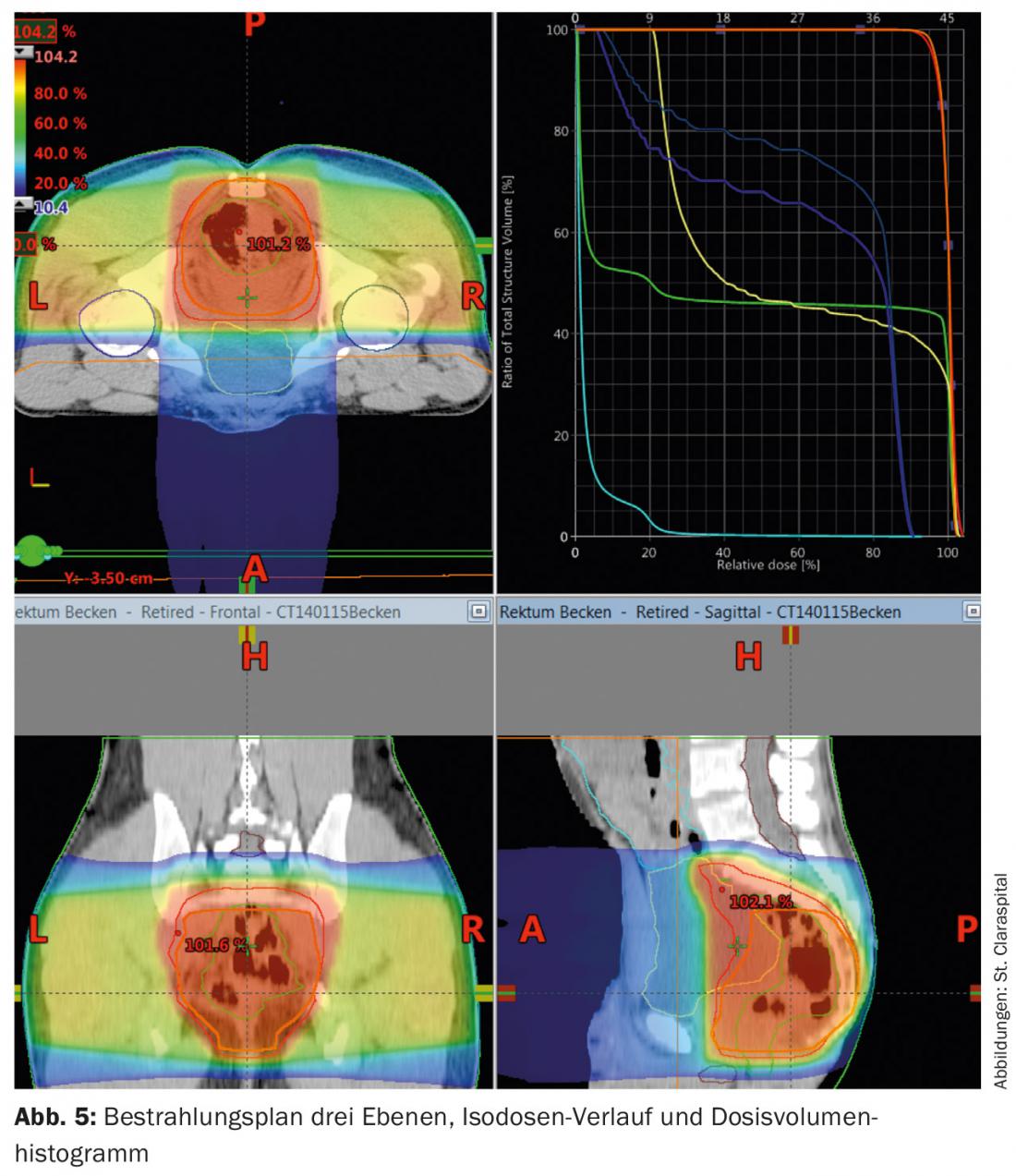
La tomografia computerizzata viene utilizzata per la pianificazione delle radiazioni. Questi vengono utilizzati per calcolare la dose e per definire l’area da irradiare (“definizione del volume bersaglio”). La dose per l’irradiazione a lungo termine è di 45-50,4 Gy con dosi individuali di 1,8 Gy, nel post-operatorio anche 45-50,4 Gy (Fig. 5) . Un “concetto di spinta” e l’omissione delle strutture a rischio dopo 45 Gy offrono la possibilità di ridurre la tossicità.
La radioterapia a intensità modulata (IMRT) può essere in grado di ridurre la tossicità per l’intestino tenue o altre strutture e organi ad alto rischio rispetto alla tecnica a 3 campi e dovrebbe essere utilizzata in questa situazione [18,19].
Operazione
Per il cancro rettale medio e distale, la TME (microresezione endoscopica transanale) è raccomandata come intervento radicale [3]. Questo riduce il tasso di recidiva rispetto ad altre procedure chirurgiche non radicali [20,21]. La TME parziale con una distanza di sicurezza distale sufficiente di 5 cm è un’opzione per i carcinomi del terzo superiore, grazie alla minore morbilità (consenso ESMO 2011) [3]. Recentemente, la TEM è stata valutata anche nei piccoli tumori in stadio T1-2 N0 [22,23].
Chemioterapia adiuvante
Nel post-operatorio, la raccomandazione per la chemioterapia deve seguire la stadiazione preoperatoria [3]. Questa raccomandazione è supportata dallo studio tedesco CAO/ARO/AIO-94 e dallo studio EORTC 22921, che hanno mostrato un beneficio di sopravvivenza del 6% assoluto e del 4% per la sopravvivenza libera da progressione [15]. Uno studio olandese di fase III sta attualmente analizzando la chemioterapia adiuvante con capecitabina rispetto all’osservazione dopo la radioterapia a breve termine 5× 5 Gy e la chirurgia. Regimi di chemioterapia più intensivi, ad esempio la combinazione con oxaliplatino, sono ancora in fase di valutazione.
Effetti collaterali
Questi si verificano localmente durante l’irradiazione: Diarrea, costipazione, disturbi proctitici a partire da dosi di 20-30 Gy, disuria, emorragie, perdite mucose e, nel caso di tumori profondi, epiteliolisi e, raramente in un periodo di tempo più lungo, incontinenza e impotenza, oltre ad aderenze e fibrosi di altri organi, nonché alterazione dell’equilibrio ormonale (soprattutto degli estrogeni nelle donne). Il tasso di rischio di tossicità di grado III (CTC) è del 3-11% quando si utilizzano le moderne tecniche di radioterapia. In combinazione con la chemioterapia, possono verificarsi anche effetti collaterali sistemici, come alterazioni dell’emocromo e aumento del tasso di infezioni, reazioni allergiche, nausea e vomito. Molti dei sintomi possono essere alleviati con farmaci anti-nausea/vomito, anti-diarrea e per la cura della pelle.
Letteratura:
- Ning Y, Wang L, Giovannucci EL: Un’analisi quantitativa dell’indice di massa corporea e del cancro colorettale: risultati di 56 studi osservazionali. Obes Rev 2010; 11(1): 19-30.
- Austin GL, et al: Il consumo moderato di alcol protegge dagli adenomi colorettali nei fumatori. Dig Dis Sci 2008; 53(1): 116-122.
- Linea guida DKG S3: www.krebsgesellschaft.de/leitlinien-onkologie.de, versione agosto 2014.
- Pox CP, et al: Efficacia di un programma di screening colonscopico a livello nazionale per il cancro colorettale. Gastroenterologia 2012.
- Whitlock EP, et al: Screening per il cancro del colon-retto: una revisione sistematica mirata e aggiornata per la U.S. Preventive Services Task Force. Ann Intern Med 2008; 149(9): 638-658.
- Peeters KC, et al.: Lo studio TME dopo un follow-up mediano di 6 anni: aumento del controllo locale ma nessun beneficio in termini di sopravvivenza nei pazienti irradiati con carcinoma rettale resecabile. Ann Surg 2007; 246(5): 693-701.
- Sauer R, et al: Chemioradioterapia preoperatoria rispetto a quella postoperatoria per il cancro del retto localmente avanzato: risultati dello studio tedesco CAO/ARO/AIO-94 randomizzato di fase III dopo un follow-up mediano di 11 anni. J Clin Oncol 2012; 30: 1926-1933.
- Fleming FJ, Påhlman L, Monson JR: Terapia neoadiuvante nel cancro del retto. Dis Colon Rectum 2011 Jul; 54(7): 901-912.
- Junginger T, et al.: [Carcinoma rettale: viene eseguita troppa terapia neoadiuvante? Proposte per un’indicazione più selettiva basata sulla risonanza magnetica]. Zentralbl Chir 2006; 131(4): 275-284.
- Smith N, Brown G: Stadiazione preoperatoria del cancro rettale. Acta Oncol 2008; 47(1): 20-31.
- Bujko K, et al: Conservazione dello sfintere dopo la radioterapia preoperatoria per il tumore del retto: rapporto di uno studio randomizzato che confronta la radioterapia a breve termine con la radiochemioterapia convenzionalmente frazionata.Radiother Oncol 2004; 72(1): 15-24.
- Bosset JF, et al: Chemioterapia con radioterapia preoperatoria nel cancro del retto. N Engl J Med 2006; 355(11): 1114-1123.
- Gerard JP, et al: Radioterapia preoperatoria con o senza fluorouracile e leucovorina concomitanti nei tumori rettali T3-4: risultati del FFCD 9203. J Clin Oncol 2006; 24(28): 4620-4625.
- Rödel C, Sauer R: Integrazione di nuovi agenti nel trattamento a modalità combinata per i pazienti affetti da cancro del retto. Strahlenther Onkol 2007; 183(5): 227-235.
- Sauer R, et al: Chemioterapia preoperatoria rispetto a quella postoperatoria per il cancro del retto. N Engl J Med 2004; 351(17): 1731-1740.
- Rödel C, Sauer R: Radioterapia e radiochemioterapia concomitante per il cancro del retto. Surg Oncol 2004; 13(2-3): 93-101.
- Conferenza di consenso del NIH. Terapia adiuvante per i pazienti con cancro al colon e al retto. Jama 1990; 264(11): 1444-1450.
- Parekh A, et al: Tossicità gastrointestinale acuta e risposta tumorale con la radioterapia preoperatoria a intensità modulata per il cancro del retto. Gastrointest Cancer Res 2013 Sep; 6(5-6): 137-143.
- Engels B, et al: Radioterapia preoperatoria a intensità modulata e a guida d’immagine con boost integrato simultaneo nel carcinoma rettale localmente avanzato: rapporto sulla tossicità tardiva e sull’esito. Radiother Oncol 2014 Jan; 110(1): 155-159.
- Brown CJ, Fenech DS, McLeod RS: Tecniche ricostruttive dopo la resezione rettale per il cancro del retto. Cochrane Database Syst Rev 2008; (2): CD006040.
- Fazio VW, et al: Uno studio multicentrico randomizzato per confrontare i risultati funzionali a lungo termine, la qualità della vita e le complicanze delle procedure chirurgiche per i tumori rettali bassi. Ann Surg 2007; 246(3): 481-488; discussione 488-490.
- Moore JS, et al: La microchirurgia endoscopica transanale è più efficace della tradizionale escissione transanale per la resezione di masse rettali. Dis Colon Rectum 2008; 51(7): 1026-1030; discussione 1030-1031.
- Kuhry E, et al: Risultati a lungo termine della resezione laparoscopica del cancro colorettale. Cochrane Database Syst Rev 2008; (2): CD003432.
InFo ONCOLOGIA & EMATOLOGIA 2015; 3(8): 16-19