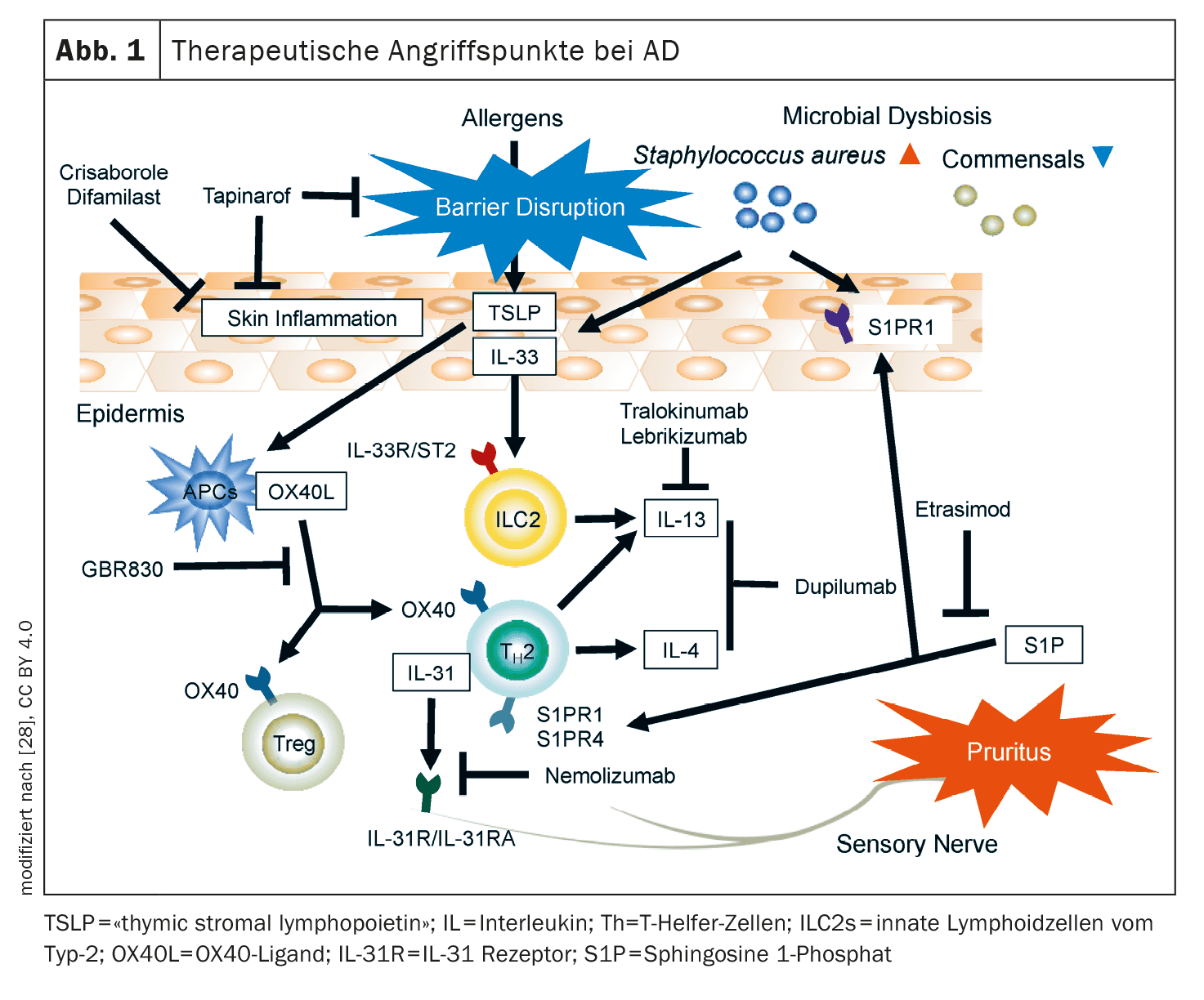
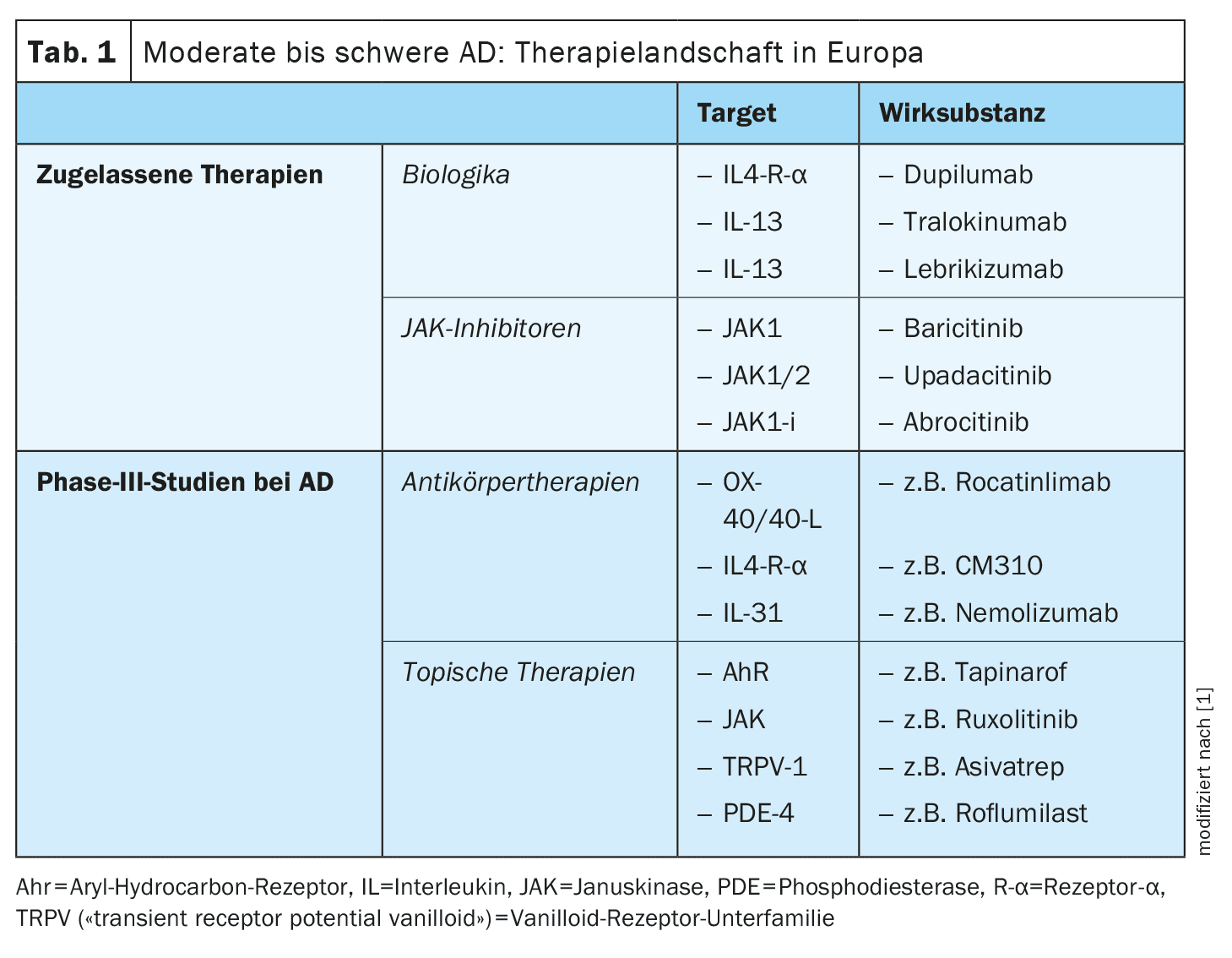
L’arsenale di sostanze attive attualmente ricercate nell’area di indicazione della dermatite atopica (AD) è considerevole. Oltre agli anticorpi anti-OX40/OX40L, al CM310, al nemolizumab e agli antagonisti del recettore 1 della neurochinina, esistono anche diverse terapie antinfiammatorie topiche, come tapinarof, ruxolitinib, delgocitinib, roflumilast, difamilast e asivatrep. Alcune di queste terapie innovative sono già state autorizzate in alcuni Paesi.
Le opzioni di trattamento per la dermatite atopica (AD) si sono ampliate in modo significativo negli ultimi anni, tanto che attualmente è disponibile un’ampia gamma di terapie topiche e sistemiche efficaci e sicure. Le esigenze e le aspettative della terapia sono aumentate: l’obiettivo non è solo quello di ottimizzare il profilo rischio-beneficio, ma anche di ottenere effetti terapeutici il più possibile duraturi. Tuttavia, i “bisogni insoddisfatti” comprendono anche alcuni sottogruppi di pazienti che non rispondono adeguatamente alle opzioni terapeutiche attualmente disponibili o non le tollerano. Anche il fattore convenienza non deve essere trascurato; il trattamento deve essere il più facile possibile da integrare nella vita quotidiana del paziente e aiutare a ottenere un miglioramento rapido e duraturo della qualità di vita. Con lo sviluppo di nuovi principi attivi, obiettivi e forme di dosaggio, si sta cercando di colmare queste lacune terapeutiche [1–3].
Nuove terapie anticorpali immunomodulanti
Tra le terapie con anticorpi, l’asse OX40/OX40L, l’IL-31 e il recettore della neurochinina-1 sui neuroni sensoriali sono bersagli promettenti per l’AD [1,2]. Inoltre, si stanno studiando nuovi rappresentanti di strutture bersaglio collaudate, come il recettore IL-4-α (IL4R-α).
Asse OX40/OX40L: OX40 è espresso sulle cellule T nella pelle lesionata dell’AD [4]. Il legame del ligando OX40 con OX40 porta alla differenziazione immunitaria T2-driven, che viene presa di mira da diversi nuovi farmaci [5].
- Rocatinlimab (AMG451/KHK4083) è un anticorpo anti-OX40L somministrato per via sottocutanea che è attualmente oggetto di studi di Fase III negli adulti con AD da moderata a grave. In uno studio di Fase IIb, il dosaggio di 300 mg ogni 2 settimane (q2w) si è dimostrato il più efficace, con una riduzione dell’EASI del 61% alla settimana 16 [3]. Gli eventi avversi ( AE) più comuni, che si sono verificati più frequentemente rispetto al placebo, sono stati piressia (17%), nasofaringite (14%) e brividi (11%) [6]. Le analisi del proteoma hanno mostrato che i mediatori associati a Th2/Th22 e al prurito sono diminuiti con il rocatinlimab alla settimana 16, accompagnati da una downregulation dei geni associati a Th2, Th1/17 e Th22 alla settimana 52.
- Altri inibitori di OX-40: attualmente in cantiere per l’AD sono GBR830 (anti-OX40), telazorlimab (ISB830) e amlitelimab (KY1005; anti-OX40L) [7].
IL-4Rα: oltre all’anticorpo IgG4 dupilumab, già approvato, che si lega all’IL-4Rα e quindi inibisce la via di segnalazione dell’IL-4 e dell’IL-13, sono attualmente in fase di sviluppo altri principi attivi.
- CBP-201: si tratta di un inibitore dell’IL-4Rα che è attualmente oggetto di due studi di Fase II (NCT04444752, NCT05017480) e ha ottenuto risultati promettenti [8]. Con CBP-201 è stato ottenuto un cambiamento medio nei punteggi EASI di -63,0% (ogni 2 settimane, q2w) e -65,4% (ogni 4 settimane, q4w), rispetto a -40,7% nel gruppo placebo [8].
- CM310: questo anticorpo anti-IL-4Rα è attualmente oggetto di studi di fase II (NCT04805411) e di fase III (NCT05265923, NCT04893707) [8].
IL-31: Questa citochina ha dimostrato di essere estremamente importante nella patogenesi del prurito e i livelli sierici di IL-31 sono correlati alla gravità dell’AD [9]. L’IL-31 è coinvolta nell’interruzione della barriera epidermica tipica dell’AD e attiva i neuroni pruricettivi, che rilasciano neuropeptidi che guidano l’infiammazione locale nella pelle attirando le cellule Th2.
Il recettore IL-31 catena α (IL-31Rα) è un importante bersaglio terapeutico che viene antagonizzato da nemolizumab [10,11]. Negli Stati Uniti, questo farmaco biologico è approvato per il trattamento della prurigo nodularis e in Giappone anche per il prurito associato all’AD in pazienti di età ≥13 anni [10,12].
- Nemolizumab: con nemolizumab 60 mg (q4w) come aggiunta alla terapia topica standard, il 66% ha ottenuto una riduzione del prurito e il 78% una riduzione dell’EASI alla settimana 68 [10]. Gli effetti collaterali più comuni sono stati la nasofaringite (33,9%) e la DA (25,2%). Attualmente sono in corso studi di Fase III di nemolizumab e studi di Fase II nei bambini (2-11 anni) con DA da moderata a grave [11].
La sostanza P (SP) e il recettore della neurochinina-1 (Nκ1R): È noto che queste tachichine sono coinvolte nella trasmissione periferica e centrale del prurito indipendente dall’istamina e che i pazienti affetti da AD presentano livelli elevati di SP nella pelle lesionata e nel siero [13,14]. Le Nκ1R sono localizzate principalmente nel ganglio della radice dorsale e nel corno dorsale del midollo spinale.
- Se gli antagonisti Nκ1R siano efficaci nella DA non è ancora del tutto chiaro, soprattutto perché aprepitant con una terapia topica standard concomitante non ha portato a un miglioramento significativo del prurito nella DA in un confronto con placebo. Al contrario, il serlopitant ha ridotto significativamente il prurito cronico nella PN [13,15]. I dati degli studi di fase III su serlopitant e tradipitant in relazione al prurito nell’AD non sono ancora stati pubblicati [14].
Nuove sostanze topiche per la terapia antinfiammatoria
Oltre alle terapie sistemiche somministrate per via sottocutanea e orale, anche le terapie antinfiammatorie topiche svolgono un ruolo importante, in particolare per i pazienti affetti da MA con una superficie corporea limitata (BSA) del 10%. Attualmente sono in fase di sviluppo avanzato gli agenti che mirano ai recettori JAK e TRPV (“transient receptor potential vanilloid”), così come gli agonisti del recettore degli idrocarburi arilici (AhR) [16].
Inibitori topici della JAK: Rispetto all’applicazione sistemica di JAK-i, l’applicazione topica comporta rischi di effetti collaterali significativamente inferiori.
- [17]Ruxolitinib: Ruxolitinib crema inibisce JAK1/2 ed è stato approvato dalla Food and Drug Administration (FDA) statunitense nel 2021 per il trattamento della DA da lieve a moderata nei bambini di età ≥12 anni. Nello studio rilevante per l’approvazione, è stata raggiunta una buona efficacia anche per quanto riguarda il prurito e anche la tollerabilità si è dimostrata buona. [17] La nasofaringite è stata segnalata come l’AE più comune.
- [18]Delgocitinib: questo JAK-i topico blocca tutte le molecole JAK ed è stato approvato per il trattamento dell’AD in Giappone nel 2020. In uno studio di fase III, un trattamento di quattro settimane con una crema allo 0,5% di delgocitinib ha portato a un miglioramento dell’infiammazione locale di circa il 45%. Gli effetti collaterali più comuni sono stati follicolite (2,4%), acne (2,2%) o irritazione (1,8%) nel sito di applicazione [19].
- Altri JAK-i topici sono attualmente in fase di studio clinico: Brepocitinib (IIb), ATI-1777, Jaktinib e SHR0302 (Fase II/III) [20].
- Tapinarof crema 1%: Si tratta di un agonista AhR che è stato approvato dalla FDA nel 2022 per il trattamento della psoriasi a placche [23]. Tapinarof modula l’espressione genica attivando i percorsi di segnalazione AhR, con conseguente downregulation dell’infiammazione di tipo 2 (IL-4, IL-13), normalizzando la barriera cutanea e contribuendo alla riduzione dello stress ossidativo. In uno studio randomizzato di fase II, in doppio cieco, della durata di 12 settimane, i pazienti adolescenti e adulti affetti da AD trattati con la crema tapinarof allo 0,5% o all’1% rispetto alla preparazione con veicolo hanno mostrato un buon miglioramento delle lesioni eczematose e del prurito [24]. Gli effetti collaterali segnalati sono stati nasofaringite, infezioni del tratto respiratorio superiore, peggioramento della DA e follicolite [24]. Gli studi di fase III su tapinarof sono attualmente in corso [22].
La fosfodiesterasi-4 (PDE4)-i topica: crisaborolo, difamilast e roflumilast inibiscono il rilascio di alcune citochine coinvolte nel processo infiammatorio e hanno dimostrato di migliorare la funzione barriera della pelle [25–27]. L’inibizione della PDE-4 provoca un aumento del cAMP, che porta a una downregulation di NFκB, un importante modulatore della produzione di citochine (ad esempio IL-4, IL-5, IL-10).
- Crisaborolo: questo inibitore topico della PDE-4 è stato autorizzato negli Stati Uniti e nell’Unione Europea, ma finora è stato disponibile sul mercato europeo solo in misura limitata.
- Roflumilast e difamilast: questi rappresentanti degli inibitori topici della PDE-4 sono attualmente in fase di ricerca e potrebbero presto essere disponibili per il trattamento dell’MA da lieve a moderato [17,22].
Antagonisti topici TRPV-1: i TRPV (“transient receptor potential vanilloid”)-1, cioè una sottofamiglia di recettori vanilloidi, si trovano sui cheratinociti, sulle cellule dendritiche e sui neuroni sensoriali e sono sovraespressi nella pelle lesionata dell’AD. Il TRPV-1 modula i processi infiammatori e il prurito istamino-dipendente e indipendente, innescando il rilascio di neuropeptidi centrali come la sostanza P e il CGRP (peptide legato al gene della calcitonina).
- Asivatrep: questo antagonista selettivo di TRPV-1 ha portato a miglioramenti nelle lesioni eczematose e nel prurito in uno studio randomizzato di fase III controllato con veicolo in pazienti di ≥12 anni con AD da lieve a moderata [21].
Letteratura:
- Müller S, Maintz L, Bieber T: Treatment of atopic dermatitis: Recently approved drugs and advanced clinical development programs. Allergy 2024; 79(6): 1501–1515.
- Buhl T, Werfel T: [Atopische Dermatitis – Perspektiven und unerfüllte medizinische Bedarfe]. JDDG 2023; 21(4): 349–354.
- Lé AM, Torres T: OX40-OX40L Inhibition for the Treatment of Atopic Dermatitis-Focus on Rocatinlimab and Amlitelimab. Pharmaceutics 2022 Dec 8; 14(12): 2753.
- Nakagawa H, et al.: Safety, tolerability and efficacy of repeated intravenous infusions of KHK4083, a fully human anti-OX40 monoclonal antibody, in Japanese patients with moderate to severe atopic dermatitis. J Dermatol Sci 2020; 99: 82–89.
- Elsner JS, et al.: The OX40 Axis is associated with both systemic and local involvement in atopic dermatitis. Acta Derm Venereol 2020; 100: adv00099.
- Guttman-Yassky E, et al.: An anti-OX40 antibody to treat moderate-to-severe atopic dermatitis: a multicentre, double-blind, placebo-controlled phase 2b study. Lancet 2022; 401(10372): 204–214.
- Clinicaltrials, https://clinicaltrials.gov, stato 2022.
- Facheris P, et al.: The translational revolution in atopic dermatitis: the paradigm shift from pathogenesis to treatment. Cell Mol Immunol 2023; 20(5): 448–474.
- Datsi A, et al.: Interleukin-31: the «itchy» cytokine in inflammation and therapy. Allergy 2021; 76: 2982–2997.
- Kabashima K, et al.: Nemolizumab plus topical agents in patients with atopic dermatitis (AD) and moderate-to-severe pruritus provide improvement in pruritus and signs of AD for up to 68 weeks: results from two phase III, long-term studies. Br J Dermatol 2022; 186: 642–651.
- Kabashima K, et al.: Trial of Nemolizumab and topical agents for atopic dermatitis with pruritus. N Engl J Med 2020; 383: 141–150.
- Keam SJ: Nemolizumab: First Approval. Drugs. 2022; 82: 1143–1150.
- Ständer S, et al.: Serlopitant reduced pruritus in patients with prurigo nodularis in a phase 2, randomized, placebo-controlled trial. JAAD 2019; 80: 1395–1402.
- Welsh SE, et al.: Neurokinin-1 receptor antagonist tradipitant has mixed effects on itch in atopic dermatitis: results from EPIONE, a randomized clinical trial. JEADV 2021; 35: e338–e340.
- Yosipovitch G, et al.: Serlopitant for the treatment of chronic pruritus: results of a randomized, multicenter, placebo-controlled phase 2 clinical trial. JAAD 2018; 78: 882–891.e10.
- Bieber T: Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov 2022; 21: 21–40.
- Kleinman E, et al.: What’s new in topicals for atopic dermatitis. Am J Clin Dermatol 2022; 23: 595–603.
- Chovatiya R, Paller AS: JAK inhibitors in the treatment of atopic dermatitis. JACI 2021; 148: 927–940.
- Nakagawa H, et al.: Delgocitinib ointment, a topical Janus kinase inhibitor, in adult patients with moderate to severe atopic dermatitis: A phase 3, randomized, double-blind, vehicle-controlled study and an open-label, long-term extension study. JAAD 2020; 82(4): 823–831.
- Bieber T: Atopic dermatitis: an expanding therapeutic pipeline for a complex disease. Nat Rev Drug Discov 2022; 21: 21–40.
- Park CW, et al.: Asivatrep, a TRPV1 antagonist, for the topical treatment of atopic dermatitis: phase 3, randomized, vehicle-controlled study (CAPTAIN-AD). JACI 2022; 149: 1340–1347.e4.
- Freitas E, Gooderham M, Torres T: New topical therapies in development for atopic dermatitis. Drugs 2022; 82: 843–853.
- Keam SJ: Tapinarof cream 1%: first approval. Drugs 2022; 82: 1221–1228.
- Paller AS, et al.: Efficacy and patient-reported outcomes from a phase 2b, randomized clinical trial of tapinarof cream for the treatment of adolescents and adults with atopic dermatitis. JAAD 2021; 84: 632–638.
- Zebda R, Paller AS. Phosphodiesterase 4 inhibitors. JAAD 2018; 78(3 Suppl 1): 43–S52,
doi: 10.1016/j.jaad.2017.11.056. - Schlessinger J, et al: Safety, effectiveness, and pharmacokinetics of Crisaborole in infants aged 3 to <24 months with mild-to-moderate atopic dermatitis: A phase IV open-label study (CrisADe CARE 1); Am J Clin Dermatol 2020; 21(2): 275–284.
- Saeki H, et al.: Difamilast ointment in adult patients with atopic dermatitis: a phase 3 randomized, double-blind, vehicle-controlled trial. JAAD 2022; 86(3): 607–614, doi: 10.1016/j.jaad.2021.10.027
- Yamamura K, Nakahara T: The Dawn of a New Era in Atopic Dermatitis Treatment. Journal of Clinical Medicine 2022; 11(20): 6145. www.mdpi.com/2077-0383/11/20/6145, (ultimo accesso 04.12.2024).
DERMATOLOGIE PRAXIS 2024; 34(6): 22–24