L’emorragia intracerebrale spontanea (ICB) rappresenta circa il 15-20% di tutti gli ictus. Sebbene un’ampia percentuale di ICB possa essere trattata in modo conservativo, il trattamento chirurgico ha un’alta priorità. Gli aspetti della terapia chirurgica comprendono il controllo della pressione intracranica (ICP), la gestione dell’idrocefalo e dell’emorragia intraventricolare e l’evacuazione chirurgica dell’ematoma. Sono state eseguite analisi di sottogruppo per le seguenti situazioni, rispettivamente. I risultati dello studio hanno dimostrato un vantaggio dell’evacuazione chirurgica precoce dell’ematoma nell’emorragia cerebellare sintomatica, nella riduzione della mortalità in pazienti selezionati con emorragia cerebrale grave e nell’emorragia superficiale atipica.
Il trattamento ottimale dell’emorragia intracerebrale (ICB) rimane un argomento controverso e clinicamente impegnativo, anche dopo la valutazione dei nuovi dati clinici pubblicati da studi randomizzati e prospettici negli ultimi 15 anni.
Nella pratica, spesso si pone la questione della possibilità, della necessità e dell’utilità di un intervento. La collaborazione delle discipline cliniche coinvolte nei centri neurovascolari permette di soppesare le possibilità di successo e i rischi di un intervento in ogni singolo caso. Tuttavia, come base per questa considerazione pragmatica “pro e contro”, anche la situazione attuale dei dati scientifici è di primaria importanza. Ne consegue l’indicazione chirurgica, tenendo conto degli aspetti etici, dei fattori di rischio legati al paziente e della valutazione della mortalità o della morbilità da aspettarsi. Nella valutazione dei pazienti con ICB, l’età, lo stato di coscienza e l’estensione e la localizzazione dell’emorragia sono di solito i parametri principali degli studi. Questo articolo riassume i risultati più importanti degli studi attuali in modo pratico.
Frequenza delle emorragie intracerebrali
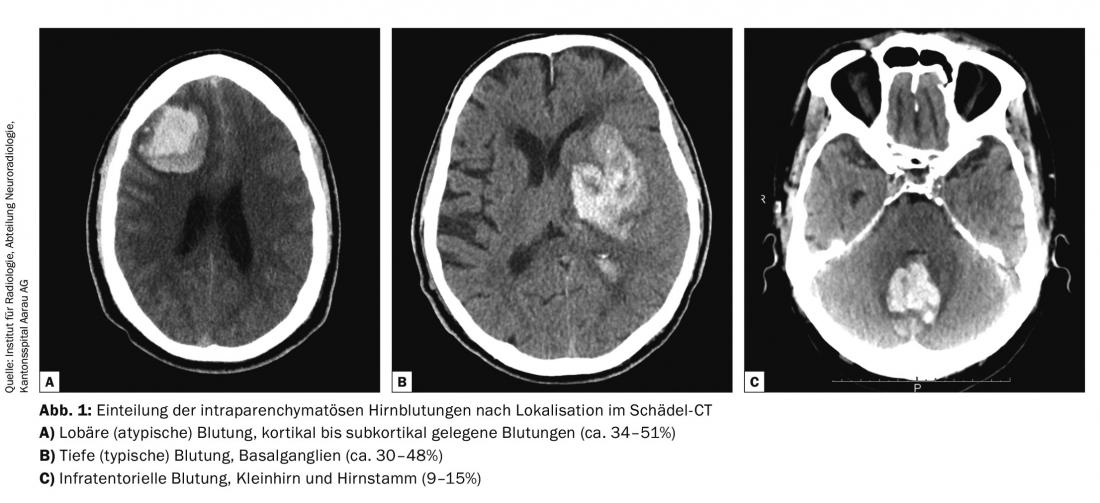
L’ICB spontaneo rappresenta circa il 15-20% di tutti gli ictus. Circa la metà di queste sono emorragie subaracnoidee aneurismatiche (aSAB), l’altra metà emorragie intraparenchimali spontanee. Le emorragie parenchimali sono ulteriormente suddivise in tre categorie rilevanti per il trattamento: emorragie lobari/superficiali (34-52%), emorragie profonde dei gangli troncali (30-48%) ed emorragie infratentoriali/cerebellari (9-15% ) (Fig. 1).
Diagnostica per le emorragie intracerebrali
L’anamnesi e l’esame clinico sono fondamentali nella situazione di emergenza per poter valutare quali pazienti devono essere assegnati a un centro di cura il prima possibile. Un’aSAB è solitamente accompagnata da fortissimi mal di testa, “mai provati prima”. L’emorragia intraparenchimale si presenta in modo simile, spesso accompagnata anche da deficit neurologici, mentre l’ictus ischemico stesso è spesso indolore e i sintomi neurologici portano alla diagnosi in questo caso. Se c’è un sospetto clinico di ictus, la diagnostica per immagini con una tomografia computerizzata (TC) è quindi indicata come primo passo diagnostico. Se si inizia a fluidificare il sangue in un paziente con sospetto ictus prima che sia stata esclusa un’emorragia, c’è il rischio di un’ulteriore estensione dell’emorragia.
Mentre nei pazienti anziani con ICB ipertensiva il sanguinamento “tipico” è causato da rotture nelle arterie più piccole (<0,5 mm), i pazienti più giovani sono più spesso colpiti da rigonfiamenti più grandi nella parete del vaso (aneurisma) o da malformazioni congenite dei vasi (malformazioni arterovenose). Questi ultimi possono essere identificati in modo non invasivo mediante angiografia TC (CTA) o risonanza magnetica (RM) e, se necessario, con la massima risoluzione mediante angiografia a sottrazione digitale (DSA). In caso di emorragia atipica, soprattutto nei pazienti giovani, è importante determinare la causa dell’emorragia (tab. 1).

Spettro di opzioni terapeutiche
Sebbene un’ampia percentuale di ICB possa essere trattata in modo conservativo, il trattamento chirurgico ha un’alta priorità nell’ampio spettro di opzioni terapeutiche. La disponibilità costante di tutte le opzioni terapeutiche in un unico centro è un prerequisito fondamentale per il successo della catena terapeutica. Questa catena di terapia consiste nel primo soccorso di emergenza, nella diagnostica per immagini, nel controllo dell’emostasi, nella regolazione della pressione arteriosa, nella terapia antiepilettica, se necessario, e nell’avvio di una gestione interna per limitare il danno primario e la profilassi del danno secondario. I dettagli si trovano nelle attuali linee guida dell’American Heart Association [1]. Le possibili misure interventistiche o chirurgiche devono essere inserite in un concetto di cura neurointensiva globale e funzionante, che richiede una disponibilità costante. Nella fase avanzata dell’assistenza acuta, iniziano la gestione medica per prevenire la recidiva dell’emorragia e la neuroriabilitazione.
Gli aspetti della terapia chirurgica comprendono il controllo della pressione intracranica (ICP), la gestione dell’idrocefalo e dell’emorragia intraventricolare e l’evacuazione chirurgica dell’ematoma.
Controllo della pressione intracranica
Una misurazione dell’ICP deve essere utilizzata se il punteggio della Glasgow Coma Scale (GCS) è inferiore a 9, se sono evidenti segni di ernia transtentoriale o se è presente idrocefalo. Tecnicamente adatta è la possibilità di inserire una misurazione della pressione intraparenchimatosa o intraventricolare attraverso una minitrapanazione. In presenza di idrocefalo, la pressione intracranica può essere misurata attraverso il catetere intraventricolare da un lato, e allo stesso tempo il liquido cerebrospinale può essere drenato in modo controllato, riducendo così anche la pressione intracranica. In ogni caso, il monitoraggio della pressione intracranica è consigliato nei pazienti con annebbiamento della coscienza [2].
Con la possibilità di misurare la ICP, le misure di terapia intensiva possono essere monitorate in modo più mirato per, tra l’altro, mantenere il limite superiore della ICP a 20 mmHg e ottimizzare approssimativamente la pressione di perfusione cerebrale (CPP = pressione arteriosa media – ICP) tra 50-70 mmHg. I corticosteroidi non dovrebbero essere utilizzati per abbassare la pressione intracranica, perché gli effetti collaterali superano ogni potenziale beneficio [3].
Emorragia intraventricolare
Il sanguinamento nel sistema ventricolare si verifica in circa il 45% dei pazienti con ICB spontanea ed è un fattore indipendente associato a un esito peggiore. Il tasso di mortalità aumenta fino al 51%, mentre gli ICB senza componenti intraventricolari hanno un tasso di mortalità di circa il 20% [4]. Tuttavia, l’inserimento di un drenaggio ventricolare esterno è consigliato nei pazienti incoscienti con idrocefalo [5].
Negli ultimi anni, la terapia di lisi intraventricolare con rtPA e l’evacuazione endoscopica dell’ematoma sono state ulteriormente sviluppate tecnicamente come opzioni di trattamento minimamente invasive e con risparmio di tessuto. Sebbene le revisioni delle prove oggi non abbiano ancora prodotto una chiara raccomandazione per la terapia di lisi o la clearance endoscopica, l’uso di queste forme di trattamento dovrebbe essere preso in considerazione in pazienti selezionati che possono chiaramente trarre beneficio da questi trattamenti. [1,5]. Grazie all’approccio minimamente invasivo all’emorragia, anche nel caso di ematomi profondi, il danno parenchimale è molto ridotto quando viene esposta la via d’accesso e, a differenza dell’ICB vero e proprio, di solito non ha alcuna rilevanza funzionale successiva. Nel complesso, il tasso di complicanze è basso e l’evacuazione efficace dell’ematoma può essere ottenuta per via endoscopica anche senza terapia di lisi (Fig. 2).
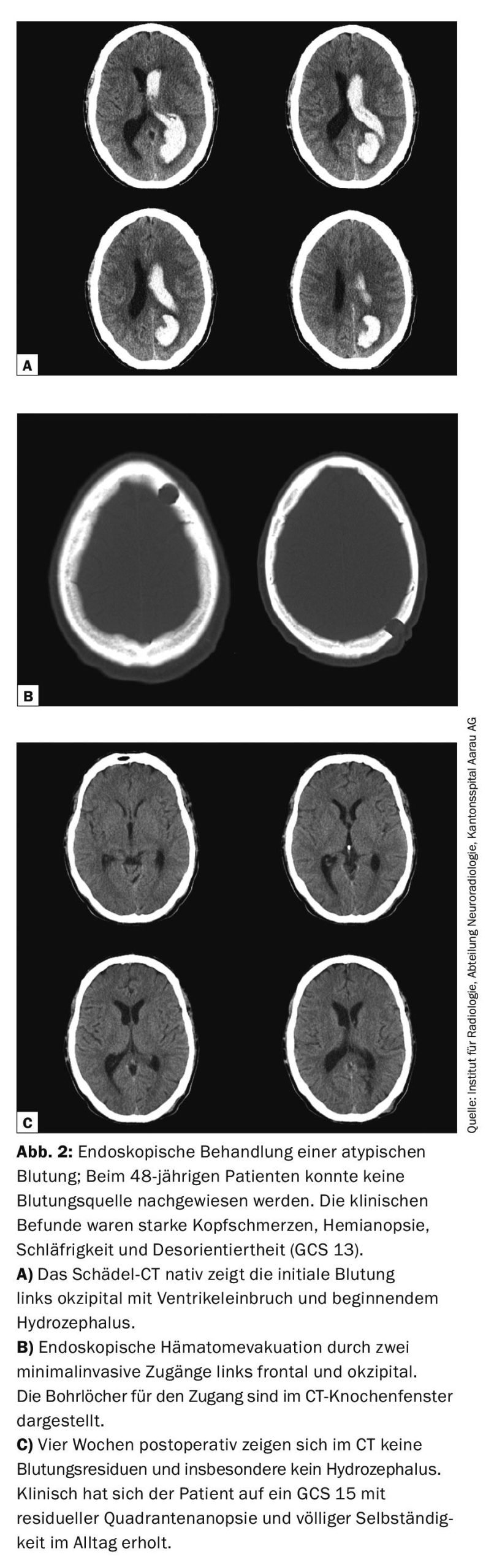
Basaldella et al. hanno potuto dimostrare che la dipendenza dal drenaggio ventricoloperitoneale (VP) permanente dopo l’evacuazione endoscopica dell’ematoma era significativamente minore (17%) rispetto al drenaggio ventricolare esterno o al solo drenaggio lombare (50%) [6]. Attualmente non sono ancora stati completati studi prospettici randomizzati promettenti, che forniranno nuove conoscenze in questo campo grazie al loro design clinicamente rilevante (Tabella 2).
Evacuazione chirurgica aperta dell’ematoma
Anche dopo i grandi studi randomizzati multicentrici internazionali (STICH I e STICH II), ad oggi non sono emerse prove chiare di classe 1 e di livello A a favore dell’evacuazione chirurgica precoce dell’ematoma (entro 24 ore) rispetto alla terapia conservativa [7,8]. Tuttavia, le analisi di sottogruppo di questi studi hanno dimostrato un vantaggio dell’evacuazione chirurgica precoce dell’ematoma in gruppi di pazienti selezionati per le seguenti situazioni:
- I pazienti con emorragia cerebellare sintomatica beneficiano chiaramente di un’evacuazione precoce dell’ematoma. In presenza di idrocefalo, deve essere inserito un drenaggio ventricolare esterno, nonostante la decompressione della fossa posteriore. Tuttavia, il solo drenaggio ventricolare senza l’evacuazione dell’ematoma cerebellare deve essere evitato.
- La decompressione chirurgica e l’evacuazione dell’ematoma per l’emorragia cerebrale devono essere prese in considerazione come misura di mantenimento in vita se ci sono ematomi di grandi dimensioni con spostamento sulla linea mediana e pressioni intracraniche incontrollabili.
- Ulteriori aspetti fisiopatologici dell’evacuazione dell’ematoma devono essere considerati nelle emorragie superficiali atipiche: la conservazione della penombra perifocale, l’ottimizzazione della pressione di perfusione cerebrale attraverso l’abbassamento della ICP e la riduzione dell’effetto tossico dei prodotti di degradazione del sangue sul parenchima cerebrale sano.
Per quanto riguarda la tempistica dell’intervento chirurgico, nello studio STICH II, l’analisi del sottogruppo ha mostrato un vantaggio nei pazienti operati entro 21 ore. Al contrario, un intervento troppo rapido (<4 ore) prima della stabilizzazione interna è associato ad un aumento del rischio di emorragia post-operatoria [9].
Per le emorragie ipertensive e “tipiche” dei gangli basali nei pazienti anziani, la terapia conservativa rimane il metodo di scelta. Tuttavia, si attendono ancora i risultati degli studi attuali per questo speciale sottogruppo (Tabella 2).
Profilassi delle emorragie intracerebrali
L’assistenza sanitaria primaria svolge il suo ruolo nella prevenzione dell’ICB. Innanzitutto, questo include un controllo ottimale della pressione sanguigna e un’indicazione restrittiva per l’anticoagulazione. Inoltre, con l’aumento del numero di TAC e risonanze magnetiche eseguite, sempre più aneurismi e malformazioni vascolari vengono rilevati incidentalmente. La gestione di queste malattie è diventata una caratteristica permanente dei centri specializzati: Nelle discussioni interdisciplinari sui casi, il rischio del decorso naturale viene soppesato rispetto al rischio del trattamento per ogni singolo paziente. Se il rischio di un eventuale intervento chirurgico o di un intervento è superiore al rischio di emorragia a lungo termine, è più probabile che si decida per un approccio osservazionale. Se sono presenti alcuni fattori di rischio, come un aneurisma molto grande o una storia di ICB in famiglia, invece, è più probabile che venga consigliato il trattamento della malattia vascolare. Il trattamento di aneurismi, malformazioni arterovenose o fistole durali arterovenose, cavernomi, tumori e lesioni traumatiche deve essere studiato e discusso separatamente.
Conclusione
La terapia dell’ICB è una sfida clinica che si associa a decisioni difficili da prendere. Le possibilità di un esito positivo non possono essere ottimizzate solo sulla base degli studi di prova. È importante non solo pensare e agire “sulla base delle evidenze”, ma anche progettare la terapia “sulla base del paziente” e della “struttura”, al fine di fornire al paziente la terapia ottimale con il miglior risultato possibile. La situazione clinica individuale del paziente, compresi la sua volontà e i suoi desideri, deve essere presa in considerazione. La volontà dei familiari e le possibilità dell’istituto di cura sono importanti quanto l’uso corretto delle prove.
Letteratura:
- Hemphill JC, et al: Consiglio Ictus dell’American Heart Association. Consiglio infermieristico cardiovascolare e ictus. Consiglio di Cardiologia Clinica. Linee guida per la gestione dell’emorragia intracerebrale spontanea: una linea guida per gli operatori sanitari dell’American Heart Association/American Stroke Association. Stroke 2015 Jul; 46(7): 2032-2060.
- Ko SB, et al: Monitoraggio multimodale per l’ottimizzazione della pressione di perfusione cerebrale nei pazienti in coma con emorragia intracerebrale. Stroke 2011; 42(11): 3087-3092.
- Poungvarin N, et al: Effetti del desametasone nell’emorragia intracerebrale primaria sopratentoriale. N Engl J Med 1987; 316(20): 1229-1233.
- Gaberel T, et al: Gestione dell’emorragia intraventricolare non traumatica. Neurosurg Rev 2012; 35(4): 485-494.
- Naff N, et al: L’attivatore del plasminogeno di tipo tissutale ricombinante a basso dosaggio migliora la risoluzione del coagulo nell’emorragia cerebrale: lo studio sulla trombolisi dell’emorragia intraventricolare. Stroke 2011; 42(11): 3009-3016.
- Basaldella L, et al: Il solo drenaggio ventricolare esterno rispetto alla chirurgia endoscopica per l’emorragia intraventricolare grave: un’analisi retrospettiva comparativa sull’esito e sulla dipendenza dallo shunt. Neurosurg Focus 2012; 32(4): E4.
- Mendelow AD, et al, investigatori STICH: Intervento chirurgico precoce rispetto al trattamento conservativo iniziale nei pazienti con ematomi intracerebrali spontanei sovratentoriali nell’International Surgical Trial in Intracerebral Haemorrhage (STICH): uno studio randomizzato. Lancet 2005; 365(9457): 387-397.
- Mendelow AD, et al: Intervento chirurgico precoce rispetto al trattamento conservativo iniziale nei pazienti con ematomi intracerebrali lobari sovratentoriali spontanei (STICH II): uno studio randomizzato. Lancet 2013; 382(9890): 397-408.
- Morgenstern LB, et al: La riemersione porta a un esito sfavorevole nella craniotomia ultra-precoce per emorragia intracerebrale. Neurologia 2001; 56(10): 1294-1299.
InFo NEUROLOGIA & PSICHIATRIA 2015; 13(6): 8-13