Il carcinoma uroteliale è responsabile del 90% dei tumori della vescica urinaria. Ogni anno, 1250 persone in Svizzera contraggono la malattia, soprattutto uomini anziani. Il trattamento standard è la chemioterapia con cisplatino. L’immunoterapia sta giocando un ruolo sempre più importante nelle forme metastatiche.
Il carcinoma uroteliale è responsabile del 90% dei tumori della vescica urinaria. Nei Paesi occidentali, il carcinoma a cellule squamose, l’adenocarcinoma e il carcinoma a piccole cellule sono rari. Sarcomi, linfomi o melanomi sono ancora più rari. Il carcinoma uroteliale della vescica urinaria è responsabile di circa il 3% dei casi di cancro in Svizzera, ossia 1250 nuovi casi ogni anno [1]. Il 75% delle persone colpite sono uomini. Oltre il 60% ha più di 70 anni al momento della diagnosi. I fattori di rischio sono la nicotina e le sostanze inquinanti come le ammine aromatiche (malattia professionale), la chemioterapia e la radioterapia. Raramente, i carcinomi uroteliali del tratto uroteliale superiore si verificano nel contesto della sindrome di Lynch. I pazienti spesso si presentano alla diagnosi con macroematuria, pollachiuria, disuria e sintomi di urgenza urinaria. Purtroppo, il 20-25% è già invasivo a livello muscolare alla prima manifestazione. I pazienti con metastasi hanno storicamente una sopravvivenza mediana di soli 12-18 mesi.
La fase localizzata
I frequenti stadi iniziali (carcinomi uroteliali non muscolo-invasivi) vengono resecati radicalmente mediante resezione transuretrale (TUR vescicale). I pazienti con rischio intermedio o alto vengono successivamente trattati con terapia intravescicale con BCG o chemioterapia. I pazienti che non rispondono al BCG hanno ora la possibilità di essere trattati con l’immunoterapia. Nello studio di fase 2 (studio Keynote-057), i pazienti con tumore alla vescica ad alto rischio, non muscolo-invasivo, che non avevano risposto al BCG, sono stati trattati con pembrolizumab ogni 3 settimane per 2 anni. È stato raggiunto un tasso di remissione completa del 41%. Gli effetti collaterali sono paragonabili a quelli del contesto metastatico. La terapia è stata approvata dalla FDA negli Stati Uniti [2].
Il carcinoma uroteliale muscolo-invasivo in fase localizzata rimane un problema importante. Circa il 50% dei pazienti con carcinoma della vescica muscolo-invasivo muore entro 3 anni a causa di metastasi, nonostante la cistectomia. A partire dallo stadio T2 o N+, ai pazienti deve essere offerta la chemioterapia neoadiuvante (NAC). Con 3-4 cicli di chemioterapia contenente cisplatino (cisplatino e gemcitabina o MVAC a dose densa), la sopravvivenza a 5 anni potrebbe aumentare del 5% in termini assoluti (Fig. 1). Una meta-analisi ha mostrato un downstaging patologico (<pT2) nel 49% dei pazienti con NAC contenente cisplatino e gemcitabina. Dopo la NAC, il tasso post-operatorio di tumori ypT0-N0 era del 25-30%, con un impatto significativo sulla sopravvivenza libera da progressione e sulla sopravvivenza globale [3]. Purtroppo, l’accettazione della chemioterapia neoadiuvante è aumentata solo leggermente negli ultimi anni. Solo una parte dei pazienti riceve la chemioterapia neoadiuvante. Inoltre, ci sono pazienti che non sono adatti alla chemioterapia a causa della loro comorbilità, cioè la chemioterapia con cisplatino non è un’opzione per loro. La sostituzione del cisplatino con il carboplatino è associata a un esito significativamente peggiore e pertanto non dovrebbe essere effettuata. I buoni risultati dell’immunoterapia nel contesto metastatico hanno portato all’aggiunta dell’immunoterapia alla chemioterapia neoadiuvante, attualmente in fase di sperimentazione in vari studi. Gli studi di fase 2 hanno dimostrato che la terapia neoadiuvante con gli inibitori del checkpoint atezolizumab e pembrolizumab può raggiungere un tasso di risposta patologica completa del 30-40% e il tasso di risposta globale (<pT2) è stato del 40-50% [4,5]. Il fattore decisivo è stata l’espressione di PDL-1, che è stata associata a un tasso di risposta migliore.
I risultati dello studio BLASST-1, che ha analizzato nivolumab in combinazione con cisplatino e gemcitabina, hanno mostrato una remissione patologica completa del 49% [6]. Con la chemioterapia neoadiuvante con cisplatino/gemcitabina da sola, si riscontra una PCR di circa il 30%. Lo studio SAKK 06/17, che sta studiando la chemioterapia neoadiuvante con cisplatino e gemcitabina in combinazione con l’immunoterapia durvalumab, seguita dalla terapia di mantenimento post-operatoria con durvalumab, è stato recentemente chiuso. Un’analisi ad interim ha mostrato un tasso di remissione patologicamente completa del 30%. I risultati finali sono molto attesi.
Il gold standard per il trattamento del carcinoma uroteliale muscolo-invasivo negli stadi T2-4a, N0-X M0 è ancora la cistectomia radicale e la linfoadenectomia pelvica (con condotto dell’ileo o vescica sostitutiva). Nelle situazioni ad alto rischio, come la recidiva dopo la terapia di instillazione di BCG o nel caso di tumori di alto grado estesi o multiloculari, la cistectomia precoce è già raccomandata a partire dallo stadio pT1. Il momento dell’operazione dopo la NAC è importante. Se l’intervallo tra la chemioterapia e la cistectomia supera le 10 settimane, la sopravvivenza globale peggiora significativamente. Anche non eseguire l’intervento chirurgico quando c’è una risposta clinicamente completa è negligente, poiché il 64% presenta ancora un tumore residuo dopo la cistectomia. La proporzione di carcinomi uroteliali pT3/4 con e senza coinvolgimento linfonodale era del 25%.
La “terapia trimodale” di conservazione della vescica, che consiste in una combinazione di resezione radicale transuretrale e radio-chemioterapia, può essere un’alternativa per i pazienti non operabili o con un forte desiderio di conservazione dell’organo, ma mostra un risultato oncologico più scarso [7].
La chemioterapia adiuvante deve essere presa in considerazione se non è stata somministrata la chemioterapia neoadiuvante. Soprattutto dagli stadi T3 e N+. I dati delle meta-analisi su questo aspetto sono meno solidi, ma suggeriscono che anche questi pazienti traggono beneficio [8].
Stadi metastatici
I pazienti con malattia recidivata o metastatica hanno una prognosi molto sfavorevole (12-18 mesi). Fattori prognostici particolarmente sfavorevoli per quanto riguarda la sopravvivenza globale sono: condizioni generali precarie con un Karnofsky Performance Status <80% e metastasi viscerali, comprese le metastasi scheletriche. La chemioterapia standard con cisplatino e gemcitabina porta a una risposta del 50% [9]. La sopravvivenza mediana è di 14 mesi. Dopo tutto, il 13-15% dei pazienti è ancora vivo dopo 5 anni. Nei pazienti in buone condizioni generali e senza metastasi viscerali, la sopravvivenza mediana è di 33 mesi e il 20% è ancora vivo dopo 5 anni. Purtroppo, questa terapia non è fattibile in molti pazienti anziani a causa della co-morbilità. Nella pratica clinica, il carboplatino viene spesso utilizzato al posto del cisplatino, che è significativamente meno efficace nel carcinoma uroteliale.
Con gli inibitori del checkpoint, ora c’è una nuova opzione terapeutica che offre anche un’opzione di trattamento, soprattutto per i pazienti anziani che non sono compatibili con il cisplatino. Nello studio di fase 2 Keynote-052, i pazienti sono stati trattati con pembrolizumab 200 mg ogni 3 settimane per un massimo di 2 anni [10]. Questo mostra una risposta del 29%, compreso il 7% di remissione completa. La risposta è stata più evidente con un’espressione di PD-L1 superiore al 10% (38%), sebbene la risposta sia stata osservata anche con un’espressione di PD-L1 inferiore al 10%. Nello studio di fase 2 IMvigor 210, l’atezolizumab ha raggiunto una sopravvivenza mediana di circa 16 mesi [11]. I pazienti che avevano una forte espressione di PD-L1 hanno beneficiato in modo significativamente migliore dell’immunoterapia (sopravvivenza mediana di 19 mesi). La risposta è stata del 32% con il 9% di remissioni complete.
In seconda linea, dopo il fallimento della terapia contenente platino, ci si può aspettare una risposta di circa il 10-20%. La vinflunina è stata testata in uno studio di fase 3 contro la migliore terapia di supporto [12]. C’è stata una risposta del 9% e un beneficio di sopravvivenza mediana (6,9 contro 4,6 mesi).
Nell’IMvigor 211, uno studio di fase 3 che ha confrontato l’atezolizumab con diversi agenti chemioterapici, non è stato osservato alcun effetto significativo dell’immunoterapia [13]. Tuttavia, lo studio di fase 3 Keynote-045, che ha confrontato anche l’immunoterapia (pembrolizumab) con le diverse terapie (vinflunina, taxani) è stato positivo, con una sopravvivenza di 10,3 vs 7,4 mesi. Dopo un anno, il 44% rispetto al 33% dei pazienti sottoposti a chemioterapia era ancora vivo [14].
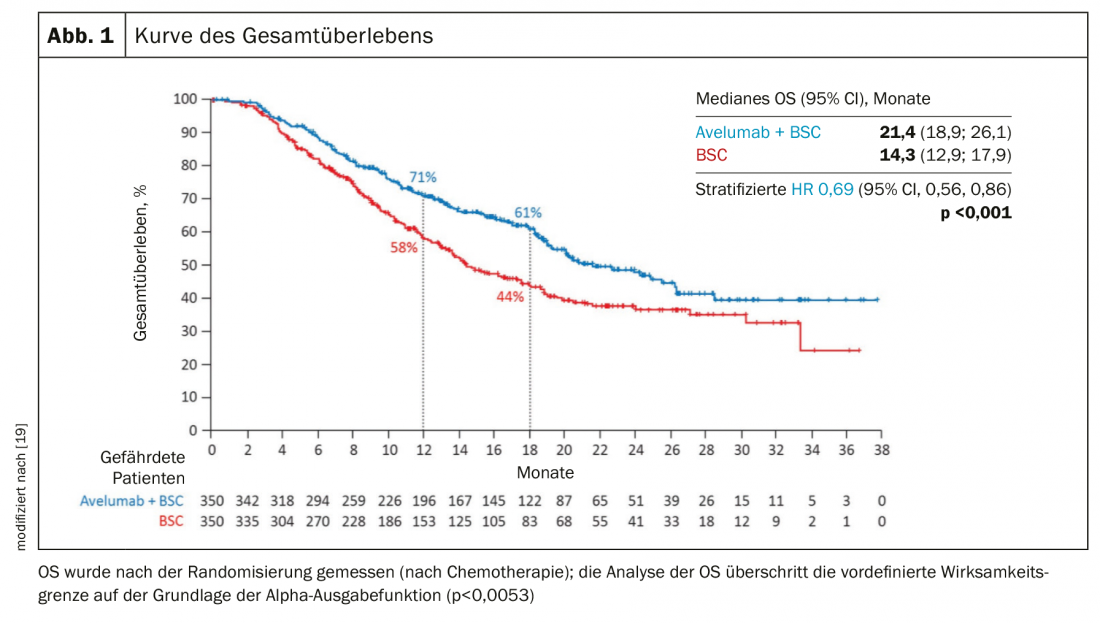
Dopo il fallimento della chemioterapia contenente platino e dell’immunoterapia, può essere presa in considerazione la terapia con enfortumab vedotin, un coniugato anticorpo-farmaco [15]. La risposta al trattamento nello studio di fase 2 è stata del 44%, con il 12% di remissioni complete (Fig. 2) . La risposta mediana è stata di 7,6 mesi.
Per i pazienti con una mutazione del gene FGFR 3 o una fusione dei geni FGFR 2 o 3, esiste l’opzione della terapia con l’inibitore FGFR Erdafitinib. In uno studio di fase 2 in aperto, sono stati trattati pazienti con almeno una terapia precedente con Erdafitinib [16]. C’è stata una risposta del 40% e una sopravvivenza libera da progressione e globale di 5,5 e 5,5 settimane, rispettivamente. 13,8 mesi. L’approvazione negli Stati Uniti si è basata sul tasso di risposta. In una fase 3, la terapia viene ora testata contro la chemioterapia e l’immunoterapia.
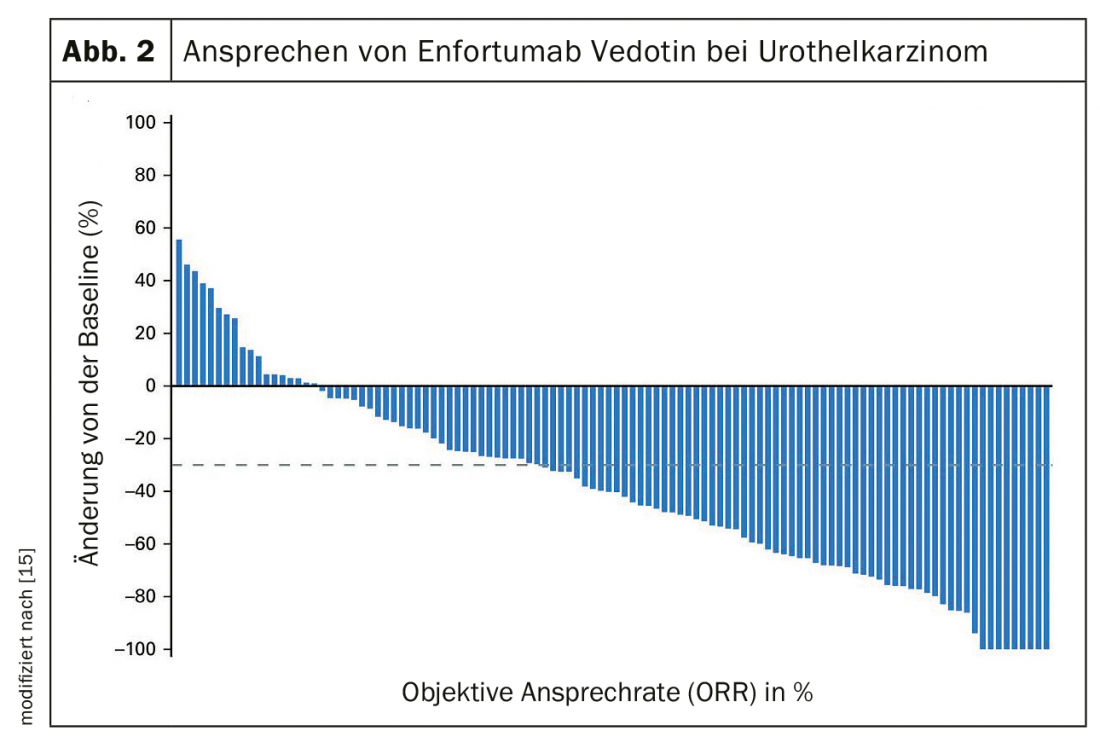
Attualmente non è chiaro se la chemio-immunoterapia primaria, già standard nel carcinoma bronchiale, sia un vantaggio anche nel carcinoma uroteliale. A causa dell’elevato carico mutazionale del tumore, che è un’indicazione di una buona risposta all’immunoterapia in molti tumori, è plausibile un vantaggio dell’uso precoce dell’immunoterapia. IMvigor130, uno studio di fase 3 che ha confrontato platino/gemcitabina +/- atezolizumab, è stato negativo per l’endpoint co-primario sopravvivenza globale [17]. Al contrario, la sopravvivenza libera da progressione è stata migliore di 1,9 mesi (6,3 vs 8,2 mesi). Nello studio di fase 3 JAVELIN Bladder 100, i pazienti che non erano progrediti dopo la chemioterapia contenente cisplatino sono stati trattati con l’immunoterapia con avelumab. I pazienti con avelumab hanno vissuto in media 7 mesi in più (OS 14,3 vs 21,4 mesi) (Fig. 3) [18].
Messaggi da portare a casa
- La chemioterapia neoadiuvante contenente cisplatino rimane lo standard di cura per i tumori localizzati dello stadio T2 e migliora la sopravvivenza di un 5% assoluto.
- Nel carcinoma uroteliale metastatico, la terapia di mantenimento con l’inibitore del checkpoint avelumab migliora la sopravvivenza di 7 mesi in risposta alla chemioterapia contenente platino.
- Nei pazienti anziani e polimorfi con carcinoma uroteliale localmente avanzato e metastatico, l’opzione della sola immunoterapia è ben tollerata.
- I marcatori molecolari stanno diventando sempre più importanti anche nel trattamento del carcinoma uroteliale con l’opzione della “terapia mirata”, ad esempio con l’inibitore FGFR Erdafitinib.
- La terapia con il coniugato anticorpo-farmaco enfortumab vedotin ha un alto tasso di risposta anche nei pazienti pretrattati.
Letteratura:
- www.nicer.org
- www.fda.org/drugs
- Collaborazione di meta-analisi sul cancro avanzato della vescica (ABC): Chemioterapia neoadiuvante nel cancro invasivo della vescica: aggiornamento di una revisione sistematica e meta-analisi per i dati dei singoli pazienti Collaborazione di meta-analisi sul cancro avanzato della vescica (ABC). Eur Urol 2005; 48(2): 202-205.
- Powles T, et al: Studio di fase II sulla sicurezza e l’efficacia dell’atezolizumab neoadiuvante nel carcinoma muscolo-invasivo della vescica (ABACUS). J Clin Oncol.2018;36(suppl 15; abstr 4506).
- Necchi A. et al: Pembrolizumab come terapia neoadiuvante prima della cistectomia radicale in pazienti con carcinoma della vescica muscolo-invasivo (PURE-01): uno studio di fase II in aperto, a braccio singolo. J Clin Oncol 2018;36(34): 3353-3360.
- Gupta S, et al: Risultati del BLASST-1 (Bladder Cancer Signal Seeking Trial) di nivolumab, gemcitabina e cisplatino nel tumore della vescica muscolo-invasivo (MIBC) sottoposto a cistectomia. J Clin Oncol 2020;38(suppl 6; abstr 439).
- Chedgy ECP, et al: Cistectomia radicale e gestione multidisciplinare del cancro alla vescica muscolo-invasivo. JAMA Oncol 2016;2(7):855-856.
- Leow JJ e altri. Chemioterapia adiuvante per il tumore invasivo della vescica: revisione sistematica e meta-analisi aggiornata al 2013 di studi randomizzati. Eur Urol. 2014 Jul;66(1):42-54.
- Van der Maase H, et al: Risultati di sopravvivenza a lungo termine dello studio randomizzato che confronta gemcitabina più cisplatino con metotrexato, vinblastina, doxorubicina più cisplatino nei pazienti con cancro alla vescica. J Clin Oncol 2005;23(21): 4602-4608.
- Balar AV, et al: Pembrolizumab di prima linea in pazienti non eleggibili al cisplatino con carcinoma uroteliale localmente avanzato e non resecabile o metastatico (KEYNOTE-052): studio multicentrico, a braccio singolo, di fase 2. Lancet Oncol. 2017;18(11): 1483.
- Balar AV, et al: Atezolizumab come trattamento di prima linea nei pazienti non eleggibili al cisplatino con carcinoma uroteliale localmente avanzato e metastatico: uno studio di fase 2, multicentrico, a braccio singolo. Lancet 2017;389(10064): 67.
- Bellmunt J, et al: Studio di fase III sulla vinflunina più la migliore terapia di supporto rispetto alla sola migliore terapia di supporto dopo un regime contenente platino nei pazienti con carcinoma a cellule transizionali avanzato del tratto uroteliale. J Clin Oncol. 2009;27(27): 4454.
- Powles T, et al: Atezolizumab rispetto alla chemioterapia in pazienti con carcinoma uroteliale localmente avanzato o metastatico trattato con platino (IMvigor211): uno studio randomizzato controllato multicentrico, in aperto, di fase 3. Lancet. 2018; 391: 748-757.
- Bellmunt J, et al: Pembrolizumab come terapia di seconda linea per il carcinoma uroteliale avanzato. N Engl J Med. 2017;376(11): 1015.
- Rosenberg JE e altri. Studio pivotale di Enfortumab Vedotin nel carcinoma uroteliale dopo la terapia con Platino e Anti-Programmed Death 1/Programmed Death Ligand 1. J Clin Oncol. 2019;37(29):2592.
- Loriot Y e altri. Erdafitinib nel carcinoma uroteliale localmente avanzato o metastatico. N Engl J Med. 2019;381(4): 338
- IMvigor 130. ESMO 2019.
- Powles, et al: Javelin Bladder 100. ASCO 2020. Journal of Clinical Oncology 38, n. 18_suppl; DOI: 10.1200/JCO.2020.38.18_suppl.LBA1
- Vale CL: Chemioterapia neoadiuvante nel carcinoma vescicale invasivo: aggiornamento di una revisione sistematica e di una metaanalisi. Urologia europea 2005.
InFo ONCOLOGIA ED EMATOLOGIA 2020; 8(4): 6-9