Lo standard per un glioblastoma di nuova diagnosi è una resezione il più possibile completa. Segue la radiochemioterapia a base di temozolomide. Uno degli approcci terapeutici più recenti è l’uso di campi di terapia tumorale.
I glioblastomi sono i tumori cerebrali maligni primari più comuni negli adulti e possono sostanzialmente insorgere a qualsiasi età. L’incidenza aumenta con l’età e l’età media di insorgenza è di 64 anni. Gli uomini sono colpiti leggermente più spesso delle donne [1]. La sopravvivenza mediana dei pazienti con glioblastoma di nuova diagnosi è di soli 16 mesi circa, anche negli studi clinici, ed è molto più breve negli studi basati sulla popolazione.
In contrasto con i progressi terapeutici, solo relativamente modesti, la comprensione della base biologica molecolare dei glioblastomi si è ampliata notevolmente negli ultimi dieci anni. Secondo la classificazione dell’OMS rivista nel 2016, i glioblastomi che insorgono de novo non presentano una mutazione in uno dei due geni dell’isocitrato deidrogenasi (IDH). Questo gruppo rappresenta circa il 90% di tutti i glioblastomi. Al contrario, i glioblastomi, molto più rari, che nascono da un tumore di basso grado, di solito presentano una mutazione IDH e hanno una prognosi migliore. Di conseguenza, questi tumori sono riportati separatamente nella nuova classificazione dell’OMS [2]. L’O6-metilguanina-DNA metiltransferasi (MGMT) si è affermata come un importante biomarcatore. È una proteina di riparazione del DNA che inverte le alchilazioni nella posizione O6 della guanina. La metilazione del promotore MGMT si trova in circa un terzo dei glioblastomi. Il risultato della metilazione è un’espressione assente o ridotta di MGMT, che porta a una sensibilità delle cellule alla chemioterapia alchilante.
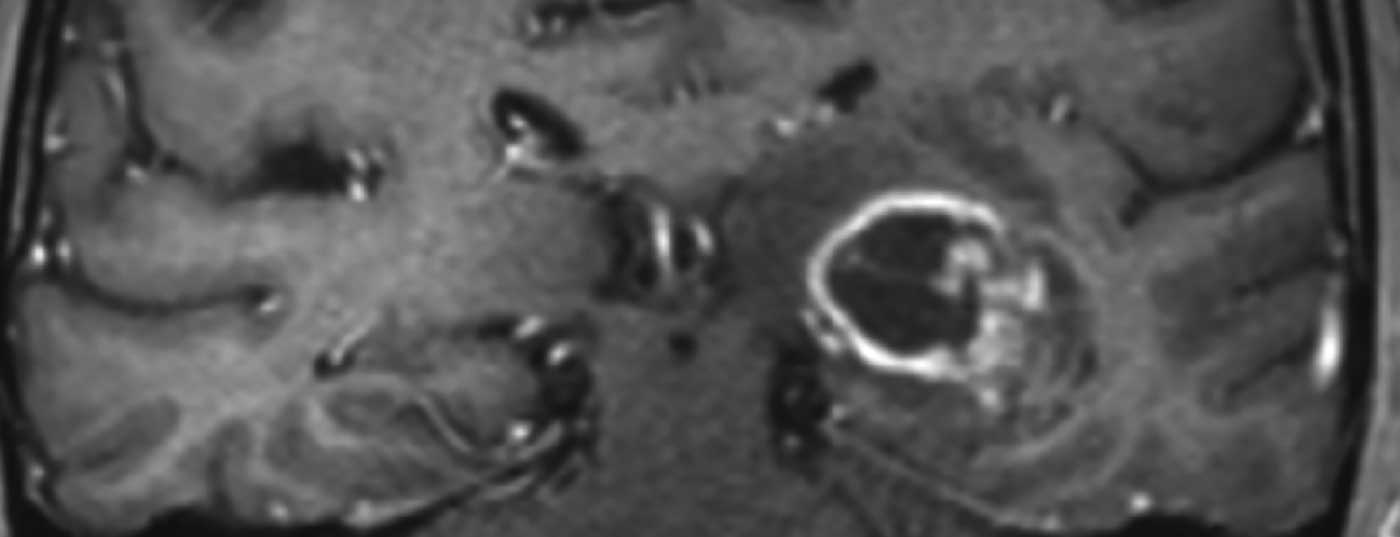
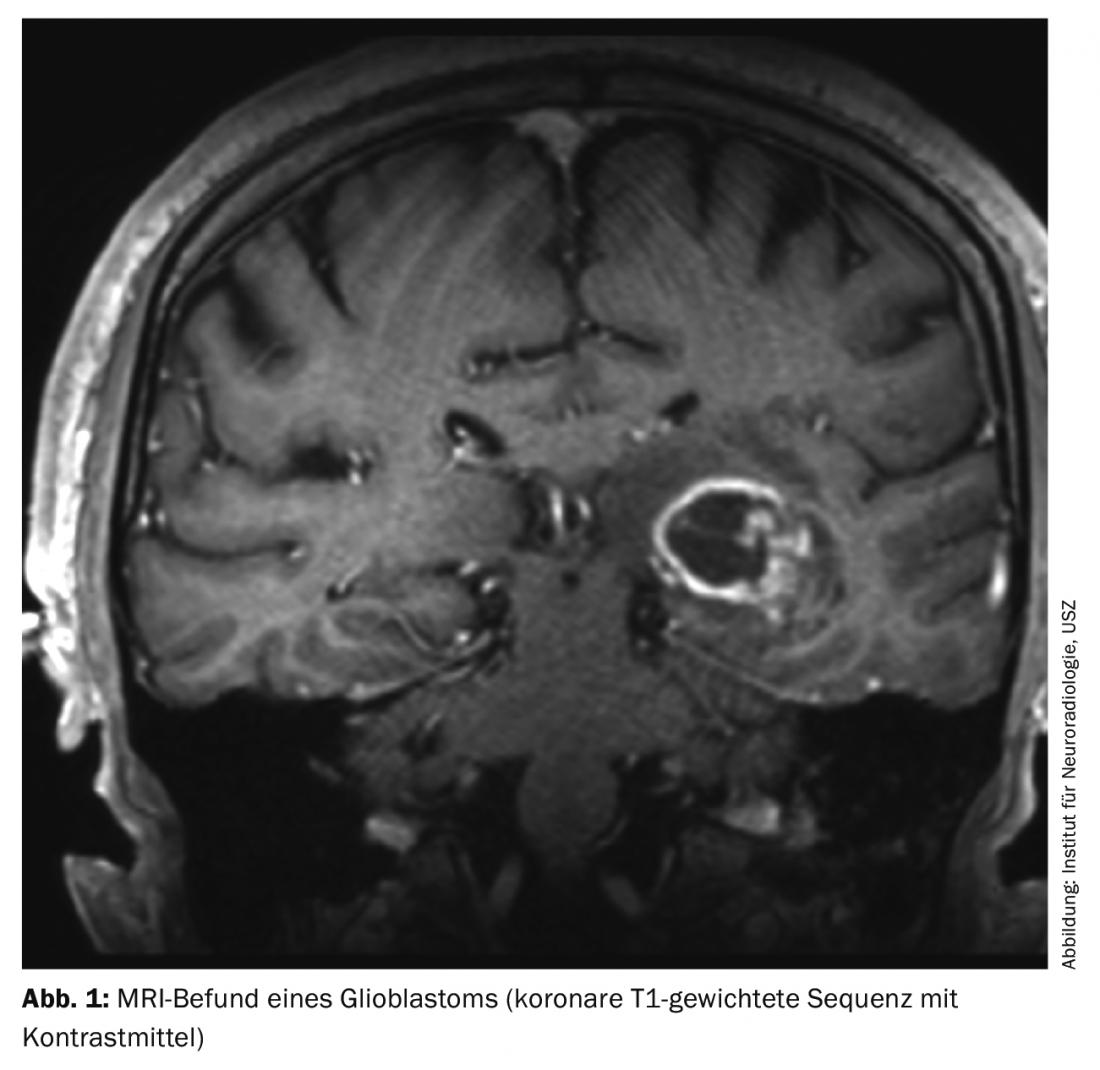
I glioblastomi si manifestano con sintomi clinici diversi, che dipendono principalmente dalla localizzazione del tumore nel cervello. Oltre ai cambiamenti di personalità, al mal di testa, alla nausea e al vomito, ai sintomi di pressione intracranica o ai deficit neurologici focali, una crisi epilettica porta spesso a un chiarimento diagnostico. La risonanza magnetica cranica mostra in genere una lesione marginalmente assorbente il contrasto con necrosi centrale (Fig. 1). Se la diagnostica per immagini fa sospettare la presenza di un glioblastoma o di un altro tumore cerebrale, di solito si deve cercare una diagnosi istologica.
Terapia
L’obiettivo dell’intervento chirurgico, oltre a ottenere il tessuto, è quello di ottenere la massima resezione possibile che può essere effettuata senza causare nuovi deficit neurologici. I tumori per i quali non è possibile una resezione completa a causa della localizzazione nel cervello devono essere sottoposti solo a biopsia. Lo stesso vale per i pazienti in condizioni generali ridotte, che potrebbero non essere in grado di sopportare lo stress di un intervento chirurgico esteso. L’uso dell’acido 5-aminolevulinico e l’imaging intraoperatorio possono migliorare l’estensione della resezione. Questo porta a un prolungamento della sopravvivenza libera da progressione [3,4].
Dal 2005, la radioterapia con terapia concomitante di temozolomide seguita da una terapia di mantenimento con temozolomide per un massimo di sei cicli (TMZ/RT -> TMZ) è stata la terapia standard per i pazienti con glioblastoma di nuova diagnosi. La radiochemioterapia è superiore alla sola radioterapia [5]. La temozolomide è un alchilano che può essere somministrato per via orale e ha un profilo di effetti collaterali complessivamente favorevole. Gli effetti collaterali più comuni includono affaticamento e nausea, nonché mielosoppressione, alcuni dei quali richiedono un aggiustamento della dose.
Diversi tentativi di integrare la radiochemioterapia a base di temozolomide con altre sostanze non hanno portato a tempi di sopravvivenza prolungati. Questo vale in particolare per l’anticorpo bevacizumab, che è diretto contro il fattore di crescita endoteliale vascolare (VEGF). L’aggiunta di bevacizumab alla terapia standard ha determinato un prolungamento della sopravvivenza libera da progressione nei pazienti con glioblastoma di nuova diagnosi, ma non un prolungamento della sopravvivenza globale [6,7]. Il vaccino peptidico rindopepimut, che ha come bersaglio la variante mutante vIII del “recettore del fattore di crescita epidermico” (EGFRvIII), è stato studiato anche in uno studio randomizzato su pazienti con glioblastoma EGFRvIII-positivo di nuova diagnosi. Tuttavia, non è stato riscontrato alcun vantaggio in termini di sopravvivenza rispetto a un vaccino placebo [8].
A differenza dei farmaci sopra citati, un nuovo approccio terapeutico con i cosiddetti campi di trattamento del tumore ha dimostrato di prolungare la sopravvivenza [9]. Qui viene generato un campo elettrico tramite elettrodi da applicare al cranio, che dovrebbe portare all’inibizione della proliferazione delle cellule tumorali. Il trattamento con campi di terapia del tumore è in aggiunta alla terapia di mantenimento con temozolomide. L’ideale sarebbe indossare il dispositivo per almeno 18 ore al giorno. Gli effetti collaterali più comuni includono l’irritazione della pelle dovuta agli elettrodi adesivi. Resta da vedere quanti pazienti opteranno per questo trattamento in aggiunta alla chemioterapia in futuro. Inoltre, la questione del rimborso da parte delle compagnie assicurative è attualmente ancora poco chiara nella maggior parte dei Paesi.
La terapia dei pazienti anziani affetti da glioblastoma rappresenta una sfida particolare. Nel frattempo, uno studio randomizzato ha dimostrato che la combinazione di radioterapia e chemioterapia con temozolomide è superiore alla sola radioterapia in questi pazienti. Tuttavia, la temozolomide porta a un vantaggio di sopravvivenza rilevante solo nei pazienti con un tumore metilato con MGMT [10]. Di conseguenza, può essere presa in considerazione la sola radioterapia, soprattutto nei pazienti di età superiore ai 70 anni con un tumore non metilato MGMT. I pazienti con tumori MGMT-metilati in cui la radiochemioterapia combinata non è indicata, ad esempio a causa delle condizioni generali ridotte, possono ricevere la monoterapia con temozolomide [11]. Soprattutto nei pazienti anziani in condizioni generali ridotte, un concetto di terapia palliativa-supportiva dovrebbe essere valutato precocemente a causa della prognosi molto sfavorevole.
Prospettiva
Attualmente, l’interesse scientifico si concentra principalmente sugli approcci terapeutici immunoterapici [12]. Oltre ai concetti di vaccinazione avanzati, si stanno studiando in particolare gli inibitori della via di segnalazione della “morte cellulare programmata” (PD)-1. L’inibitore PD1 nivolumab è attualmente utilizzato in due studi randomizzati di fase III. Lo studio Checkmate 498 sta confrontando la combinazione di radioterapia e nivolumab con la terapia standard (TMZ/RT -> TMZ) nei pazienti con glioblastoma non metilato MGMT. Lo studio Checkmate 548, a reclutamento parallelo, sta confrontando l’aggiunta di nivolumab o placebo a TMZ/RT -> TMZ nei pazienti con glioblastoma di nuova diagnosi in cui il tumore presenta una metilazione del promotore MGMT. I risultati di questo e di altri studi mostreranno se gli approcci immunoterapeutici possono contribuire a una prognosi migliore nei pazienti affetti da glioblastoma.
Messaggi da portare a casa
- La terapia standard per un glioblastoma di nuova diagnosi consiste in una resezione il più possibile completa, seguita da una radiochemioterapia a base di temozolomide.
- L’aggiunta di bevacizumab alla terapia standard non prolunga la sopravvivenza nei pazienti con glioblastoma.
- Uno studio di fase III, valutato positivamente, ha dimostrato un prolungamento della sopravvivenza di diversi mesi grazie all’uso di campi di terapia tumorale.
- Gli studi attualmente in corso stanno studiando in particolare vari approcci terapeutici immunoterapici.
Letteratura:
- Ostrom QT, et al: Rapporto statistico CBTRUS: tumori primari del cervello e di altri sistemi nervosi centrali diagnosticati negli Stati Uniti nel 2009-2013. Neuro Oncol 2016; 18(Suppl 5): v1-v75.
- Louis DN, et al: La classificazione dei tumori del sistema nervoso centrale dell’Organizzazione Mondiale della Sanità del 2016: una sintesi. Acta Neuropathol 2016; 131(6): 803-820.
- Stummer W, et al: Chirurgia guidata dalla fluorescenza con acido 5-aminolevulinico per la resezione del glioma maligno: uno studio multicentrico randomizzato e controllato di fase III. Lancet Oncol 2006; 7(5): 392-401.
- Senft C, et al: Guida alla risonanza magnetica intraoperatoria ed estensione della resezione nella chirurgia del glioma: uno studio randomizzato e controllato. Lancet Oncol 2011; 12(11): 997-1003.
- Stupp R, et al: Radioterapia più temozolomide concomitante e adiuvante per il glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Chinot OL, et al: Bevacizumab più radioterapia-temozolomide per il glioblastoma di nuova diagnosi. N Engl J Med 2014; 370(8): 709-722.
- Gilbert MR, et al: Uno studio randomizzato sul bevacizumab per il glioblastoma di nuova diagnosi. N Engl J Med 2014; 370(8): 699-708.
- Weller M, et al: Rindopepimut con temozolomide per i pazienti con glioblastoma di nuova diagnosi, esprimente EGFRvIII (ACT IV): uno studio internazionale di fase 3, randomizzato, in doppio cieco. Lancet Oncol 2017; 18(10): 1373-1385.
- Stupp R, et al: Terapia di mantenimento con campi tumorali più Temozolomide vs Temozolomide da sola per il Glioblastoma: uno studio clinico randomizzato. JAMA 2015; 314(23): 2535-2543.
- Perry JR, et al: Radiazione di breve durata più temozolomide nei pazienti anziani con glioblastoma. N Engl J Med 2017; 376(11): 1027-1037.
- Weller M, et al: Linea guida dell’Associazione Europea di Neuro-Oncologia (EANO) sulla diagnosi e il trattamento dei gliomi astrocitici e oligodendrogliali dell’adulto. Lancet Oncol 2017; 18(6): e315-e329.
- Weiss T, Weller M, Roth P: Immunoterapia per il glioblastoma: concetti e sfide. Curr Opin Neurol 2015; 28(6): 639-646.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(6): 16-18