La malattia arteriosa periferica (PAVD) è la manifestazione di una patologia che spesso viene giudicata male nella sua importanza dai pazienti, ma anche dai medici. Anche se la prevalenza complessiva è tra il 3 e il 10%, è già circa il 20% nei pazienti >70 anni [1]. Inizialmente, è solo leggermente sintomatico, ma il dolore che si verifica durante lo sforzo porta gradualmente a una restrizione dell’attività fisica – con conseguente riduzione della qualità della vita [2]. La prognosi dei pazienti colpiti è significativamente limitata dalla manifestazione della malattia in altri organi. La riabilitazione multimodale è l’unico concetto terapeutico che va oltre il trattamento dei sintomi locali e migliora la prognosi dei pazienti a lungo termine.
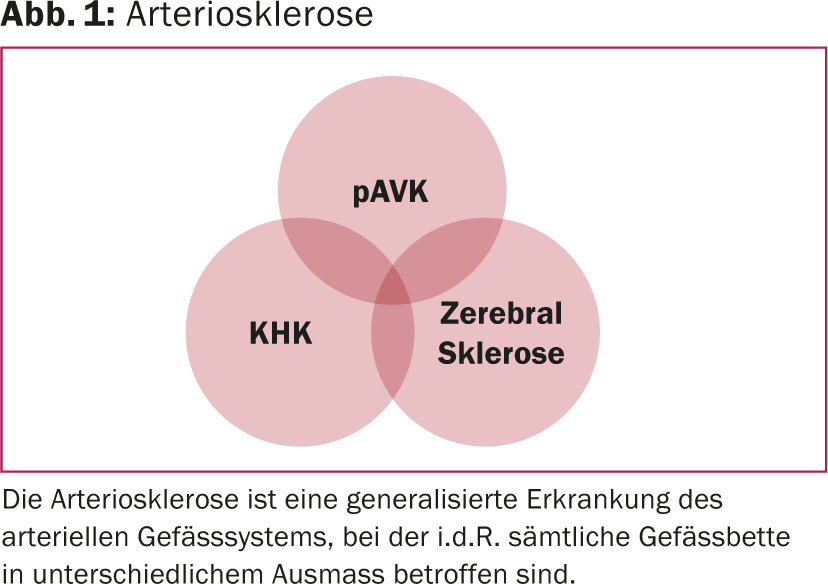
La malattia arteriosa periferica (PAVD) è la manifestazione di una malattia vascolare sistemica che può colpire in egual misura tutte le aree dei vasi arteriosi. Oltre alle arterie delle gambe, spesso vengono colpite anche le arterie renali, le arterie coronarie e le arterie di alimentazione del cervello. Anche se i sintomi della PAOD possono essere ridotti localmente con varie strategie di trattamento, la malattia sistemica rimane – e progredisce. La prognosi dei pazienti colpiti è infine determinata in modo decisivo dalla manifestazione della malattia in altri organi: in particolare nelle coronarie o nelle arterie che riforniscono il cervello. Il rischio di complicazioni cardiovascolari è più elevato nei pazienti con PAOD rispetto a quelli che hanno subito un infarto (Fig. 1).
Nel trattamento dei pazienti con PAOD, è quindi particolarmente importante frenare la progressione della malattia di base, oltre ai sintomi manifesti. Di conseguenza, il concetto di trattamento comprende due approcci (Fig. 2):
- Trattamento locale della PAOD con l’obiettivo di alleviare i sintomi o prolungare la distanza di deambulazione.
- Il trattamento della malattia di base con l’obiettivo di migliorare la mortalità riducendo le complicanze cardiovascolari. Il trattamento dei fattori di rischio vascolare è particolarmente importante.

Linee guida
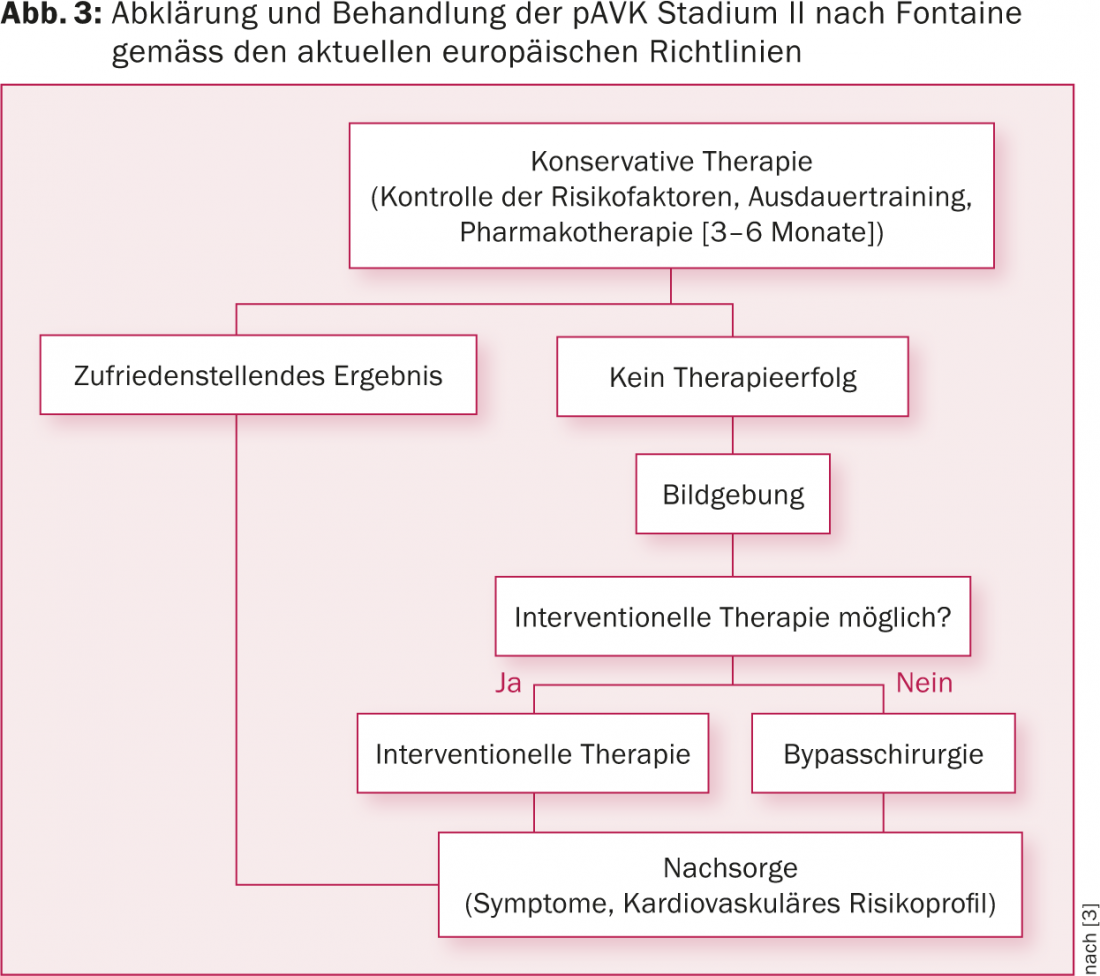
Secondo le attuali linee guida, si raccomanda un approccio multimodale per i pazienti con PAOD [3]. Questo include l’ottimizzazione dei fattori di rischio vascolare, oltre alla terapia farmacologica. Nella pAVK asintomatica (stadio I secondo Fontaine) o nella claudicazione intermittente (stadio II secondo Fontaine), si può adottare un approccio conservativo per tre-sei mesi. A differenza della formazione indipendente, la formazione supervisionata riceve una raccomandazione di IA [3]. Solo se questo non migliora i sintomi, si raccomanda una procedura interventistica o chirurgica (Fig. 3).
Opzioni terapeutiche
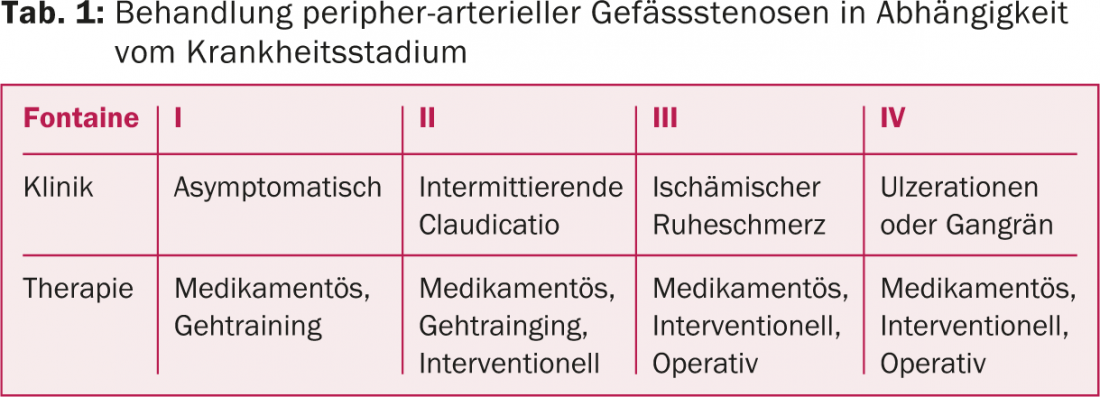
Per trattare le stenosi periferiche, sono indicati l’allenamento alla deambulazione, le terapie interventistiche o chirurgiche, a seconda dello stadio della malattia (Tabella 1).
In molti casi, la PAOD di Fontaine di stadio I e II può essere trattata in modo conservativo. A partire dalla fase II, si ricorre a ulteriori procedure interventistiche. A partire dallo stadio III e IV, un approccio interventistico o chirurgico è di solito il trattamento di scelta.
Di seguito, verranno discusse le opzioni di trattamento conservativo per i pazienti con PAOD.
Terapia farmacologica
L’inibizione dell’aggregazione piastrinica per migliorare la reologia e la terapia con statine sono standard nei pazienti con PAOD. Le statine hanno proprietà pleomorfe oltre al loro effetto ipocolesterolemizzante, che hanno un impatto positivo sulla progressione della PAOD. Oltre a una riduzione significativa degli ictus, le statine hanno portato anche a un aumento della distanza percorsa a piedi rispetto al placebo [4].
Allenamento alla camminata
Le possibilità terapeutiche dell’allenamento (del cammino), che può essere effettuato fino allo stadio II, sono note solo a pochi. Diversi studi hanno dimostrato che un programma di esercizio fisico strutturato nei pazienti con PAOD di stadio I e II è equivalente alla terapia interventistica in termini di aumento della distanza di deambulazione senza dolore e assoluta [5]. Inoltre, i pazienti con un approccio terapeutico basato sull’esercizio fisico per il trattamento della PAOD richiedono complessivamente meno procedure invasive [5], e si tratta di una terapia efficace dal punto di vista dei costi [6] (Fig. 4).
L’allenamento provoca un miglioramento della funzione endoteliale e della capillarizzazione, nonché un migliore esaurimento dell’O2 in periferia [7]. Negli studi non è stato possibile dimostrare un aumento della collateralizzazione. La migliore perfusione porta a un’economia delle sequenze di movimento e a un rimodellamento della muscolatura, che si traduce in un ulteriore miglioramento delle prestazioni. È interessante che si possa dimostrare un miglioramento della distanza di cammino senza dolore per diverse forme di allenamento [8]. Oltre all’allenamento per la corsa, si sono potuti dimostrare effetti positivi anche per l’ergometro o l’allenamento della forza, e anche l’allenamento della parte superiore del braccio è risultato efficace [9]. I pazienti che possono partecipare all’allenamento per la deambulazione solo in misura limitata possono quindi utilizzare forme alternative di allenamento per migliorare la loro condizione e prolungare la distanza di deambulazione. Questo tipo di allenamento alternativo può essere considerato anche nella fase III, secondo Fontaine, mentre l’allenamento basato sul movimento è controindicato nella fase IV. Gli effetti positivi dell’allenamento sono attesi soprattutto nei pazienti con lesioni prossimali, dove si possono ancora misurare buone pressioni di chiusura della caviglia (ottimale >80 mmHg). Una lunga storia medica o una malattia concomitante limitante, entrambe in grado di limitare l’allenamento fisico, hanno un effetto sfavorevole sul successo dell’allenamento.

Miglioramento del profilo di rischio cardiovascolare
Un miglioramento della prognosi dei pazienti con PAOD si ottiene solo migliorando il profilo di rischio cardiovascolare [7]. Il fattore di rischio più importante, ma anche il più difficile da controllare, è il fumo di sigaretta. Il consumo di sigarette porta a una progressione più rapida della PAOD, a un aumento delle amputazioni e a un incremento significativo della mortalità cardiovascolare [10]. Ipertensione, ipercolesterolemia, obesità e diabete sono altri fattori di rischio che hanno un impatto sulla prognosi [11]. La regolazione ottimale della pressione arteriosa può ridurre gli eventi cardiovascolari. In generale, si punta a valori di pressione arteriosa <140/90 mmHg – la controindicazione per i beta-bloccanti che esisteva dalla fase III in poi è stata eliminata. Nei diabetici, si deve sempre raggiungere un’HbA1c inferiore a 6,5 e si deve puntare a valori di pressione arteriosa inferiori a 130/85 mmHg [12]. In caso di terapia con statine, il valore target per il colesterolo LDL è <1,8 mmol/l.
Terapia completa attraverso la riabilitazione PAVK – Il miglior trattamento medico?
Un programma di riabilitazione ambulatoriale specifico per la PAOD (Tabella 2) è attualmente l’unica opzione per un trattamento completo dei pazienti. I costi di questo programma di riabilitazione ambulatoriale di dodici settimane sono coperti dai fondi di assicurazione sanitaria. La combinazione di una formazione supervisionata e guidata da professionisti, insieme alla modifica dei fattori di rischio e all’ottimizzazione della terapia farmacologica attraverso un attento monitoraggio da parte dei medici e dei servizi associati, consente un miglioramento dei sintomi e della prognosi [13]. La continuità dell’assistenza offre ai pazienti un supporto per apportare i cambiamenti comportamentali necessari.
In generale, con l’allenamento si può ottenere un aumento della distanza percorsa a piedi del 50-200%. Per ottenere un successo ottimale (cioè un miglioramento della distanza percorsa a piedi), l’allenamento appropriato deve essere eseguito almeno tre volte alla settimana per 30 minuti per un periodo di almeno tre mesi [14]. L’addestramento supervisionato è superiore all’addestramento indipendente [15,16].
Nell’ambito di un programma di riabilitazione, i pazienti sono motivati a praticare un’attività fisica regolare e, in particolare, ad apprendere un allenamento adeguato ed efficiente della deambulazione. Il programma di formazione di solito comprende diverse forme di allenamento per rivolgersi al maggior numero possibile di pazienti e per motivarli a integrare l’attività fisica nella loro vita quotidiana. Quindi, l’allenamento della corsa viene svolto in alternanza con altre forme di allenamento. Ai pazienti viene chiesto di correre a un’intensità prestabilita fino all’insorgere del dolore, dopodiché si fa una pausa fino al recupero del dolore. Il concetto di allenamento nell’intervallo del dolore è stato abbandonato a causa della ridotta compliance del paziente. Inoltre, non è stato possibile dimostrare con certezza il beneficio aggiuntivo di tale allenamento “nell’area dell’ischemia”.
Per trattare al meglio i fattori di rischio secondari, l’anamnesi del fumo e la volontà di smettere di fumare sono valutati da una consulenza specializzata per smettere di fumare. Se c’è il desiderio di smettere di fumare, viene eseguita una terapia comportamentale con il supporto di farmaci, se necessario. La disponibilità di questi servizi nei programmi di riabilitazione consente ai pazienti di accedervi facilmente – la stretta supervisione durante il programma di riabilitazione aumenta le possibilità di successo. Le lezioni di accompagnamento e la consulenza nutrizionale completa favoriscono un cambiamento comportamentale autoresponsabile, che a lungo termine migliora il profilo di rischio e la prognosi. Con il supporto di uno psicologo, spesso è possibile modificare meglio i fattori psicosociali che influenzano la compliance e il successo del trattamento a lungo termine.

Sommario
I programmi di riabilitazione strutturati per i pazienti affetti da PAOD implementano il concetto di terapia multimodale raccomandato dalle linee guida. I pazienti imparano un allenamento strutturato ed efficiente e migliorano il loro profilo di rischio cardiovascolare, il che spiega i risultati positivi a lungo termine con un tasso di intervento complessivamente inferiore. La riabilitazione multimodale è l’unico concetto di terapia che va oltre il trattamento dei sintomi locali a lungo termine e quindi migliora anche la prognosi dei pazienti. I costi del programma sono coperti dalle compagnie di assicurazione sanitaria secondo l’Ordinanza sulle prestazioni sanitarie in Svizzera.
Letteratura:
- Selvin E, Erlinger TP: Prevalenza e fattori di rischio della malattia arteriosa periferica negli Stati Uniti: risultati del National Health and Nutrition Examination Survey, 1999-2000. Circolazione 2004; 110(6): 738-743. Epub 2004/07/21.
- Spronk S, et al: Impatto della claudicazione e del suo trattamento sulla qualità della vita. Seminari di chirurgia vascolare 2007; 20(1): 3-9. Epub 2007/03/28.
- Tendera M, et al.: Linee guida ESC sulla diagnosi e il trattamento delle malattie delle arterie periferiche: documento che copre la malattia aterosclerotica delle arterie carotidee e vertebrali extracraniche, mesenteriche, renali, degli arti superiori e inferiori: la Task Force sulla diagnosi e il trattamento delle malattie delle arterie periferiche della Società Europea di Cardiologia (ESC). European heart journal 2011; 32(22): 2851-2906. Epub 2011/08/30.
- Mohler ER, Hiatt WR, Creager MA: La riduzione del colesterolo con atorvastatina migliora la distanza da percorrere a piedi nei pazienti con malattia arteriosa periferica. Circolazione 2003; 108(12): 1481-1486. Epub 2003/09/04.
- Fakhry F, et al: Efficacia clinica a lungo termine della terapia di esercizio supervisionata rispetto alla rivascolarizzazione endovascolare per la claudicazione intermittente, da uno studio clinico randomizzato. The British journal of surgery 2013; 100(9): 1164-1171. Epub 2013/07/12.
- Spronk S, et al.: Costo-efficacia delle nuove strategie di riabilitazione cardiaca e vascolare per i pazienti con malattia coronarica. PloS one 2008; 3(12): e3883. Epub 2008/12/10.
- Hamburg NM, Balady GJ: Riabilitazione all’esercizio fisico nella malattia arteriosa periferica: impatto funzionale e meccanismi dei benefici. Circolazione 2011; 123(1): 87-97. Epub 2011/01/05.
- Lauret GJ, et al: Modalità di allenamento per la claudicazione intermittente. Cochrane Database Syst Rev 2014; 7: CD009638. Epub 2014/07/06.
- Parmenter BJ, et al: Una revisione sistematica degli studi randomizzati e controllati: la camminata rispetto alla prescrizione di esercizi alternativi come trattamento della claudicatio intermittens. Atherosclerosis 2011; 218(1): 1-12. Epub 2011/05/24.
- Lu L, Mackay DF, Pell JP: Meta-analisi dell’associazione tra fumo di sigaretta e malattia arteriosa periferica. Cuore 2013. Epub 2013/08/08.
- Kjeldsen SE, Aksnes TA, Ruilope LM: Implicazioni cliniche delle Linee Guida ESH/ESC 2013 sull’ipertensione: obiettivi, scelta della terapia e monitoraggio della pressione arteriosa. Farmaci in R&S 2014; 14(2): 31-43. Epub 2014/05/21.
- Adam DJ, Bradbury AW: Documento TASC II sulla gestione della malattia arteriosa periferica. European journal of vascular and endovascular surgery : la rivista ufficiale della Società Europea di Chirurgia Vascolare 2007; 33(1): 1-2. Epub 2006/12/13.
- Norgren L, et al: Consenso intersocietario per la gestione della malattia arteriosa periferica (TASC II). European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery 2007; 33 Suppl 1: S1-75. Epub 2006/12/05.
- Gardner AW, Poehlman ET: Programmi di riabilitazione con esercizio fisico per il trattamento del dolore da claudicazione. Una meta-analisi. JAMA : la rivista dell’Associazione Medica Americana 1995; 274(12): 975-980. Epub 1995/09/27.
- Bendermacher BL, et al: Terapia di esercizio supervisionata rispetto alla terapia di esercizio non supervisionata per la claudicazione intermittente. Cochrane Database Syst Rev 2006(2): CD005263. Epub 2006/04/21.
- Fakhry F, et al: Terapia del cammino supervisionata nei pazienti con claudicatio intermittens. Journal of vascular surgery 2012; 56(4): 1132-1142. Epub 2012/10/03.
CARDIOVASC 2014; 13(6): 30-33