Il ferro è essenziale per diverse funzioni biochimiche e fisiologiche. La carenza di ferro è molto diffusa ed è una delle principali cause di anemia. Come profilassi, è importante un apporto adeguato di ferritina attraverso la dieta. In presenza di una carenza di ferro, si può ricorrere alla sostituzione per via orale o endovenosa, ma l’efficacia e la tollerabilità variano da individuo a individuo.
Il ferro è uno dei quattro elementi più comuni della crosta terrestre. È un oligoelemento importante per tutte le creature viventi, compresi gli esseri umani. Deve il suo ruolo essenziale nella biologia alla capacità di trasportare e legare reversibilmente gli elettroni. Nell’emoglobina, ad esempio, è responsabile di garantire che l’ossigeno, altamente elettronegativo, possa essere trasportato in modo efficace. Per lo stesso motivo, il ferro è un componente centrale di numerosi sistemi enzimatici che si occupano di molte funzioni biochimiche e fisiologiche.
Più di 1,2 miliardi di persone nel mondo soffrono di carenza di ferro [1]. Questa è una delle principali cause di anemia [2]. In Europa, le raccolte di dati tra le donne in età fertile mostrano una prevalenza di carenza di ferro del 10-32%, con una prevalenza stimata di anemia del 2-5%. La percentuale di donne con basse riserve di ferro è stimata al 40-55% [3]. Le prevalenze di carenza di ferro nei bambini piccoli sono state registrate localmente e hanno mostrato valori del 4-48%. Quindi, i bambini piccoli rappresentano un altro gruppo di rischio per la carenza di ferro [4].
Perché uno degli elementi più diffusi è allo stesso tempo responsabile di una pesante carenza globale? Il motivo risiede nella capacità del ferro di promuovere la formazione di radicali reattivi tossici. Inoltre, il ferro è praticamente insolubile in forma libera a pH fisiologico (cioè ovunque nel corpo, tranne che nell’acido gastrico). L’assorbimento del ferro è quindi naturalmente limitato. Per essere utilizzato, deve essere assunto in forma legata: associato a proteine che possono legarlo in modo forte ma reversibile.
Metabolismo e assorbimento del ferro
Ad oggi, non è noto alcun meccanismo di escrezione attiva del ferro; l’escrezione renale è irrilevante per l’equilibrio del ferro. Il bilancio del ferro umano deve quindi essere regolato attivamente durante l’assorbimento dal cibo nell’intestino tenue, dove gli enterociti svolgono un ruolo chiave.
Il ferro negli alimenti esiste in due forme principali: Ferro eme (nei prodotti animali) e ferro non eme (nei prodotti animali e non animali). Viene assorbito principalmente nell’intestino tenue, dove il pH del contenuto intestinale aumenta successivamente lungo un gradiente fino a raggiungere quasi la neutralità. Il ferro non ematico proveniente dagli alimenti diventa più insolubile lungo questo gradiente, e questo è probabilmente il motivo per cui l’assorbimento nell’intestino distale svolge un ruolo subordinato. La solubilità del ferro nell’intestino tenue è un fattore importante per l’assorbimento del ferro dagli alimenti e può essere influenzata in modo significativo dalla composizione di un pasto.
A livello cellulare, il ferro ematico e il ferro non ematico vengono assorbiti da diversi trasportatori. Entrambi contribuiscono alla concentrazione di ferro negli enterociti, che è fondamentale per la regolazione del ferro cellulare. Ha un’influenza diretta sulla conformazione delle proteine di risposta al ferro (IRPs), che controllano la sintesi delle proteine di trasporto cellulare. Quindi, il ferro interviene direttamente nella sintesi dei meccanismi di trasporto che lo importano o lo esportano nella cellula. Questo è particolarmente importante per il controllo dell’equilibrio sistemico del ferro negli enterociti, nei macrofagi e negli epatociti.
Un secondo componente regolatore ad azione sistemica è l’ormone epcidina, che viene sintetizzato nel fegato. L’epcidina è regolata da diversi segnali: L’aumento dell’eritropoiesi o l’ipossia portano a basse concentrazioni, mentre gli stimoli infiammatori/infettivi (interleuchina-6) e lo stato del ferro proprio dell’organismo (saturazione della transferrina) aumentano la sintesi. L’epcidina si lega all’unico esportatore di ferro cellulare conosciuto, la ferroportina, portando alla sua degradazione. In questo modo, il ferro rimane nelle cellule e non può più entrare nel flusso sanguigno, che a sua volta influisce sulle IRP e sulla sua cascata di reazioni. Dato che questo processo è regolato a livello sistemico, riguarda tutti i tipi di cellule. Un equilibrio del ferro è quindi il risultato dei processi di tutti i singoli equilibri cellulari del ferro e della loro orchestrazione sistemica da parte dell’epcidina [5]. La scoperta di questo ormone negli anni 2000 ha ampliato notevolmente la comprensione della regolazione del ferro: l’elevazione cronica dell’epcidina porta a un’anemia marcata che non può essere corretta, o può essere corretta solo parzialmente, dall’assunzione di ferro per via orale; ad esempio, l’anemia causata da malattie infiammatorie o infettive croniche.
Recupero del ferro attraverso il riciclaggio
Il contenuto di ferro negli adulti è di ≈4 g e si trova principalmente nei globuli rossi (≈2,8 g). Il 90% del fabbisogno giornaliero è coperto dal recupero dei vecchi globuli rossi. Questo ciclo di riciclaggio avviene tra midollo osseo, globuli rossi e macrofagi. Nel midollo osseo vengono prodotti i globuli rossi (≈300 mg), i macrofagi raccolgono i vecchi eritrociti, li scompongono e rilasciano il ferro nel flusso sanguigno, dove può essere nuovamente utilizzato dal midollo osseo (≈600 mg). Le riserve di ferro variano individualmente e si trovano principalmente nel fegato. Il ferro da trasportare nel flusso sanguigno è legato alla transferrina, che costituisce una percentuale dinamica ma piccola (3-4 mg) del contenuto totale di ferro. Questa frazione è responsabile del trasporto tra le cellule e i tessuti ed è quindi di grande importanza funzionale.
Il 10-20% del fabbisogno giornaliero di ferro (1-2 mg) deve essere assunto attraverso l’alimentazione per compensare le naturali perdite giornaliere di ferro (ad esempio, attraverso piccole emorragie, attraverso le membrane mucose, ecc.) Poiché la quantità da assorbire al giorno è molto piccola rispetto al contenuto dell’organismo, la carenza di ferro può derivare solo da un deficit di ferro a lungo termine. Le donne giovani, le donne incinte o i bambini sono più spesso colpiti, poiché la perdita di sangue durante le mestruazioni e la crescita comportano un maggiore fabbisogno di ferro.
L’anemia aumenta il rischio di complicazioni della gravidanza e può portare a un parto prematuro. La carenza di ferro può essere cronica e asintomatica. Dal punto di vista sintomatico, si manifesta con stanchezza, mancanza di concentrazione, irritabilità, ridotta tolleranza al freddo, mancanza di respiro durante l’attività fisica, sindrome da pica e sindrome delle gambe senza riposo. Altri sintomi includono pallore cutaneo e congiuntivale, stomatite e koilonychia.
Biomarcatore di carenza di ferro
Le misure biochimiche dello stato del ferro riflettono la dimensione relativa dei diversi compartimenti e allo stesso tempo informano sullo stato generale del ferro dell’organismo. Il gold standard è la misurazione del contenuto di ferro nel midollo osseo. Se questo valore è troppo basso, viene riciclato troppo poco ferro nella circolazione del corpo. questo deficit non può essere compensato dalla dieta o dalle riserve epatiche, con conseguente riduzione dell’eritropoiesi e anemia.
Un segno di anemia da carenza di ferro è anche l’aumento dell’emoglobina dopo la somministrazione di ferro nei pazienti anemici.
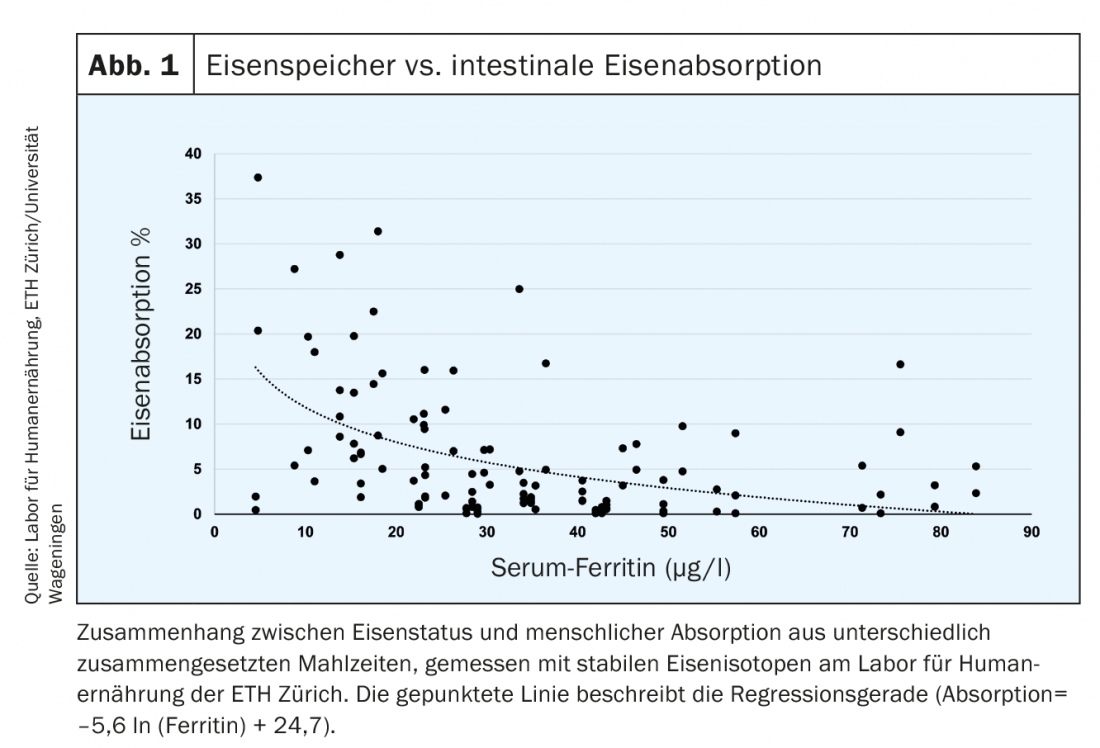
Inoltre, l’assorbimento di ferro misurato con isotopi di ferro radioattivi o stabili è aumentato nei pazienti con carenza di ferro (Fig. 1) [6]. Nelle persone sane, i limiti di ferritina sierica (SF) sono linearmente correlati alle riserve di ferro. 1 µg/l di SF corrisponde a circa 120 µg di riserve di ferro/kg di peso corporeo o circa 8-10 mg di riserve di ferro [7]. Il valore limite definito di 15 µg/l indica l’assenza di ferro rilevabile nel midollo osseo e riflette le riserve vuote. Un’ulteriore riduzione del valore al di sotto dei 15 µg/l non ha quindi alcun significato quantitativo. Dal punto di vista biochimico, SF è la molecola di stoccaggio intracellulare del ferro e riflette l’accumulo di ferritina intracellulare nei macrofagi e negli epatociti. Nei pazienti sani, l’SF riflette quindi le riserve di ferro nel fegato. Con l’eritropoiesi difettosa (talassemia), si verifica un accumulo di ferro intercellulare nei macrofagi, che porta anche ad un aumento della ferritina. Durante un’infezione o un’infiammazione, il livello di epcidina aumenta. Il ferro cellulare viene esportato solo in misura ridotta e deve essere immagazzinato a livello cellulare (nelle molecole di ferritina). Questo può portare a un “falso” aumento della ferritina, che in questo caso non indica un aumento delle riserve di ferro.
Nei pazienti con malattie infettive o infiammatorie, occorre quindi determinare un altro marcatore: il recettore solubile della transferrina nel siero (sTfR), che è proporzionale al fabbisogno di ferro delle cellule. In pratica, questo valore riflette la “fame” di ferro delle cellule del midollo osseo. Il quoziente di SF e sTfR si è dimostrato molto predittivo [8]. Purtroppo, l’utilissimo marcatore sTfR non è ben standardizzato; diversi metodi definiscono soglie diverse per la carenza di ferro.
La saturazione della transferrina è un altro marcatore utile che rappresenta l’attuale disponibilità di ferro sistemico e diminuisce durante la carenza. Questo marcatore può dare indicazioni su una carenza funzionale di ferro, soprattutto in relazione a un aumento della SF dovuto a infezioni o infiammazioni. Una panoramica dei biomarcatori stabiliti e sperimentali per il ferro è fornita da Lynch et al. [8].
Prevenzione attraverso la giusta alimentazione
La biodisponibilità di ferro della dieta è definita sia dal suo contenuto di ferro che dalla sua composizione [9]. Livelli medio-alti di ferro si trovano nei legumi, nella carne, nelle uova, nei prodotti a base di cereali integrali, negli alimenti arricchiti, nelle noci e nei semi. Il ferro ematico viene assorbito in quantità maggiori (intatte) (20-50%). L’assorbimento è meno sensibile agli inibitori e ai promotori dell’assorbimento del ferro ed è meno influenzato dallo stato personale del ferro. Il ferro non eme, invece, è più sensibile alla composizione della dieta e allo stato del ferro, con conseguente elevata variabilità nell’assorbimento del ferro (2-50%). Nonostante la piccola quantità di ferro eme consumato nella dieta, rappresenta un’alta percentuale dell’assunzione di ferro alimentare, perché è più biodisponibile.
Diversi componenti definiscono l’assorbimento del ferro nell’intestino tenue, che è anche influenzato dalla solubilità: La carne muscolare o l’acido ascorbico (vitamina C) hanno un effetto promozionale. Tuttavia, i cereali e i prodotti integrali, che sono effettivamente ricchi di ferro, contengono acido fitico, che riduce la percentuale di assorbimento. I polifenoli e i tannini del tè e del caffè hanno un effetto simile. L’acido ascorbico contenuto nella frutta e nella verdura contrasta l’inibizione. Sono particolarmente consigliate le combinazioni di alimenti ricchi di ferro e vitamina C (panoramica 1). Una dieta varia con molto acido ascorbico, carne muscolare o pesce, mostra un assorbimento del 15-17% [10].

Integrazione orale e endovenosa
Sebbene l’ottimizzazione della dieta possa essere efficace per la prevenzione primaria della carenza di ferro, l’integrazione è consigliata nei casi di accertata carenza di ferro per correggere rapidamente l’anemia, invertire la carenza di ferro nei tessuti e reintegrare le riserve di ferro.
Gli integratori di ferro sono efficaci, ma possono anche causare effetti collaterali dipendenti dalla dose. In uno studio su pazienti anziani, sono stati somministrati 15, 50 o 150 mg di Fe per tre mesi. Mentre l’efficacia era simile alla fine dello studio, i gruppi che ricevevano 50 e 150 mg di Fe mostravano più effetti collaterali [11].
Il ferro aumenta la concentrazione di epcidina per diverse ore. A dosi ≥60 mg di Fe, l’epcidina aumenta in modo dose-dipendente dopo la somministrazione di un integratore di ferro e rimane elevata fino a 24 ore. Questo aumento è associato a una riduzione dell’assorbimento di circa il 35%. Per questo motivo, gli integratori di ferro possono essere somministrati a giorni alterni per aumentare l’efficienza dell’assorbimento, mantenendo la stessa dose [12]. Inoltre, è stato dimostrato che il frazionamento del dosaggio nell’arco della stessa giornata (ad esempio, 2× 60 mg di Fe invece di 1× 120 mg di Fe) non ha alcun valore aggiunto in termini di aumento dell’assorbimento [13].
Le dosi <60 mg di Fe hanno probabilmente un effetto minore sull’epcidina. Inoltre, dosi minori non solo possono prevenire efficacemente la carenza di ferro, ma hanno anche meno effetti collaterali [14].
Va notato che con l’integrazione orale in dosi minori, l’assorbimento percentuale aumenta, ma la quantità totale di ferro assorbito diminuisce. Quando si consiglia la somministrazione alternata di ferro, si deve quindi prendere in considerazione anche lo stato del ferro. I possibili effetti collaterali devono essere soppesati rispetto all’effetto da ottenere.
Il ferro per via endovenosa è raccomandato come terapia di prima linea per la carenza di ferro grave e sintomatica con anemia [1]. In genere è ben tollerato e raramente presenta effetti collaterali. Eventuali effetti negativi sull’ecosistema intestinale, ad esempio nei pazienti pre-stressati, vengono aggirati. In Svizzera, tuttavia, l’uso più frequente di terapie endovenose ha suscitato critiche, soprattutto a causa dei costi più elevati [15]. L’Ufficio federale della sanità pubblica ha avviato una “Valutazione delle tecnologie sanitarie”.
La terapia per la carenza di ferro e l’anemia da carenza di ferro deve essere personalizzata. La scelta della terapia “giusta” deve tenere conto delle possibili cause, del grado di carenza di ferro, delle comorbidità, della durata della carenza e delle preferenze del paziente. Oltre alle ragioni cliniche/fisiologiche, l’alimentazione e lo stile di vita (sport, contraccezione) svolgono un ruolo importante nella prevenzione delle carenze e nel mantenimento di uno stato di ferro sano dopo la terapia in pazienti altrimenti sani.
Messaggi da portare a casa
- Per la prevenzione della carenza di ferro, si dovrebbe raccomandare una dieta varia, ricca di ferro e con un’elevata biodisponibilità di ferro.
- Con l’integrazione orale, le dosi basse (tra 30 e 60 mg di Fe/giorno) sono meglio assorbite in termini percentuali e probabilmente causano meno effetti collaterali.
- La terapia di integrazione del ferro deve essere il più possibile personalizzata. Si consiglia una terapia orale a giorni alterni (ad esempio, se la carenza di ferro non è grave: 60 mg/giorno, a giorni alterni).
Letteratura:
- Camaschella C: Carenza di ferro. Sangue 2019; 133(1): 30-39.
- Zimmermann MB, Hurrell RF: Carenza nutrizionale di ferro. Lancet 2007; 370(9586): 511-520.
- Milman N, et al: Stato del ferro nelle donne in gravidanza e nelle donne in età riproduttiva in Europa. Am J Clin Nutr 2017; 106(Suppl 6): 1655S-1662S.
- Van der Merwe LF, Eussen SR: Stato del ferro dei bambini piccoli in Europa. Am J Clin Nutr 2017; 106(Suppl 6): 1663S-1671S.
- Hentze MW, et al.: Due per tango: regolazione del metabolismo del ferro nei mammiferi. Cell 2010; 142(1): 24-38.
- Daru J, et al: La ferritina sierica come indicatore dello stato del ferro: cosa dobbiamo sapere? Am J Clin Nutr 2017; 106(Suppl 6): 1634S-1639S.
- Cook JD: Diagnosi e gestione dell’anemia da carenza di ferro. Best Pract Res Clin Haematol 2005; 18(2): 319-332.
- Lynch S, et al: Biomarkers of Nutrition for Development (BOND)-Iron Review. J Nutr 2018; 148(Suppl 1): 1001S-1067S.
- Hurrell R, Egli I: Biodisponibilità del ferro e valori dietetici di riferimento. Am J Clin Nutr 2010; 91(5): 1461s-1467s.
- OMS/FAO: Fabbisogno di vitamine e minerali nell’alimentazione umana: relazione di una consultazione congiunta di esperti FAO/OMS. Ginevra: OMS/FAO 2004.
- Rimon E, et al.: Stiamo dando troppo ferro? La terapia con ferro a basso dosaggio è efficace negli ottuagenari. American J Med 2005; 118(10): 1142-1147.
- Moretti D, et al.: Gli integratori di ferro per via orale aumentano l’epcidina e diminuiscono l’assorbimento di ferro da dosi giornaliere o due volte al giorno in giovani donne impoverite di ferro. Sangue 2015; 126(17): 1981-1989.
- Stoffel NU, et al: Assorbimento di ferro da integratori orali di ferro somministrati a giorni consecutivi rispetto a giorni alterni e come dosi singole al mattino rispetto a dosi frazionate due volte al giorno in donne con carenza di ferro: due studi controllati randomizzati, in aperto. Lancet Haematol 2017; 4(11): e524-e533.
- Bialkowski W, et al: Le stime del ferro totale corporeo indicano che 19 mg e 38 mg di ferro per via orale sono equivalenti per mitigare la carenza di ferro nei soggetti sottoposti a ripetute flebotomie. Am J Hematol 2017; 92(9): 851-857.
- Giger M, Achermann R: [Sostituzione del ferro nei pazienti ambulatoriali in Svizzera: aumento dei costi associati alla somministrazione endovenosa]. Z Evid Fortibld Qual Gesundhwes 2013; 107(4-5): 320-326.
PRATICA GP 2019; 14(2): 15-18
CARDIOVASC 2020; 19(3): 6-9