Os carcinomas da tiróide podem hoje em dia ser bem diagnosticados graças às modernas técnicas de imagem e têm frequentemente um bom prognóstico. No entanto, a estratificação de risco pós-operatória deve ter lugar num centro com uma tábua dedicada à tiróide.
Com as modernas técnicas de imagem, os nódulos da tiróide estão a ser diagnosticados com cada vez maior frequência. A maioria destes protuberâncias são benignas. Um trabalho e uma análise precisos são, portanto, indispensáveis para evitar intervenções cirúrgicas desnecessárias. No caso de nódulos suspeitos da tiróide, a biopsia com agulha fina e o trabalho citológico são o padrão de ouro para o diagnóstico. Se um carcinoma da glândula tiróide for confirmado citologicamente ou histologicamente, recomenda-se discutir os resultados num painel interdisciplinar da tiróide à medida que as opções de tratamento se tornam mais complexas. A terapia e os cuidados posteriores ideais para o paciente podem então ser determinados por consenso. Este artigo fornece uma visão geral do diagnóstico e tratamento do carcinoma da tiróide. O foco aqui é a terapia. As actuais directrizes internacionais servem de base.
Epidemiologia
O carcinoma da tiróide é um tumor raro com um baixo potencial maligno. É o tumor endócrino mais comum. Na Suíça, são registados cerca de 770 novos casos por ano, o que corresponde a 1,9% de todos os carcinomas. As mulheres são mais frequentemente afectadas do que os homens numa proporção de 2,5:1 [3].
A mortalidade do carcinoma da tiróide é de cerca de 0,4% de todos os tumores malignos. O carcinoma papilífero e folicular da tiróide tem taxas de sobrevivência global de 5 anos de quase 100% e 97%, respectivamente, com uma terapia óptima. Contudo, alguns subtipos histológicos mostram um prognóstico significativamente pior com uma mortalidade ao longo de 10 anos de 10-40%. Para os carcinomas medulares da tiróide, a taxa de sobrevivência global de 5 anos é de 90%. No caso de metástases, o prognóstico é pior. Em contraste com os carcinomas diferenciados da tiróide, o prognóstico do carcinoma anaplásico ou indiferenciado da tiróide é extremamente pobre, com uma taxa de sobrevivência global de 5 anos de 7% [1].
O carcinoma papilífero da tiróide é o carcinoma mais comum da glândula tiróide com uma incidência de 60-80%, seguido pelo carcinoma folicular, medular e anaplásico/undiferenciado da tiróide. Esta última é uma raridade, representando menos de 2% de todos os carcinomas da tiróide.
A incidência do carcinoma papilífero da tiróide está a aumentar para os pequenos carcinomas papilíferos <2 cm, mas para os maiores a incidência e mortalidade é constante. Isto pode ser explicado por um diagnóstico mais frequente de nódulos da tiróide clinicamente não-manifestados. A prevalência de nódulos da tiróide clinicamente não-manifestados aumenta com a idade na população. Em estudos de rastreio, a prevalência de nódulos da tiróide excede 50% em doentes com mais de 60 anos de idade [6].
Diagnóstico
Exame clínico: Se houver suspeita de um nódulo tireoidiano, recomenda-se um breve exame clínico dos tecidos moles do pescoço. Nódulos da tiróide maiores que 1,5 cm podem normalmente ser bem palpados. O diagnóstico clínico também inclui o estado dos gânglios linfáticos. Os gânglios linfáticos ipsilaterais localizados nas regiões da parte inferior do pescoço são suspeitos. A rouquidão do recém-estabelecido também pode ser um sinal de malignidade.
Diagnóstico químico laboratorial: Na clarificação dos nódulos da tiróide em relação à malignidade, o estado da hormona tiróide desempenha um papel subordinado, porque os valores nada dizem sobre a benignidade ou malignidade de um nódulo. A tiroglobulina é um excelente parâmetro de progressão tumoral no carcinoma da tiróide no pós-operatório. No entanto, a tiroglobulina não específica não é adequada para diagnóstico. A situação é bastante diferente com a calcitonina sérica como parâmetro tumoral para o carcinoma medular da tiróide. Em alguns centros, a calcitonina sérica é, portanto, rotineiramente determinada no diagnóstico de nódulos da tiróide.

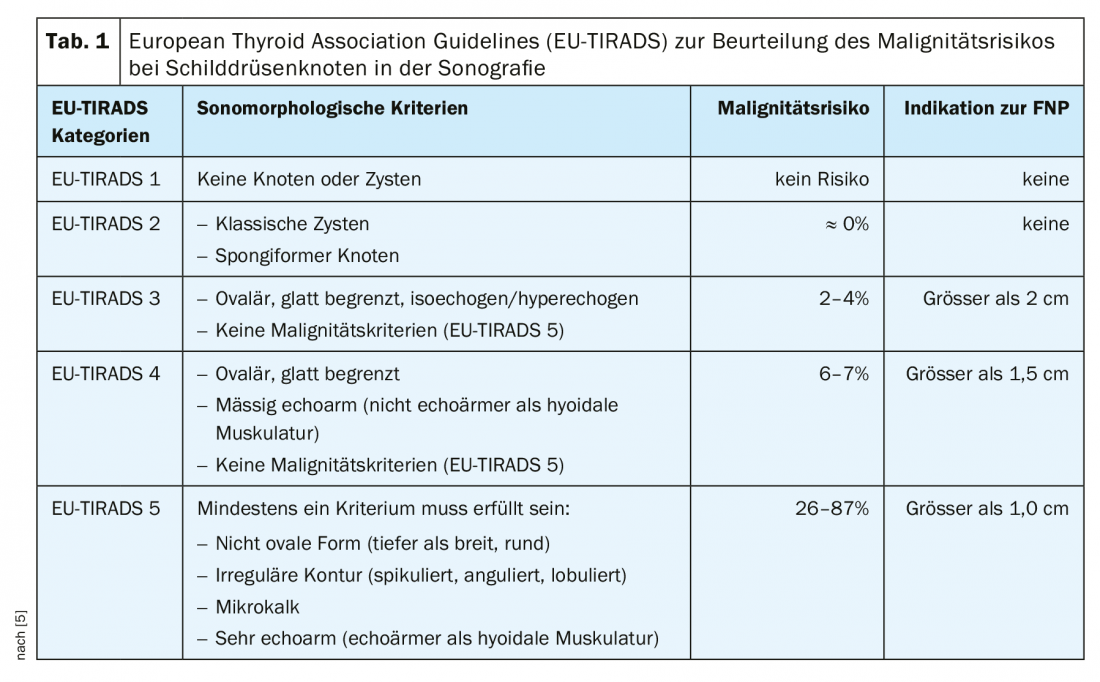
Procedimentos de imagem: O método de exame primário na clarificação de uma massa no pescoço é a ultra-sonografia. Isto permite uma avaliação de alta resolução dos nódulos da tiróide e diagnósticos de localização muito precisos. É aconselhável utilizar um sistema de classificação para avaliar os nódulos da tiróide examinados ultra-sonograficamente. O objectivo de tal sistema de classificação é uma classificação quantitativa dos nódulos da tiróide com as recomendações resultantes, uma nomenclatura normalizada e um relatório normalizado. Nas nossas latitudes, o americano [7] ou europeu [5] TI-RADS (Thyroid Imaging-Reporting and Database System) é frequentemente utilizado (Fig. 2, Tab. 1 [5]).
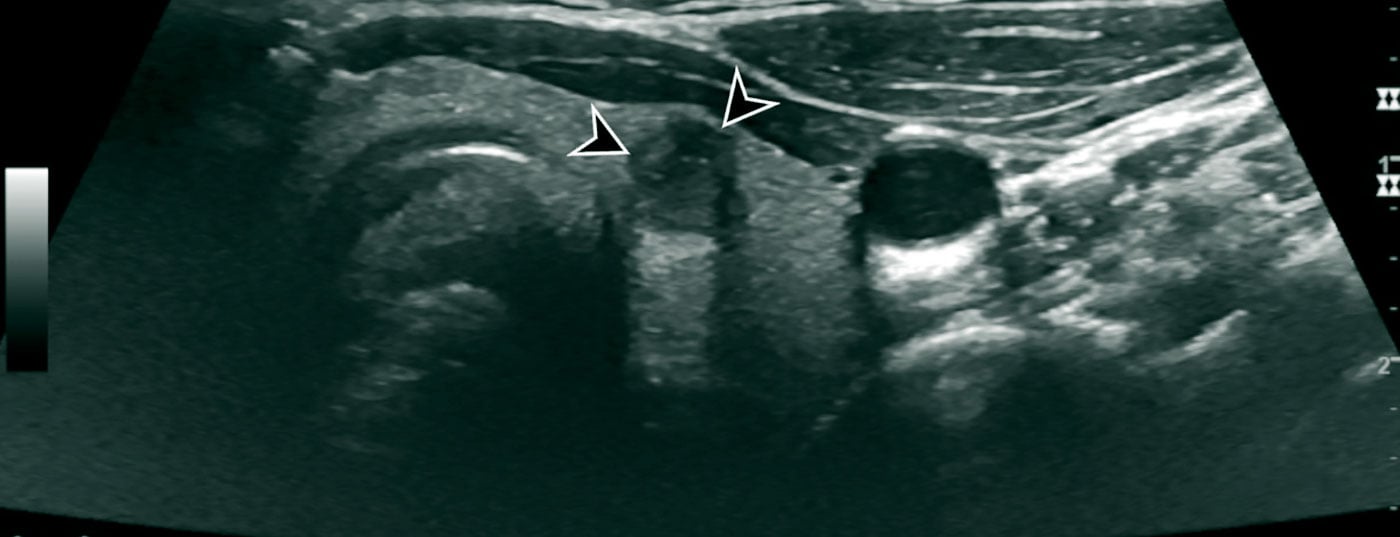
Para além da glândula tiróide, os gânglios linfáticos cervicais e os outros tecidos moles do pescoço devem ser sempre avaliados ultra-sonograficamente. Em certa medida, os tecidos moles do pescoço também podem ser avaliados para infiltração nos carcinomas da tiróide infiltrados.
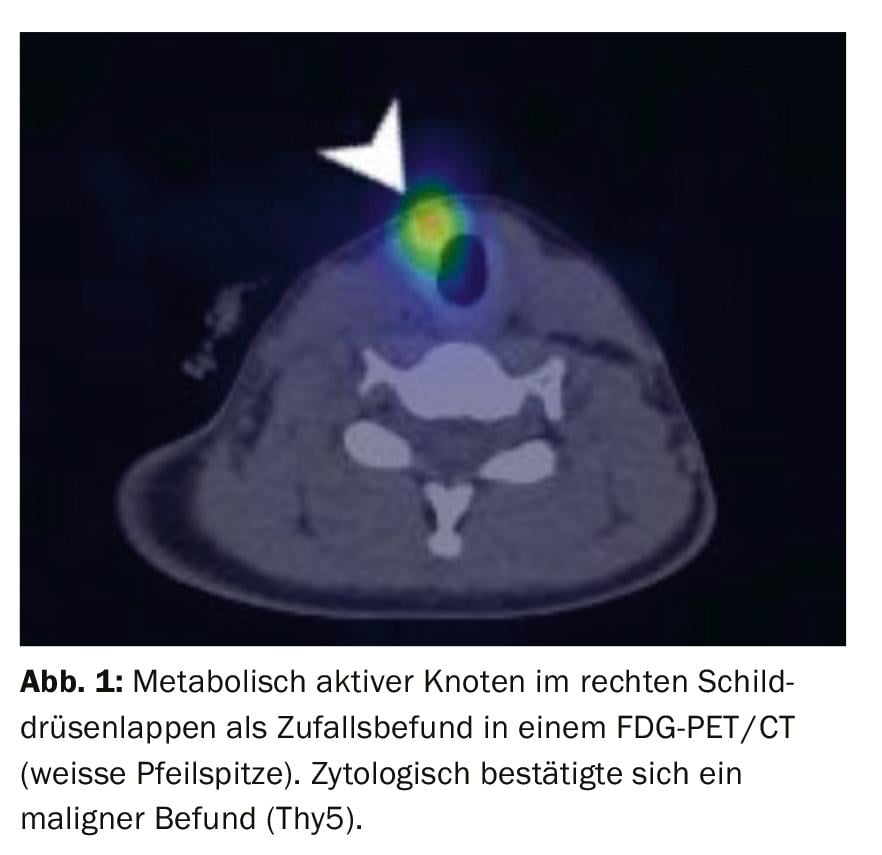
A TC e a RM têm um valor limitado no diagnóstico primário dos nódulos da tiróide. Quando a sonografia atinge o seu limite físico, a avaliação da localização anatómica das grandes glândulas da tiróide que se estendem mediastinalmente e retrotraquealmente pode ser melhor avaliada do que com ultra-sons. Os nódulos da tiróide fosforescentes da Tiróide, detectados aleatoriamente em PET-CT, devem ser perfurados. O potencial maligno de tais nódulos é de cerca de 14-56% [6] (Fig. 1).
Aspiração fina da agulha (FNP) e diagnóstico citológico: A aspiração fina da agulha é de grande importância para o diagnóstico e determinação do procedimento posterior. As células processadas são avaliadas de acordo com uma classificação americana de 6 níveis (classificação Bethesda) ou com uma classificação britânica de 5 níveis (classificação Thy). A partir de um resultado Thy3, o carcinoma já não pode ser excluído. O risco de carcinoma aqui é de 15-40%, com um Thy4 60-70% e com um Thy5 97-100%.
Várias mutações e translocações são utilizadas hoje em dia no diagnóstico de carcinomas da tiróide e tornar-se-ão cada vez mais importantes no futuro. As mutações actualmente mais importantes são RAS, B-RAF e hTERT. Dependendo da dimensão da lesão focal e do diagnóstico citológico, é feita uma estratificação do risco no que diz respeito à terapia e aos cuidados de acompanhamento.
Terapia do carcinoma da tiróide
Cirurgia: A principal terapia para o carcinoma da tiróide é a cirurgia. Se o tumor for completamente removido após o trabalho histológico, o paciente é considerado curado. Este é o caso se o tumor mede menos de 2,0 cm na peça patológica após hemiectomia ou tiroidectomia total, tiver sido completamente removido e mostrar uma diferenciação clássica.
Em todos os outros casos, a tiroidectomia total sob monitorização recorrente é indicada, complementada por dissecção ipsilateral do pescoço, geralmente de nível III-IV e nível VI, dependendo do estado do gânglio linfático. Os riscos intra e pós-operatórios são baixos nos cirurgiões experientes; o principal risco é considerado como hipoparatiroidismo não reversível e lesão do nervo laríngeo. Dependendo da histologia, do estado da TNM e, cada vez mais, das análises genéticas, é determinado o tratamento pós-operatório adequado e o regime de seguimento.
Ablação de radioiodo: Tanto a ATA [2] (American Thyroid Association) como a ETA [4] (European Thyroid Association) desenvolveram directrizes para a indicação de terapia de radioiodo no pós-operatório. Dependendo da histologia, tamanho do tumor primário, multifocalidade, número/tamanho de gânglios linfáticos e genética, os pacientes são classificados como “baixo risco”, “risco intermédio” ou “alto risco” para ATA e “muito baixo”, “baixo” e “alto risco” para ETA. Há acordo em doentes “muito baixos” e “de baixo risco”, onde o risco global de recorrência dentro de 10 anos é inferior a 3%, com ou sem ablação de radioiodo. Há também acordo sobre os pacientes de “alto risco” para os quais a radioterapia reduz significativamente o risco de recidiva no curso de 10 anos. A grande discordância é com os doentes de “risco intermédio”. A ATA sugere a ablação por radioiodo apenas em doentes seleccionados, enquanto que as directrizes europeias não listam doentes de “risco intermédio” e recomendam um procedimento mais agressivo em geral. Com a ajuda desta estratificação de risco, é feita a indicação para uma possível ablação suplementar de radioiodo, os intervalos de exame no seguimento são determinados e o alvo pós-terapêutico TSH é definido.
O objectivo da radioterapia complementar é encontrar e eliminar as células da tiróide ou tumores deixadas para trás após a cirurgia, de modo a que o seguimento seja simplificado por meio de sonografia do pescoço e medições da tiroglobulina. O isótopo 131iodonatural utilizado para terapia é administrado peroralmente em forma de cápsula e acumula-se em 24 horas quase exclusivamente em células da tiróide e células bem diferenciadas do carcinoma da tiróide, sendo metabolizado nestas células. O pré-requisito para tal é a estimulação das células por meio de um aumento da TSH, quer endógena através da abstinência da hormona tiróide ou exógena por meio de rhTSH (Tirogénio). O método escolhido depende da estratificação inicial do risco. As células que absorvem 131iodosão destruídas e decompostas pelo corpo. Desta forma, os resultados residuais no alojamento da tiróide, gânglios linfáticos bem como metástases distantes podem ser tratados com sucesso. O paciente é considerado livre de tumores se não houver descoberta de iodavid seis meses após a cirurgia ou ablação de radioiodo e se o marcador tumoral não for mensurável sob estimulação (geralmente por rhTSH).
Todos os doentes são substituídos por hormonas da tiróide (levothyroxina) no pós-operatório. Em pacientes “muito baixos” (apenas ETA), “baixo”, “risco intermédio” (apenas ATA), um TSH de 0,5-2,0 mU/l, em pacientes de “alto risco” entre 0,1-0,5 mU/l é destinado.
Tratamento de descobertas residuais (doença persistente), metástases e recidivas: Se as metástases distantes iodavidas aparecerem no cintilograma de corpo inteiro sob ablação de radioiodo (mais frequentemente metástases pulmonares ou ósseas), uma segunda terapia com radioiodo é normalmente realizada 4-6 meses após a ablação de radioiodo após terem sido excluídas as metástases não iodavidas através de FDG-PET/CT ou FDG-PET/MRI. O efeito da terapia pode ser medido na cintilografia subsequente de corpo inteiro e no sangue através da determinação da tiroglobulina. Com uma boa resposta, as metástases iodavidas são completamente regredidas e a tiroglobulina diminui até deixar de ser mensurável após 3-6 meses (Fig. 3-5).
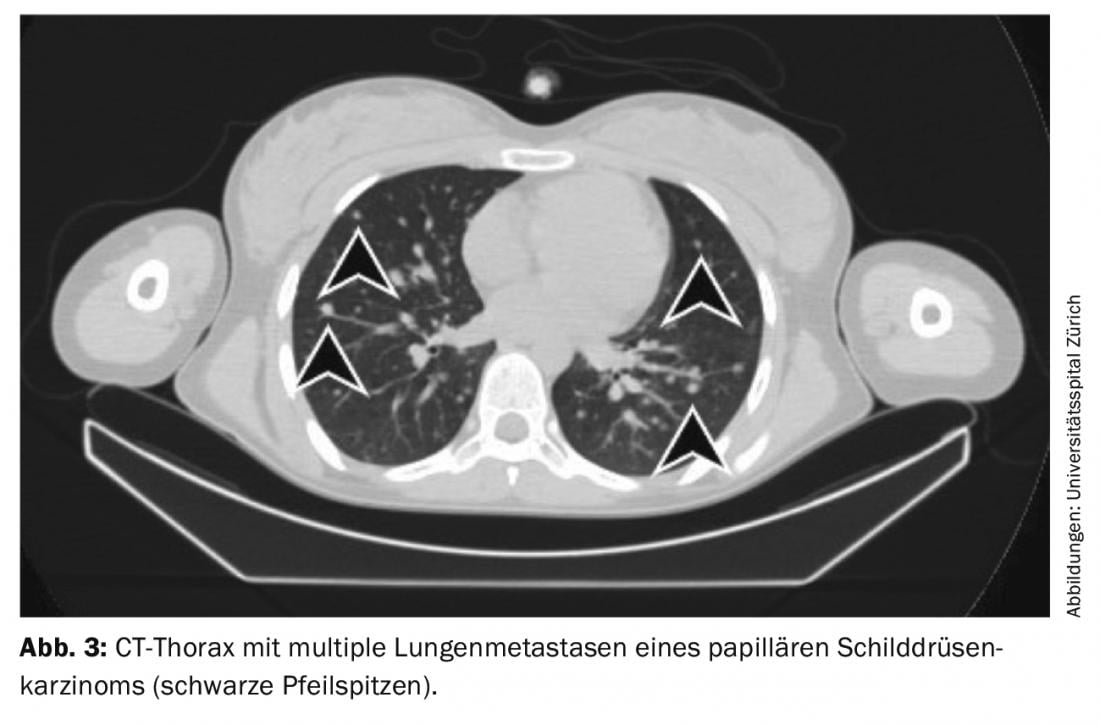
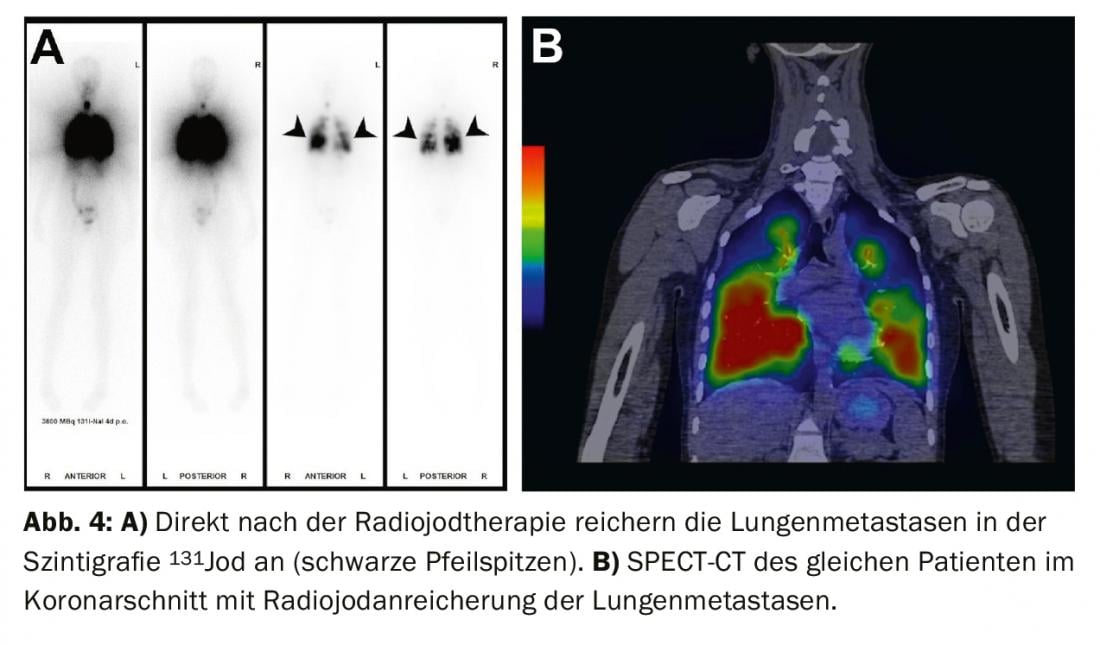
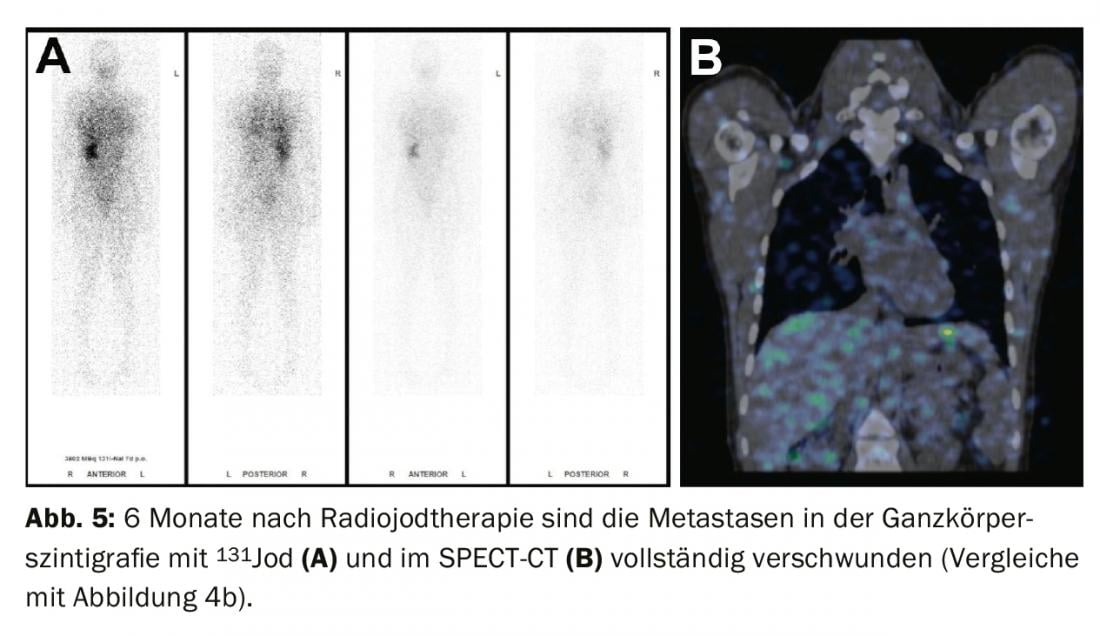
Se a tiroglobulina subir no decurso do seguimento do tumor ou se aparecerem gânglios linfáticos suspeitos na ecografia do pescoço, o diagnóstico deve ser primeiro confirmado citologicamente. A radioterapia é então recomendada com o objectivo de tratar as metástases e completar ou ajustar a encenação.
A radioterapia de repetição pode ser realizada desde que as metástases armazenem iodo e uma gota de tiroglobulina possa ser documentada. No entanto, a cada terapia com radioiodinas, o risco de formação de células tumorais refractárias de radioiodina aumenta. Além disso, de cerca de 22 GBq dose focal cumulativa (correspondente a cerca de 4-5 terapias), o risco de desenvolver um segundo tumor aumenta. As leucemias são as mais comuns. O período de latência é de cerca de 10 anos. A radioterapia está contra-indicada se as metástases se desdiferenciarem, ou seja, já não armazenam iodo ou a tiroglobulina já não cai.
Carcinomas radio-refractários da tiróide: Os carcinomas radio-refractários da tiróide com iodo são raros. A incidência é estimada em cerca de 4 a 5 casos por milhão de habitantes. Afecta principalmente doentes idosos com metástases extensas, carcinomas pouco diferenciados e manifestações de tumores altamente agredidos por FDG. A taxa de sobrevivência de 10 anos para carcinomas da tiróide refractários de radioiodo é de apenas 10% [6].
Opções terapêuticas e gestão dos carcinomas refractários do iodo: Nos carcinomas da tiróide refractários do iodo, a supressão do soro TSH é de grande importância. A substituição da levothyroxina por um alvo TSH de <0.1 mU/l é recomendada em tais situações. As opções terapêuticas são terapia sistémica com inibidores de tirosina quinase ou radioterapia percutânea.
Radioterapia: A radioterapia percutânea pode ser utilizada para metástases ósseas singulares, localmente cervical se houver metástases disseminadas sem correlação morfológica na imagem, ou se o paciente já não estiver operável.
Quimioterapia clássica: A quimioterapia clássica está menos estabelecida no tratamento do carcinoma da tiróide. Por exemplo, os tratamentos com doxorubicina apresentam uma resposta de 0 a 20% com elevada toxicidade. As terapias combinadas com doxorubicina e cisplatina também não são promissoras.
Terapia do alvo molecular – inibidores da tirosina cinase [6]: A terapia do sistema com inibidores de tirosina quinase está mais estabelecida nos carcinomas da tiróide refractários do iodo. A indicação de uma terapia de sistema depende de vários factores. A taxa de progressão de um tumor pode ser avaliada com o tempo de duplicação da tiroglobulina. Contudo, a imagem deve ser sempre utilizada para confirmar a progressão do tumor anatómico usando RECIST (Critérios de Avaliação de Resposta em Tumores Sólidos). O progresso é definido como um aumento da dimensão das lesões alvo em mais de 20% ou em mais de 5 mm, progressão significativa da dimensão das lesões não alvo, ou aparecimento de novas lesões.
Em doentes com metástases múltiplas >1-2 cm e progressão de RECIST dentro de 12 meses, recomenda-se a terapia sistémica. Em contraste, para poucas e pequenas metástases <1 cm sem progressão RECIST dentro de 12 meses, nenhuma terapia de sistema é recomendada. Em vez disso, pode ser adoptada uma abordagem de esperar para ver com imagens regulares e verificações laboratoriais (“vigilância activa”).
Os inibidores da tirosina cinase são principalmente anti-angiogénicos, e levam à inibição do crescimento das células tumorais. A sobrevivência sem progressão versus placebo é de 18,3 versus 3,6 meses para o lenvatinibe, 10,8 versus 5,8 meses para o sorafenibe e 11,1 versus 5,9 meses para o vandetanibe [6].
A resposta tumoral é observada principalmente em metástases linfonodais, metástases hepáticas e pulmonares. As metástases ósseas mostram uma resposta tumoral mais fraca. As metástases ósseas progridem frequentemente durante a terapia com inibidores de tirosina quinase, apesar de uma resposta das metástases de outros órgãos ou gânglios linfáticos. Nestes casos, a administração adicional de bisfosfonatos ou denosumab pode ser discutida. Em dois terços dos casos, as complicações das metástases ósseas desenvolvem-se no prazo de um ano.
A duração óptima da terapia não é conhecida. Muitas vezes, a terapia é mantida até que os efeitos secundários (diarreia, fadiga, toxicidade cutânea, hipertensão, aumento da necessidade de tiroxina, toxicidade hepática, hemorragia, trombose, formação de fístulas gastrointestinais, insuficiência cardíaca) se tornem prevalentes ou se observe a progressão de tumores. Não é claro se o tratamento deve ser continuado no caso de apenas uma ligeira progressão do tumor ou no caso de resposta e progressão simultânea do tumor. Os pacientes com interrupções mais longas entre ciclos terapêuticos mostram um risco acrescido de progressão acelerada do tumor.
Mensagens Take-Home
- Os doentes com carcinomas da tiróide bem diferenciados têm geralmente um prognóstico muito bom.
- Uma boa avaliação pré-operatória serve para optimizar o planeamento cirúrgico.
- A estratificação de risco pós-operatória deve ter lugar num centro com uma tábua dedicada à tiróide.
- A terapia pós-operatória e o acompanhamento devem ser efectuados num centro de tiroideia para doentes com uma situação de “risco intermédio” ou superior.
Literatura:
- ACS. Sociedade Americana contra o Cancro [Internet]. 2019 [cited 2019 Sep 23];Disponível em:
- Haugen BR, Alexander EK, Bible KC, et al: 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Tiróide. 2016; doi:10.1089/thy.2015.0020
- NICER. Instituto Nacional de Epidemiologia e Registo do Cancro [Internet]. 2019 [cited 2019 Sep 23]; Disponível em:
- Pacini F, Schlumberger M, Dralle H, et al: Consenso europeu para a gestão de doentes com carcinoma diferenciado da tiróide do epitélio folicular. Eur. J. Endocrinol. 2006; doi:10.1530/eje.1.02158
- Russ G, Bonnema SJ, Erdogan MF, et al: European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur. Tiróide J. 2017; doi:10.1159/000478927
- Schlumberger M, Pacini F, Tuttel RM: Tumores da tiróide. 4ª ed. tcgraphite; 2015.
- Tessler FN, Middleton WD, Grant EG, et al: ACR Thyroid Imaging, Reporting and Data System (TI-RADS): Livro Branco do Comité do ACR TI-RADS. J. Am. Coll. Radiol. 2017; doi:10.1016/j.jacr.2017.01.046
InFo ONCOLoGy & HEMAToLoGy 2019; 7(5): 6-10.