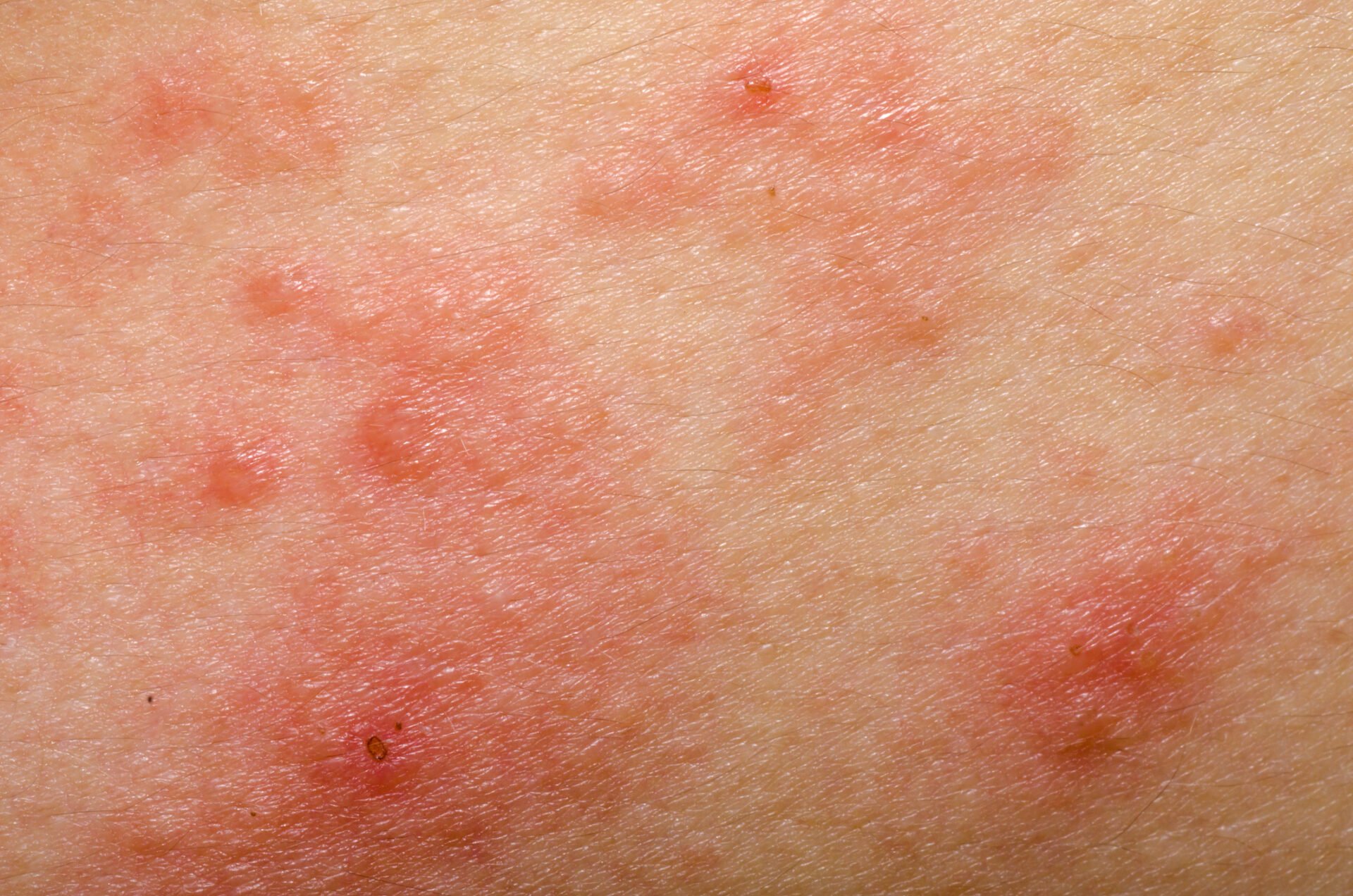
Os mecanismos patológicos da dermatite atópica (DA) estão a ser cada vez mais bem compreendidos. Um desequilíbrio imunológico geneticamente determinado caracteriza-se por uma resposta Th2 aumentada e está associado à produção de citocinas inflamatórias, como a interleucina (IL)-4 e a IL-13. Existem ainda outras moléculas que desempenham um papel importante no processo inflamatório. O panorama da terapia está a mudar. Dois produtos biológicos e três inibidores da Janus quinase estão atualmente autorizados na área de indicação da DA na Suíça, estando outros em desenvolvimento.
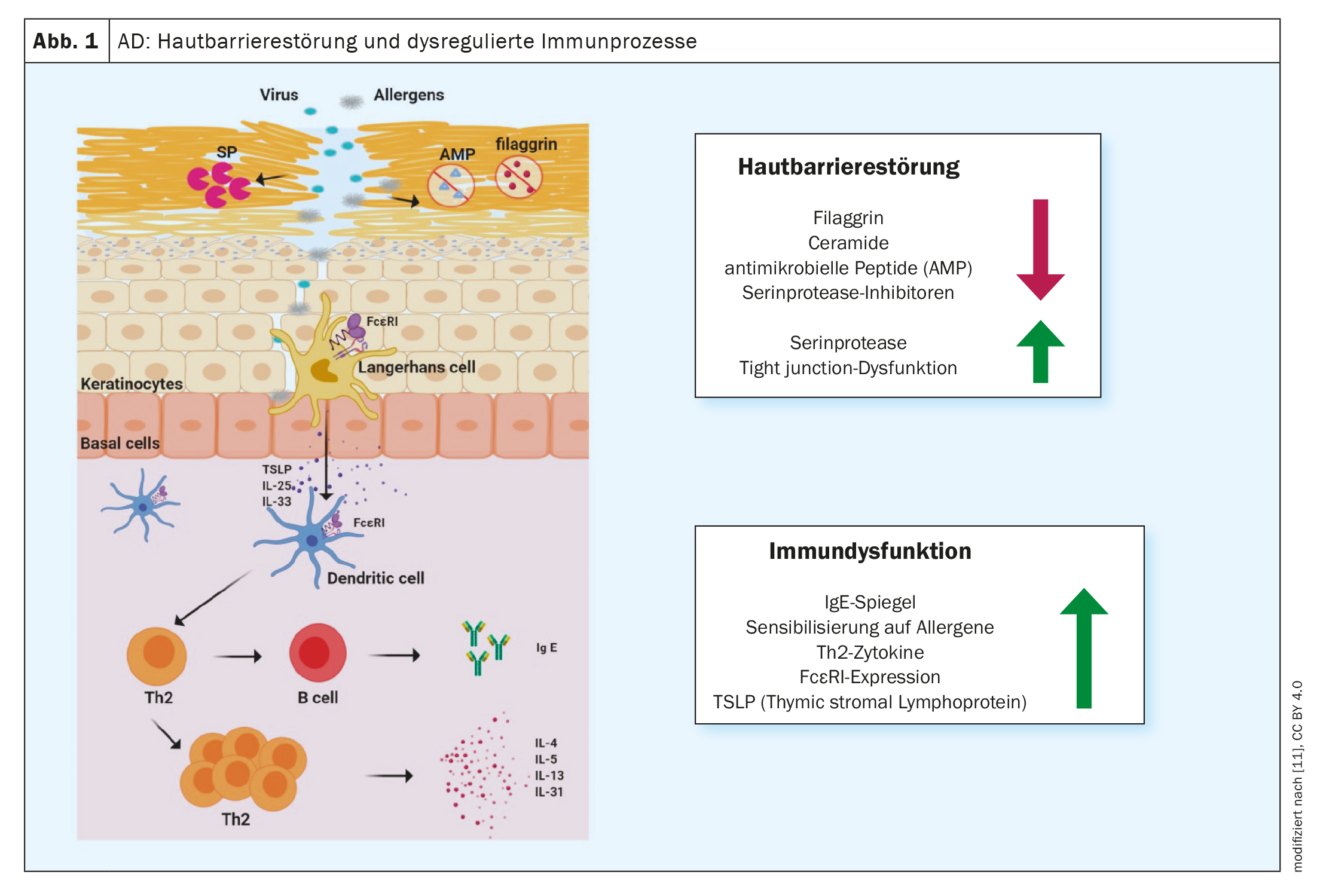
A inflamação do tipo 2 é uma causa comum de várias doenças alérgicas, incluindo a dermatite atópica (DA), a asma brônquica, a rinossinusite crónica, a esofagite eosinofílica e a rinite alérgica [1]. Estão a ser desenvolvidos métodos de tratamento cada vez mais eficazes na luta contra as doenças alérgicas. Os anticorpos monoclonais e os inibidores da Janus kinase (JAK) contribuíram significativamente para melhorar as opções de tratamento, sublinhou o Prof. Dr. Peter Schmid-Grendelmeier, especialista em alergias, Departamento de Dermatologia, Hospital Universitário de Zurique, no congresso anual da Sociedade Suíça de Alergologia e Imunologia [2]. Este desenvolvimento encorajador foi precedido de uma investigação intensiva sobre os processos fisiopatológicos. Sabe-se agora que uma resposta imune T helper (TH)2 dominante está associada à secreção de citocinas como a interleucina (IL)-4, IL-5 e IL-13 (Fig. 1). Este ambiente inflamatório promove não só a geração, maturação e ativação de granulócitos eosinófilos e basófilos, mas também a ativação de mastócitos [3].
Bases moleculares das reacções imunitárias do tipo 2
Em alguns casos, as doenças alérgicas também ocorrem em comorbilidade – por exemplo, há doentes que têm asma grave ou DA e também sofrem de rinite alérgica. Estas comorbilidades podem aumentar ainda mais o peso da doença. A inflamação de tipo 2 é mantida por TH2, células linfóides inatas de tipo 2 (ILC2) e mediadores do sistema imunitário inato e adaptativo [1]. Estudos empíricos mostram que 58-79% de todos os doentes adultos com DA sofrem de pelo menos uma outra doença atópica, independentemente da gravidade [4–6].
As respostas imunitárias do tipo 2 são o correlato celular da inflamação cutânea na DA e também influenciam significativamente a função de barreira e a disbiose microbiana [7]. “Atualmente, sabemos muito sobre a dermatite atópica”, resumiu o orador. Há alguns anos, isto era apenas “bom saber”, mas, entretanto, a crescente compreensão das relações fisiopatológicas levou a várias opções inovadoras de terapia imunomoduladora. Ao contrário dos biológicos, os inibidores da Janus quinase (JAK) não interceptam os sinais das citocinas no espaço extracelular, mas sim intracelularmente.
Biológicos e inibidores de JAK em alta
O primeiro produto biológico aprovado na indicação AD foi o dupilumab (Dupixent®) em 2019. Trata-se de um anticorpo monoclonal dirigido contra a subunidade α do recetor da IL-4, que bloqueia a sinalização dos mediadores inflamatórios IL-4 e IL-13 [8,9]. Esta abordagem de tratamento revelou-se muito eficaz, segundo o Prof. Schmid-Grendelmeier. O tralokinumab (Adtralza®), outro medicamento biológico que neutraliza especificamente a IL-13, está disponível para doentes com DA desde 2022 [8]. Embora estejam atualmente disponíveis menos evidências no mundo real em comparação com o dupilumab, as evidências de eficácia até à data têm sido muito convincentes.
Os inibidores da JAK representam outra abordagem terapêutica promissora. Na Suíça, três inibidores da JAK – baricitinib (Olumiant®), abrocitinib (Cibinqo®) e upadacitinib (Rinvoq®) – ultrapassaram recentemente as barreiras da autorização na indicação AD [8]. Os inibidores da JAK exercem o seu efeito através do mecanismo intracelular JAK-STAT.
| Como anticorpos ou proteínas de fusão, os produtos biológicos bloqueiam uma única citocina extracelularmente ou um recetor de citocina ou uma molécula de superfície na célula, enquanto as JAK-i actuam intracelularmente e modulam várias citocinas. Ao contrário dos medicamentos biológicos, o objetivo do JAK-i é reduzir reversivelmente a atividade de uma ou mais isoformas JAK, à semelhança de um termóstato. O efeito é, portanto, mais amplo e menos específico. |
| para [12] |
Decisão terapêutica baseada em critérios
“Um medicamento biológico actua sobre uma ou duas citocinas e bloqueia-as mais ou menos completamente. Um JAK-i, por outro lado, reduz várias citocinas com diferentes afinidades. Há prós e contras em ambas as abordagens”, explicou o Prof. Schmid-Grendelmeier [2]. A escolha da opção de tratamento deve ser adaptada individualmente ao doente, tendo em conta aspectos como as doenças concomitantes, o estado da infeção e a idade. Os factores situacionais também podem desempenhar um papel nestas considerações; por exemplo, o JAK-i tende a ter um início de ação mais rápido mas, em contraste com os biológicos, requer um rastreio e uma monitorização laboratorial relativamente extensos em paralelo com a terapêutica [10]. Outra diferença importante para a vida quotidiana dos doentes diz respeito à forma de administração: o baricitinib, o abrocitinib e o upadacitinib são tomados por via oral, sob a forma de comprimidos, uma vez por dia, ao passo que os medicamentos biológicos dupilumab e tralokinumab são administrados sob a forma de injecções com intervalos de algumas semanas ou meses. O espetro de tratamento alargado para a DA está agora também refletido na versão actualizada da diretriz S3. Embora o dupilumab já estivesse incluído na versão anterior das directrizes, o tralokinumab, o abrocitinib, o baricitinib e o upadacitinib são agora também abordados [9].
Conclusão e perspectivas
Para os doentes com um elevado grau de gravidade da doença de Alzheimer, as novas opções de tratamento representam um grande avanço, segundo o orador [2]. Mas ainda há muita investigação a fazer. Na Suíça, o dupilumab é, até à data, o único representante do grupo de novas terapêuticas sistémicas (biológicas, JAK-i) que recebeu uma extensão da indicação para doentes pediátricos com DA com idade igual ou superior a 6 anos. O tralokinumab é autorizado na Suíça a partir dos 18 anos de idade e na UE a partir dos 12 anos de idade. No caso do JAK-i, a autorização foi até agora limitada a doentes adultos. Mas isto pode mudar num futuro não muito distante, especialmente porque a utilização de vários produtos biológicos e de JAK-i em doentes pediátricos com DA está atualmente a ser investigada.
Além disso, estão atualmente a ser investigadas outras substâncias activas com novos alvos. Até à data, o lebrikizumab, o nemolizumab, o tezelumab e o Ox-40-Ak revelaram-se candidatos a medicamentos promissores [2]. O lebrikizumab liga-se especificamente à IL-13 que circula livremente e o nemolizumab bloqueia a subunidade α do recetor da IL-31. O tezelumab é um anticorpo contra a TSLP (linfoproteína do estroma tímico) e o Ox-40 é um recetor coestimulador das células T activadas.
Para os doentes com DA moderada a grave, a expansão das opções de tratamento oferece melhores hipóteses de recuperação, desde que o acesso às terapias esteja disponível. Os cuidados básicos com emolientes e a educação do doente continuam a ser pilares importantes do tratamento da DA de qualquer gravidade [2]. Os doentes recebem muitas informações e conselhos valiosos sobre a gestão da doença durante as sessões de formação sobre dermatite atópica.
Congresso: Sociedade Suíça de Alergologia e Imunologia (SSAI), Congresso Anual
Literatura:
- Klimek L, et al: Inflamação do tipo 2: o valor de diferentes produtos biológicos na prática. Dtsch Arztebl 2021; 118(50): [20]; DOI: 10.3238/PersPneumo.2021.12.17.05
- “Dr. Peter Schmid-Grendelmeier, Congresso Anual da SSAI, 24-25 de agosto de 2023.
- Kühn M, et al: Resposta imunitária TH2: importância e influência terapêutica. Swiss Med Forum 2021; 21(0102): 13-17.
- Weidinger S, et al: Dermatite atópica. Nat Rev Dis Primers 2018; 4(1): 2.
- Chiesa Fuxench ZC, Ong P: Poster apresentado na AAD 2018. Poster 6236.
- Drucker AM, et al: The Burden of Atopic Dermatitis: Resumo de um relatório para a Associação Nacional de Eczema. J Invest Dermatol 2017; 137(1): 26-30.
- Lauffer F, Biedermann T: Eczema atópico: um fogo perturbador para uma relação triangular. Dtsch Arztebl 2021; 118(24): [24]; DOI: 10.3238/PersDerma.2021.06.18.04
- Swissmedic: Informações sobre o medicamento, www.swissmedicinfo.ch,(último acesso em 15.11.2023)
- Diretriz S3 “Atopic dermatitis”, registo AWMF n.º: 013-027, a partir de 17/06/2023.
- Worm M, et al: Terapia moderna da dermatite atópica: biológicos e medicamentos de pequenas moléculas. JDDG 2020; 18(10): 1085-1093.
- Yang G, et al: Anomalias da barreira cutânea e disfunção imunitária na dermatite atópica. Revista Internacional de Ciências Moleculares 2020; 21(8): 2867.
www.mdpi.com/1422-0067/21/8/2867,(último acesso em 15 de novembro de 2023) - Choy EH: Significado clínico da seletividade dos inibidores da Janus kinase. Rheumatology (Oxford) 2019; 58(6): 953-962.
DERMATOLOGIE PRAXIS 2023; 33(6): 22-23 (publicado em 12.12.23, antes da impressão)