Para a maioria dos doentes com doenças respiratórias, a inalação é o método de tratamento mais eficaz. Em comparação com as vias de terapia sistémica (oral, i.v., i.m., s.c.), oferece uma clara vantagem de tratamento, uma vez que transporta a substância activa directamente para os pulmões. No entanto, um pré-requisito para tal é que tanto o médico como o doente saibam utilizar correctamente o inalador.
Com a inalação, podem ser administradas doses mais pequenas em comparação com outros métodos. O início da acção é rápido e a incidência de efeitos secundários é baixa, de acordo com outras vantagens listadas pelo Prof. Dr. Omar S. Usmani do Imperial College London no Congresso Respiratório Europeu (ERS) [1]. A questão principal é como levar a dose certa ao lugar certo: “Pode ter a melhor droga, mas se o dispositivo inalador não entregar a droga de forma eficaz e precisa aos pulmões, então a droga não é eficiente! Para alcançar este objectivo, três aspectos são eminentes:
- Formulação e química do aerossol
- Desenvolvimento e concepção do dispositivo
- Formação e técnica de aplicação do paciente.
Formulação
O tamanho, forma e densidade das partículas a inalar são importantes. As partículas porosas de baixa densidade são utilizadas em antibióticos inalados e insulina inalada, e estão a ser desenvolvidas partículas em forma de agulha à base de amianto e vírus de filamentos para utilização em corticosteróides inaláveis.
O tamanho da partícula influencia a quantidade total de ingrediente activo que entra nos pulmões e o local exacto onde é aí entregue. A maioria dos dispositivos utilizados na prática atingem uma gama respirável de 1 µm-5 µm [2]. Já em 2005, um grupo liderado pelo Prof. Usmani testou três tamanhos de partículas diferentes (1,5 µm, 3,0 µm e 6,0 µm) em doentes com asma. Foi demonstrado que a utilização de partículas mais pequenas consegue uma melhor deposição pulmonar e uma maior penetração destes aerossóis nos pulmões (Fig. 1) [3]. O mesmo resultado foi mostrado mais tarde em doentes com DPOC: partículas mais pequenas conseguem uma melhor deposição pulmonar em geral e uma melhor distribuição através das vias respiratórias.
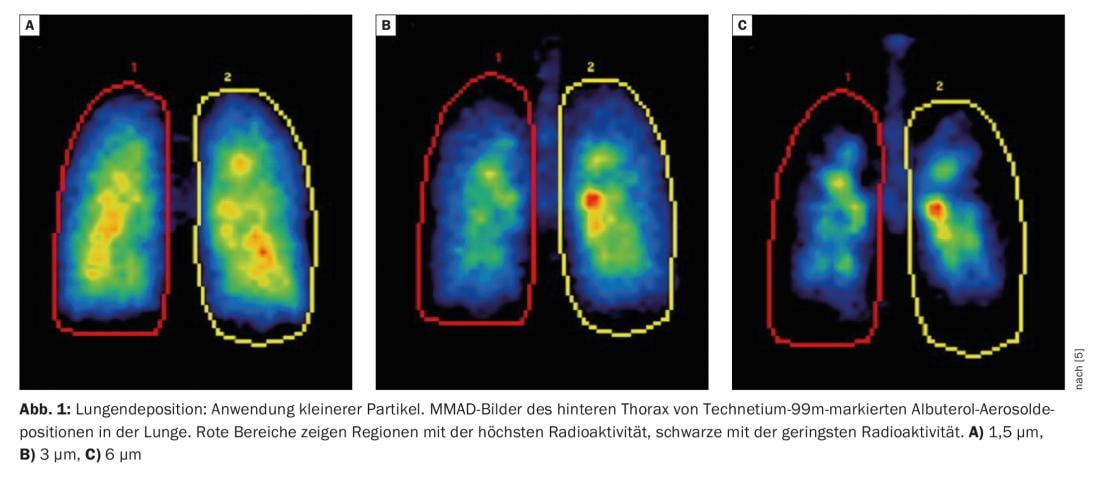
Usmani salientou que o Relatório GOLD 2022 [4] também se refere à importância da deposição periférica e do tratamento extra-fino: “Para o fornecimento de medicamentos às vias respiratórias inferiores e aos pulmões, o tamanho da partícula (diâmetro aerodinâmico médio da massa) pode ser fino (2-5 µm) ou multa extra (<2 µm), o que significa a fracção respirável total (partículas <5 µm), bem como a quantidade e localização do depósito da droga é influenciada (deposição mais periférica com partículas extra-finas)”.
Nos últimos três a quatro anos, tem havido grandes progressos no desenvolvimento clínico da terapêutica inalatória de nanopartículas, disse o perito. O conceito por detrás disto consiste numa camada protectora, a parte terapêutica e as moléculas alvo, ou seja, moléculas na superfície das nanopartículas que guiam todo o pacote até ao seu alvo. Tais nanoterapias estão em desenvolvimento para corticosteróides inalados.
Desenvolvimento e tecnologia de dispositivos
Os inaladores actualmente em uso são na sua maioria inaladores de dose pressurizada (pMDI), inaladores de pó seco (DPI), nebulizadores e inaladores de névoa mole (SMI). Algumas das inovações que médicos e pacientes podem esperar incluir
- MDI, que são névoa macia (uma vez que a emissão da névoa fina permite que o aerossol seja transportado melhor e com maior precisão para os pulmões),
- espaçadores antiestáticos que não precisam de ser preparados e podem ser aplicados imediatamente pelo paciente,
- Os nebulizadores de pó seco que funcionam a pilhas, muito fáceis de utilizar, têm um lembrete de dose e fornecem feedback,
- inalador de névoa macia reutilizável,
- nebulizadores mais pequenos que podem ser segurados na mão.
Usmani destacou particularmente os “nebulizadores inteligentes”, cujo modo de operação já é conhecido pelo tratamento da hipertensão pulmonar e fibrose cística: nebulizadores portáteis, alimentados por bateria, de malha vibratória que instruem os utilizadores a inalar profunda e lentamente, tendo constantemente em conta as alterações na respiração dos pacientes. Os dispositivos podem emitir os aerossóis sempre que o utilizador inalar realmente, conseguindo assim uma deposição de 50-70%. A perda de aerossol durante a exalação é assim minimizada.
Formação e tecnologia de aplicação
O uso sub-óptimo do inalador afecta a eficiência clínica. Isto parece ser uma questão natural, mas ainda não parece ter chegado completamente à prática, como lamentou o Prof. Usmani. Isto não se refere apenas ao cumprimento frequentemente deficiente dos pacientes, mas também ao manuseamento técnico e à aplicação do inalador.
Com os dispositivos pMDI, os erros mais comuns não são a inalação lenta o suficiente, a inalação profunda, ou a coordenação dos dois. A maioria dos pacientes inalaria demasiado depressa e, portanto, não conseguiria obter o melhor efeito possível. Com inaladores de pó seco, por outro lado, a inalação não seria suficientemente forte e profunda. Os DPIs precisariam de um fluxo de pelo menos 60 l/min para funcionarem adequadamente. Na vida real, isto não é exequível por muitos pacientes.
Usmani apresentou o estudo PIFotal, que investigou o pico de fluxo inspiratório (PIF) em doentes com DPOC (n=1434) utilizando inaladores de pó seco para terapia de manutenção [5]. Comparou-se o PIF óptimo com o sub-óptimo (sPIF). sPIF foi definido como um PIF típico mais baixo do que o necessário para a unidade. A técnica de inalação foi avaliada e classificada através de uma avaliação padronizada das gravações de vídeo.
Os doentes foram ainda classificados em três subgrupos clinicamente relevantes com base no seu PIF:
- “Capaz e disposto”: pacientes com PIF ideal
- “Pode mas não pode”: Pacientes com um PIF típico abaixo do PIF óptimo para o seu dispositivo, mas que são capazes de realizar um PIF máximo igual ou mesmo superior ao do grupo PIF óptimo.
- “Não é possível”: Pacientes que têm o seu PIF típico e máximo abaixo do PIF óptimo para o seu dispositivo.
71% dos pacientes tinham uma PIF óptima, 29% de todos os participantes não geraram uma PIF óptima para a sua DPI durante um procedimento de inalação típico [6]. 16% deles mostraram que eram realmente capazes de gerar um PIF óptimo para o seu dispositivo, mas não o conseguiram durante o processo de inalação. Isto pode indicar que a sPIF é uma característica potencialmente tratável na gestão da COPD. Os restantes 13% caíram no último grupo (“Não é possível”), que não foram capazes de atingir o PIF ideal para o seu dispositivo, mesmo com o seu PIF máximo. Este problema poderia provavelmente ser resolvido no futuro por DPIs electrónicos de múltiplas doses, disse o pneumologista. Tais inaladores de pó seco poderiam utilizar sensores digitais integrados para avaliar a inalação enquanto o paciente ainda a executa e ter em conta parâmetros como o PIF para fornecer um feedback adequado ao utilizador.
Finalmente, o Prof. Usmani também avisou os seus colegas: Os médicos muitas vezes não têm conhecimentos sobre inaladores porque não são ensinados nas universidades e colégios. Consequentemente, muitos não sabem qual é o dispositivo adequado para cada tipo de paciente. Dos mais de 6.000 pneumologistas e alergista, clínicos gerais, terapeutas respiratórios, enfermeiros e farmacêuticos inquiridos, apenas 12% conheciam as técnicas de aplicação correctas ou como escolher os dispositivos adequados. Para além do desenvolvimento técnico e da formação dos pacientes, a auto-reflexão dos médicos é também um factor de optimização da utilização dos inaladores.
Congresso: ERS Congress 2022
Literatura:
- Simpósio: O futuro da terapia inalatória na DPOC. Congresso Internacional da Sociedade Respiratória Europeia (ERS) 2022, Barcelona, 4.9.2022.
- Chrystyn H: Anatomia e fisiologia na entrega: podemos definir os nossos alvos? Alergia 1999; 54: 82-87; doi: 10.1111/j.1398-9995.1999.tb04393.x.
- Usmani OS, Biddiscombe MF, Barnes PF: Regional Lung Lung Deposition and Bronchodilator Response as a Function of β2-Agonist Particle Size. Am J Respir Crit Care Med 2005; 172: 1497-1504; doi: 10.1164/rccm.200410-1414OC.
- Relatório GOLD 2022, p. 58; https://goldcopd.org/2022-gold-reports-2; acedido pela última vez em 9.11.2022.
- Leving M, Wouters H, de la Hoz A, et al: Impact of PIF, inhalation technique and medication adherence on health status and exacerbations in COPD: protocol of a real-world observational study (PIFotal COPD Study). Pulm Ther 2021; 7(2): 591-606; doi: 10.1007/s41030-021-00172-7.
- Kocks JWH, Wouters H, Bosnic-Anticevich S, et al: Factores associados ao estado de saúde e exacerbações na terapia de manutenção de COPD com inaladores de pó seco. npj Prim Care Respir Med 2022; doi: 10.1038/s41533-022-00282-y.
InFo PNEUMOLOGY & ALLERGOLOGY 2022; 4(4): 22-24 (publicado 1.12.22, antes da impressão).











