O agente fitoterapêutico menthacarin tem sido utilizado durante décadas para tratar distúrbios gastrointestinais funcionais. O efeito baseia-se, entre outras coisas, numa inibição da hipersensibilidade visceral. De acordo com os conhecimentos actuais, a hipersensibilidade visceral é multifactorial, com os canais de iões TRP a desempenhar um papel central. Num estudo com animais, foi demonstrado que a regulação da transdução intracelular do sinal de cálcio pela menthacarin é, entre outras coisas, controlada pelo TRP-.canais iónicos.
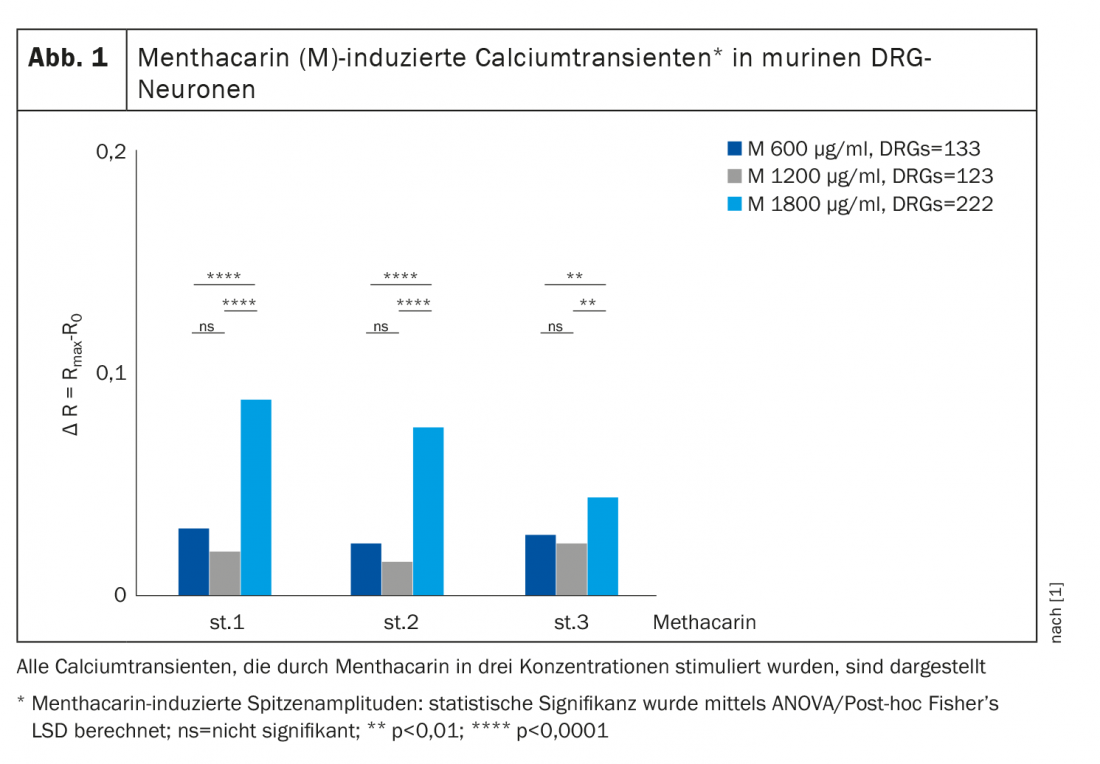
Os canais iónicos TRP (potencial receptor transitório) são altamente permeáveis a iões de cálcio divalentes e alvos para o tratamento da hipersensibilidade visceral [1]. A partir de alterações no equilíbrio do cálcio, podem ser tiradas conclusões sobre as complexas relações de nocicepção visceral como base para intervenções farmacoterapêuticas. Contra este pano de fundo, Zhang et al. 2021, o efeito da menthacarina no influxo de cálcio em neurónios ganglionares dorsais (neurónios DRG), macrófagos peritoneais e organóides do cólon foi investigado num modelo de rato [1]. Para este fim, superfundiram neurónios DRG lombossacrais recentemente isolados, macrófagos peritoneais e organóides do cólon cultivados durante 7 dias a partir de ratos do tipo selvagem (WT/C57BL/6) com mentoacarina em diferentes concentrações (600, 1200 e 1800 µg/ml). Os sinais de cálcio e o fluxo de cálcio intracelular foram medidos utilizando o método de imagem de cálcio.
|
Os investigadores foram capazes de demonstrar que a menthacarina em várias concentrações induz o influxo de iões de cálcio nos neurónios sensoriais do gânglio daraiz dorsal (DRG), macrófagos peritoneais e organóides do cólon [1]. (+)-Carvone, um componente essencial do óleo de cominho, actua como um agonista específico dos canais quimiossensoriais TRPA1 [2]. Os canais de iões TRP são altamente permeáveis aos iões de cálcio divalentes. |
|
Nocicepção visceral na FGID A dor visceral é uma característica comum das perturbações gastrointestinais funcionais (FGIDs). Os nociceptores no tracto gastrointestinal têm terminações nervosas em todas as camadas do tracto gastrointestinal (mucosa, submucosa, muscular); os seus corpos celulares estão localizados nos neurónios ganglionares espinhais (neurónios DRG) [9]. O sinal nociceptivo está ligado através da raiz posterior da medula espinal e vias ascendentes predominantemente no tracto espinotalâmico contralateral. Este sinal é conduzido através do sistema talamocortical até ao córtex do cérebro, onde a avaliação da percepção da dor tem lugar. A hiperalgesia visceral é característica dos pacientes com FGIDs. A combinação do ingrediente activo menthacarin (Carmenthin®), uma mistura de alta dose de hortelã-pimenta e óleo de alcaravia, foi comprovadamente capaz de neutralizar a hipersensibilidade visceral [6,10]. |
Desensibilização dos canais TRP como um importante mecanismo de acção
Verificou-se que a menthacarina induziu transientes intracelulares de cálcio nos neurónios DRG (gânglio de raiz dorsal) (Fig. 1), macrófagos peritoneais e organóides do cólon. Neste contexto, o (+)-carvone, o componente essencial do óleo de cominho, actua como um agonista específico dos canais quimiossensoriais TRPA1 [2]. Além disso, os organóides do cólon e, em menor grau, os neurónios DRG sensoriais mostraram uma resposta decrescente (taquifilaxia) de transitórios de cálcio com aplicações repetidas de menthacarin. Estudos anteriores em modelos de ratos mostram que a dessensibilização/taquifilaxia dos canais TRP é um tratamento potencial para a dor e inflamação [3,4]. Este mecanismo poderia também explicar os efeitos analgésicos da menthacarin no contexto clínico [5–8]. De notar que os estudos de banho de órgãos em tecido intestinal humano mostraram uma inibição independente dos nervos da contratilidade muscular lisa pela menthacarin, como evidenciado pelo relaxamento muscular sustentado e uma diminuição da contractilidade faseada. A diminuição da contractilidade foi mediada, pelo menos em parte, pela inibição dos canais de cálcio do tipo L [7].
Literatura:
- Zhang Z, et al: Life Sci 2021; 264: 118682.
- Kang Q, et al: Biophys Res Commun 2015; 459 (3): 498-503.
- Kistner K, et al: Sci Rep 2016; 6: 28621, https://doi.org/10.1038/srep28621.
- Khalil M, et al: Life Sci 2020; 257, 118112, https://doi.org/10.1016/j.lfs.2020.118112.
- Botschuijver S, et al: Motil 2018; 30 (6) , e13299, https://doi.org/10.1111/nmo.13299
- Adam B, et al: Scandinavian Journal of Gastroenterology 2006; 41: 155-160.
- Krueger D, et al: Motil 2020; 32 (2), e13748, https://doi.org/10.1111/nmo.13748.
- Jacquot L, et al: Rhinology 2005; 43 (2): 93-98.
- Moloney RD, et al: CNS Neurosci Ther 2016; 22(2): 102-117.
- Informação sobre drogas, www.swissmedicinfo.ch, (último acesso 05.07.2022)
PRÁTICA DO GP 2022; 17(7): 27