A metaplasia intestinal, um chamado epitélio Barrette, pode desenvolver-se a partir do epitélio escamoso esofágico normal devido a vários factores. Estes podem evoluir para displasia de baixo ou alto grau, que por sua vez podem estar associados a adenocarcinoma perigoso. O artigo seguinte discute o curso, os factores de risco e as possibilidades e necessidades de vigilância. A terapia das displasias de “alto grau” por meio de ressecção da mucosa ou ablação por radiofrequência apresenta resultados muito bons.
O esôfago de Barrett é definido (pelo menos nas nossas latitudes) como a presença de epitélio cilíndrico no esôfago distal com metaplasia intestinal especializada adicional (presença de células de taça, Fig. 1). Noutros países (por exemplo, Inglaterra, França ou Japão), a evidência histológica do epitélio do cilindro é suficiente para o diagnóstico do esófago de Barrett [1, 2].
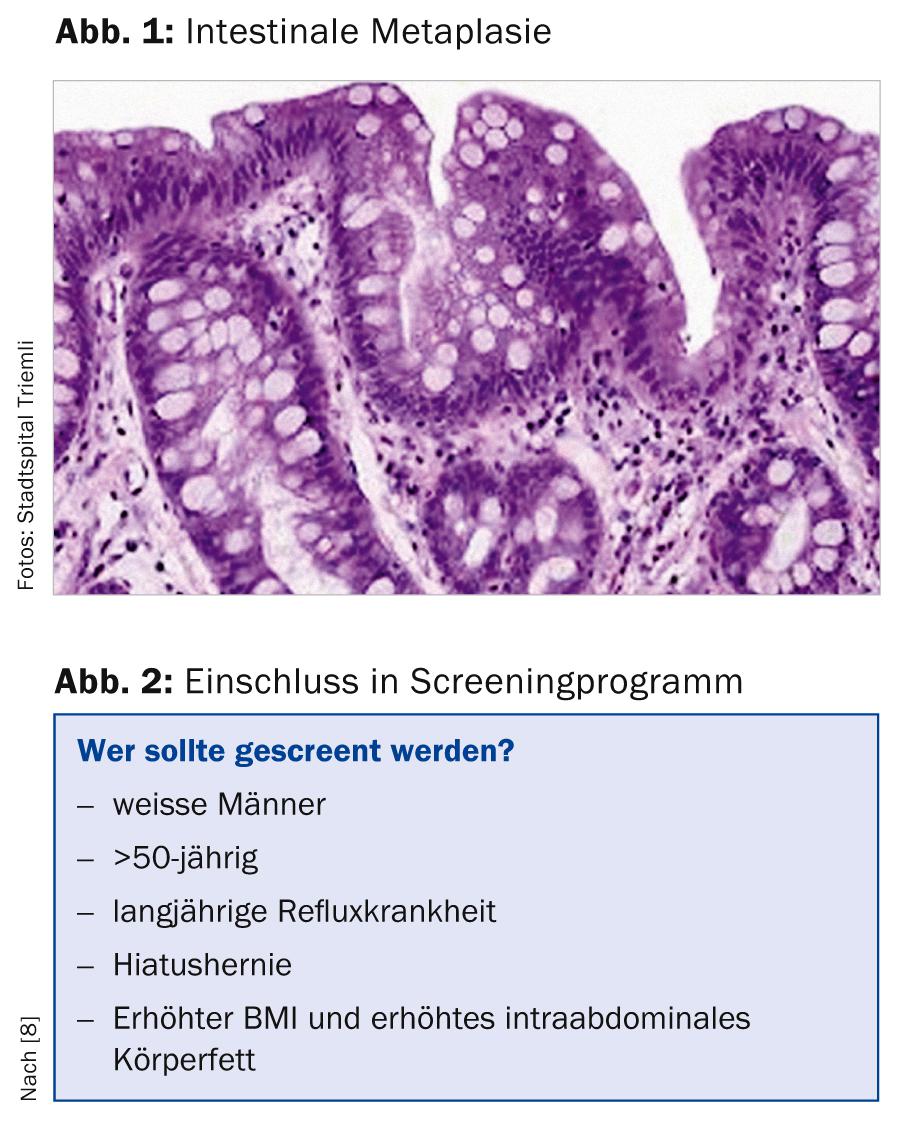
Distinguimos um segmento longo do esófago de Barrett (língua epitelial de pelo menos 3 cm de comprimento) de um segmento curto do esófago de Barrett (língua de Barrett mais curta do que 3 cm).
Curso
A metaplasia intestinal pode desenvolver-se a partir de epitélio escamoso esofágico normal devido a vários factores e encontra-se em aproximadamente 5-20% de todas as panendoscopias superiores. Displasia de “baixo grau” ou “alto grau” pode desenvolver-se a partir deste epitélio chamado Barrette, a partir do qual se pode desenvolver um adenocarcinoma. Apesar das melhores opções de tratamento (radiochemoterapia neoadjuvante), o adenocarcinoma do esófago – especialmente quando detectado tardiamente – ainda tem um prognóstico muito pobre, com uma sobrevivência de 5 anos ligeiramente inferior a 20% [3,4].
Factores de risco conhecidos para o desenvolvimento do esófago de Barrett
Conhecemos os seguintes factores de risco para o desenvolvimento de um epitélio de barrette [5, 6]:
- Idade
- Género masculino
- Reclamações de refluxo
- Descendência caucasiana
- Fumar
- Comprimento do esófago de Barrett
- Obesidade central
- Diabetes tipo 2.
Rastreio e vigilância: Geral
O risco anual de adenocarcinoma do esófago foi provavelmente significativamente sobrestimado em estudos mais antigos e está a um nível baixo entre 0,1 e 0,3% por ano em doentes com esófago de Barrett não displásico em estudos mais recentes (e maiores). De acordo com um estudo de coorte da Grã-Bretanha, pacientes com esófago de Barrett morrem em mais de 95% não de carcinoma de esófago, mas principalmente de doenças cardiovasculares, doenças pulmonares ou outras doenças tumorais [7]. Por esta razão, segundo a Associação Americana de Gastroenterologia (AGA), os pacientes com múltiplos factores de risco devem ser rastreados principalmente (Fig. 2) [8]. O argumento para o rastreio destes pacientes é que o esófago de Barrett é uma condição pré-cancerosa que se apresenta normalmente de forma assintomática. Além disso, como descrito acima, o adenocarcinoma do esófago tem um mau prognóstico, que pode ser melhorado através de uma terapia precoce.
O principal argumento contra o rastreio é o facto de a progressão natural do esófago de Barrett para o carcinoma ser pequena. Além disso, endoscopias e biópsias comportam certos (embora pequenos) riscos e custos.
A vigilância, tal como o rastreio, tem como objectivo reduzir a mortalidade do adenocarcinoma de esófago. A inclusão num programa de vigilância fala do facto de que a displasia “de alto grau” ou carcinoma precoce pode ser detectada o mais cedo possível e as intervenções precoces podem levar a uma redução dos custos de seguimento e da mortalidade. Além disso, a vigilância dá frequentemente tanto ao paciente como ao médico uma sensação de segurança.
Um argumento contra a inclusão num programa de vigilância é que a detecção endoscópica de displasia pode ser relativamente difícil e as biópsias aleatórias podem levar a “erros de amostragem”. Além disso, a interpretação histológica das biópsias realizadas também pode ser difícil e, como mencionado anteriormente, as endoscopias comportam riscos potenciais e geram custos.
Rastreio e vigilância: directrizes
Existem várias directrizes internacionais para a gestão de doentes com esófago de Barrett. A seguir, gostaríamos de discutir brevemente as directrizes da Associação Americana de Gastroenterologia (ACG), a que essencialmente aderimos no Stadtspital Triemli (Fig. 3) [9]:
Os doentes com esófago de Barrett sem displasia devem fazer uma segunda gastroscopia no prazo de um ano e um acompanhamento de três em três anos se a displasia permanecer sem ser detectada.
Se for detectada displasia de “baixo grau”, recomenda-se repetir a gastroscopia no prazo de seis meses e ter a displasia confirmada por um segundo patologista. Posteriormente, são recomendados controlos anuais até que a mucosa esteja livre de displasia duas vezes.
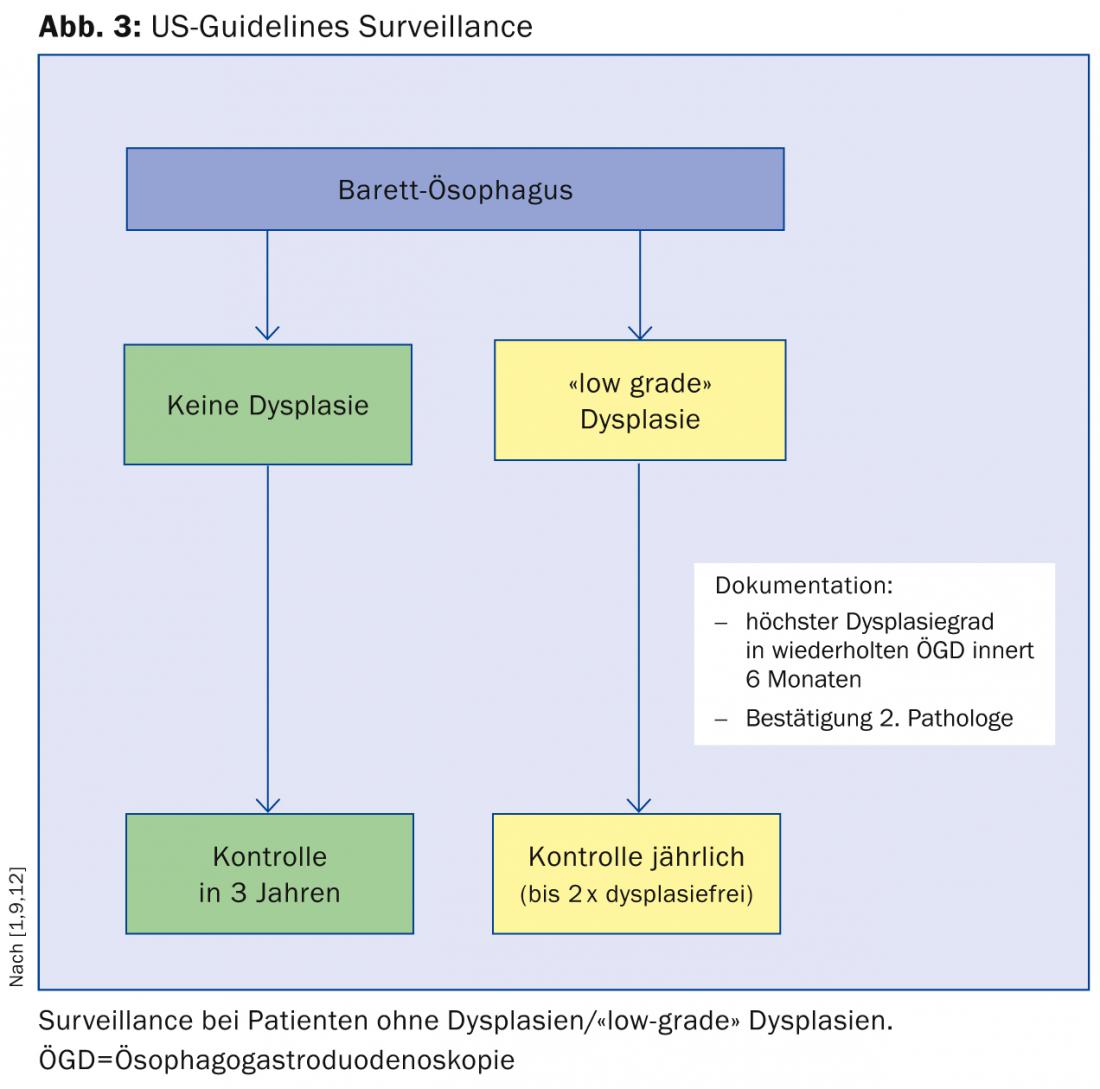
Se for detectada displasia de “alto grau”, é também necessária a confirmação por um segundo instituto patológico. O procedimento posterior depende então da idade do paciente, da perícia do respectivo centro e das co-morbilidades.
Terapias para o esófago de Barrett e adenocarcinoma
Terapia com inibidor de bomba de prótons: Recomenda-se a terapia com um inibidor de bomba de prótons (PPI, dose 20-40 mg/d) como terapia a longo prazo. Isto apesar do facto de não haver estudos controlados por placebo aleatorizados que provem que a terapia com PPI leva a uma regressão do epitélio metaplástico ou a uma redução do desenvolvimento de carcinoma [8].
Terapias para displasias de “alto grau”: As pequenas lesões macroscopicamente visíveis são tratadas endoscopicamente por mucosectomia ou ablação por radiofrequência (RFA). Os pacientes com grandes lesões devem ser discutidos interdisciplinarmente entre gastroenterologistas e cirurgiões. No entanto, de acordo com as recomendações de um grupo internacional multidisciplinar de peritos, a ressecção endoscópica é geralmente preferível à terapia cirúrgica, uma vez que está associada a uma maior taxa de complicações [10].
Durante a mucosectomia, áreas de mucosa maiores são aspiradas para uma tampa que é presa à ponta do endoscópio. As lesões podem então ser ressecadas com uma unidade de corte. Este método permite não só uma terapia de displasias de “alto grau” e carcinomas precoces, mas também uma encenação definitiva.
Ablação por radiofrequência – o segundo método amplamente utilizado para ablação do epitélio de Barrett – ablata a mucosa de Barrett através da utilização de energia de radiofrequência libertada por um balão.
O resultado a longo prazo destes métodos é muito bom.
Por exemplo, num estudo recente, três anos após a ablação por radiofrequência, 98% dos pacientes permaneceram livres de displasia e 91% dos pacientes ficaram sem evidência da mucosa de Barrett [11].
CONCLUSÃO PARA A PRÁTICA
- O epitélio barrette pode resultar em displasia de “baixo grau” ou “alto grau” e, no pior dos casos, em adenocarcinoma perigoso.
- Em doentes com esófago de Barrett sem displasia: uma segunda gastroscopia (dentro de um ano) e acompanhamento (de três em três anos) se a displasia permanecer sem ser detectada.
- displasias de “baixo grau”: repetir a gastroscopia no prazo de seis meses e confirmação por um segundo patologista. Posteriormente, verificações anuais até a mucosa estar livre de displasia duas vezes.
- displasia “de alto grau”: também confirmação por um segundo instituto patológico. O procedimento posterior depende da idade do paciente, da perícia do respectivo centro e das co-morbilidades.
- Recomenda-se a terapêutica com um PPI.
- A terapia das displasias de “alto grau” por meio de ressecção da mucosa ou ablação por radiofrequência apresenta resultados muito bons.
- Sampliner RE, et al: Am J Gastroenterol 2002; 97: 1888-1895.
- Messmann H, et al: Z Gastroenterol 2005; 43: 184-190.
- Shaheen N, et al: Gastroenterology 2005; 128: 1554-1566.
- Siegel R, et al: Cancer statistics, 2012. Cancer J Clin 2012; 62: 10.
- Prasag G, et. al: Clin Gastroenterol Hepatol 2013; 11: 1108.
- Wani, et al: Clin Gastroent e hepatol 2011; 9: 220-227.
- Masoud S: Gastroenterologia 2013: 144: 1375.
- Painel de Posição Médica do Instituto AGA: Gastroenterologia 2011.
- Wang KK: AM J Gastroenterol 2008; 103: 788-797.
- Bennett, et al: Gastroenterologia 2012; 143: 336.
- Shaheen NJ: Gastroenterol 2011; 141: 460-468.
- Sharma P: NEJM 2009; 361: 2548-2556.
PRÁTICA DO GP 2014; 9(1): 23-25











