O trabalho de equipa entre médico de família, nefrologista, centro de transplantes e paciente é essencial. 50% dos pacientes transplantados morrem com um transplante de rim funcional. Na fase inicial após o transplante, o foco está em ajustar a imunossupressão e registar a rejeição e as infecções em particular. O tratamento de complicações não-imunológicas, especialmente factores de risco cardiovascular, é extremamente importante. Devem ser efectuados controlos regulares dos tumores, especialmente da pele. Estar sempre atento às interacções medicamentosas, especialmente para os imunossupressores.
O transplante renal é o procedimento de substituição renal preferido pela maioria dos pacientes com insuficiência renal crónica e está associado à melhor qualidade de vida e esperança de vida para o paciente. A sobrevivência de 5 anos do transplante renal é actualmente superior a 70% para órgãos de dadores falecidos, e mesmo mais de 80% para donativos vivos [1].
Actualmente, cerca de 50% dos receptores de transplante com enxertos funcionais morrem devido a complicações cardiovasculares seguidas de tumores e infecções graves. Por conseguinte, o controlo e tratamento regulares das comorbilidades desempenham um papel crucial. O resultado a longo prazo de um transplante depende em grande parte da qualidade e da regularidade dos cuidados de acompanhamento. Aqui, a boa cooperação entre o médico de família e o centro de transplante é crucial.
Fase inicial após o transplante
A fase inicial de monitorização (primeiro ano pós-operatório) é predominantemente realizada directamente no centro de transplante, com intervalos de tempo para controlo que são prolongados até três meses após a fase inicial. Após o primeiro ano, o nefrologista próximo da casa do paciente assume a parte principal dos cuidados regulares em cooperação com o médico de família, complementada por check-ups anuais no centro de transplantes.
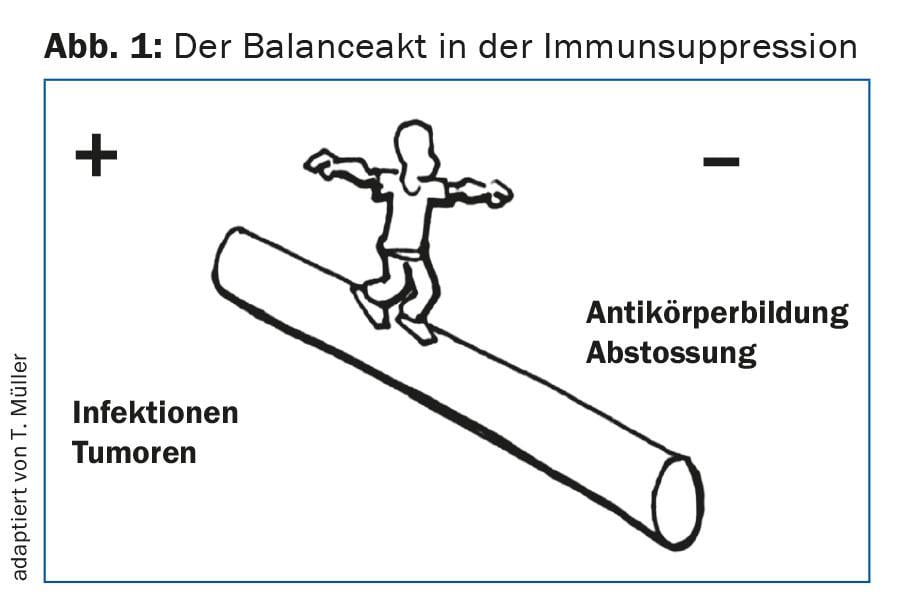
A monitorização inicial de malha fechada é necessária para a detecção precoce de complicações imunológicas agudas, tais como reacções de rejeição agudas. Para evitar isto, ou seja, para evitar a sub ou sobre imunossupressão, é necessário um ajuste muito individual de imunossupressão (Fig. 1) . Além disso, é importante reconhecer as infecções, especialmente as virais, na fase inicial. Estas incluem, em particular, a reactivação ou primoinfecções CMV, que podem ter consequências graves se não forem tratadas [2]. Além disso, é necessário um controlo rigoroso para uma possível replicação do BKV (poliomavírus), uma vez que uma viraemia BKV significativa pode levar a nefropatia BK e isto, se não for tratado, pode levar a uma rápida perda da função de enxerto.
Controlos no curso a longo prazo
A longo prazo, é dada maior importância ao registo de complicações não imunológicas, incluindo o controlo e ajustamento da pressão arterial, bem como possíveis perturbações lipometabólicas e do metabolismo ósseo.
Devido à melhor sobrevivência a longo prazo dos pacientes de transplante renal, somos agora confrontados com as consequências da terapia imunossupressora a longo prazo. Aqui, o risco acrescido de tumores malignos da pele deve ser mencionado acima de tudo. O cancro de pele não melanoma (NMSC) representa a maior proporção de todos os malignos pós-transplante a 40%. No caso do NMSC, 90-95% são carcinomas escamosos e basocelulares. O risco de um tal carcinoma é significativamente mais elevado em doentes imunodeprimidos do que na população em geral [3], o risco geral de tumores é aproximadamente. aumentou duas a três vezes [4]. Por este motivo, é crucial uma vigilância apertada da pele e pode ser necessária uma mudança na terapia imunossupressora se ocorrer um CCNM.
Um factor importante na fase final dos cuidados é o problema das alterações crónicas no enxerto, que quase sempre ocorrem por razões ainda pouco claras e que encurtam a vida funcional do enxerto. O curso da creatinina e da proteinúria é crucial no diagnóstico funcional. Um aumento de creatinina de mais de 15% requer esclarecimento. Para a excreção de proteínas, a determinação do quociente proteína-creatinina ou albumina-creatinina na urina espontânea é geralmente suficiente. Também aqui, o curso ao longo do tempo e o aumento da excreção de proteínas são decisivos. As mudanças significativas devem ser discutidas com o centro de transplante. Se necessário, deve então ser tomada uma decisão sobre exames adicionais, tais como o rastreio de anticorpos contra o transplante ou uma biópsia renal.
Na fase de longo prazo, é importante que em caso de doença, deterioração da função renal, febre, dor ou intolerância aos medicamentos, o contacto com o centro de transplante seja feito repetidamente, mesmo fora das marcações acordadas, pois nestas situações é frequentemente necessário um rápido esclarecimento, no contexto do qual o tratamento hospitalar pode também ser necessário.
As auto-medidas dos pacientes são também uma parte muito importante da monitorização padrão. Isto inclui medir a pressão arterial, pulso, temperatura e peso corporal, primeiro diariamente e depois de forma intermitente. Em particular, um aumento da temperatura corporal (geralmente um aumento de mais de 0,5°C acima da gama normal individual) e/ou um aumento de peso significativo de um dia para o outro de mais de 1 kg são sinais de alarme que os pacientes devem comunicar.
Drogas imunossupressoras
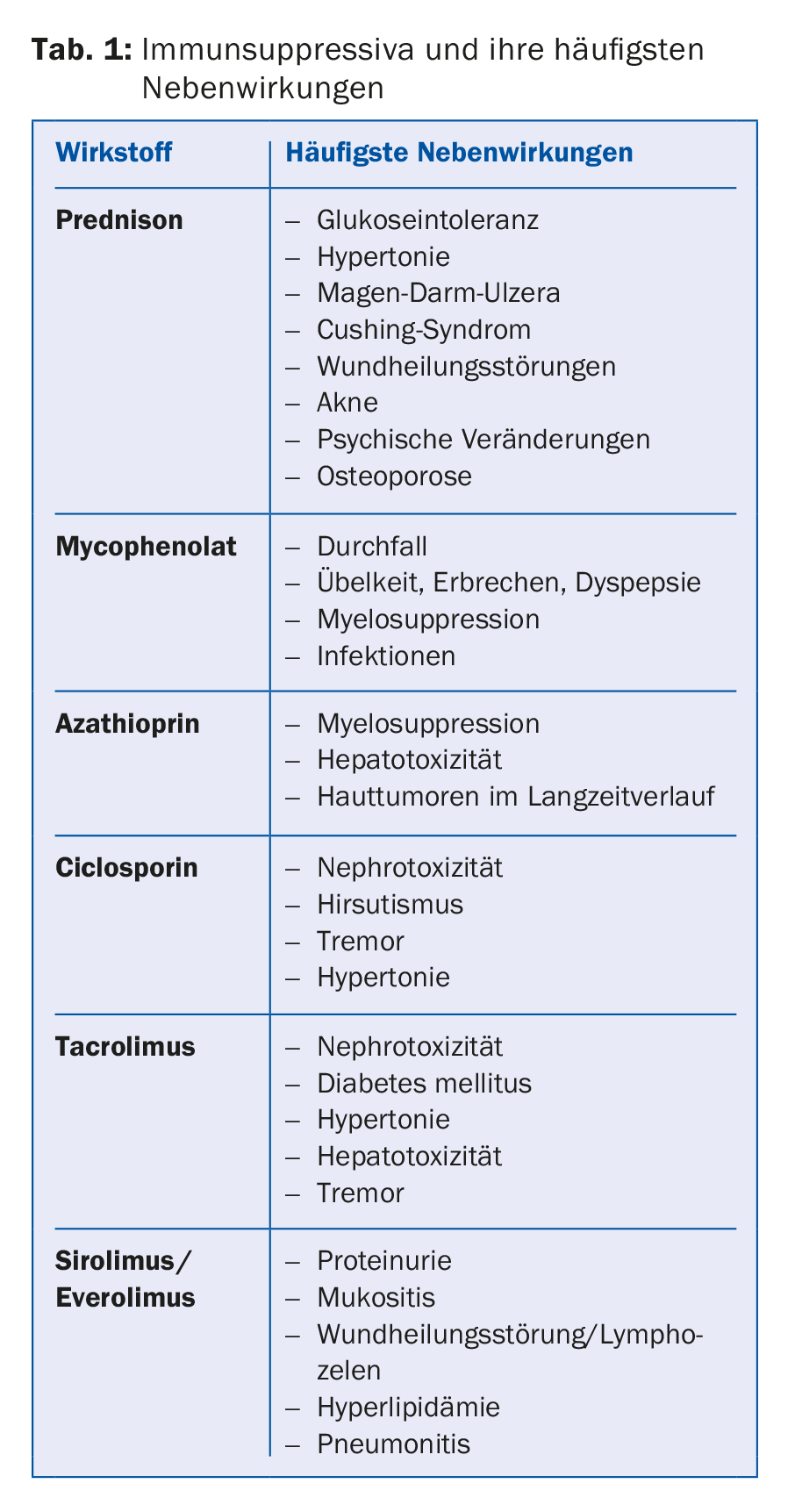
Com um transplante, o paciente não está curado, deve tomar medicação regular para toda a vida. As questões dos efeitos secundários e das interacções devem, portanto, ser sempre discutidas com o centro de transplante. O padrão é dupla terapia para pacientes com baixo risco imunológico ou tripla terapia para pacientes com maior risco. O tratamento imunossupressor consiste geralmente num inibidor de calcineurina, geralmente tacrolimus (Prograf® ou Advagraf®, sendo este último a forma de libertação prolongada do tacrolimus), em alguns casos alternativamente ciclosporina (Sandimmun Neoral®). Além disso, é utilizada uma substância antiproliferativa, na maioria dos casos micofenolato (CellCept® ou Myfortic®), mais raramente azatioprina (Imurek®). Na fase pós-operatória inicial, um glicocorticóide é normalmente adicionado como um terceiro imunossupressor, que é retirado após cerca de seis meses, dependendo do risco imunológico e das directrizes do centro (tab. 1).
O ajuste da dose, especialmente dos inibidores de calcineurina, é feito com base no chamado nível do vale, a determinação da concentração da substância activa no sangue doze horas após a ingestão da última dose. Os níveis-alvo individuais destinam-se, adaptados à clínica (situação imunológica, infecção ou complicações tumorais).
Para os imunossupressores, devem ser utilizados os preparados recomendados pelo centro de transplante. As alterações na terapia, dose ou mudança para medicamentos genéricos só devem ser feitas em consulta.
Os inibidores de calcineurina, como muitos outros medicamentos, são metabolizados através do CYP3A, pelo que se deve ter muita cautela ao prescrever novos medicamentos devido a potenciais interacções. Os antibióticos macrolídeos em particular (especialmente claritro- e eritromicina) podem levar a uma toxicidade severa dos inibidores da calcineurina ao inibirem o CYP3A. Mas os medicamentos ervanários também têm um elevado potencial de interacção. Por exemplo, uma redução significativa dos níveis de inibidores de calcineurina pode ocorrer com a erva de São João, e um forte aumento com sumo de toranja, com o risco de rejeição consecutiva ou superimunosupressão.
Outros medicamentos
Em procedimentos dentários e endoscopias com ou sem biópsias, a profilaxia antibiótica não é obrigatória simplesmente porque o paciente requer imunossupressão sistémica. A terapia antibiótica de acordo com o regime de profilaxia por endocardite é normalmente indicada apenas em doentes que receberiam profilaxia antibiótica mesmo sem imunossupressão e/ou se forem planeadas intervenções numa área infectada. Em caso de dúvida, a situação individual do paciente deve ser avaliada com o centro de transplante, dependendo do estado imunitário.
Na terapia analgésica, os AINE e os inibidores de COX II devem ser evitados a todo o custo devido a vários efeitos secundários renais possíveis (insuficiência renal aguda induzida por vasomotores, nefrite tubulointersticial, retenção de sal, etc.), como é geralmente o caso em todos os doentes com função renal prejudicada.
A função renal deve ser tida em conta ao dosear o medicamento. Num transplante muito funcional, a taxa de filtração glomerular (GFR) é normalmente superior a 60 ml/min e 1,73 m2 de superfície corporal. A dose deve ser ajustada para as diferentes gamas de GFR de acordo com as informações do produto.
Infecções do tracto urinário
As infecções mais comuns após o transplante renal são as infecções do tracto urinário. Em princípio, apenas as infecções sintomáticas do tracto urinário devem ser tratadas a longo prazo. Antes de iniciar a terapia empírica (geralmente com ciprofloxacina ou amoxicilina/ácido clavulânico), é imperativo tomar uma cultura de urina para tratamento subsequente em linha com a resistência.
No caso de infecções recorrentes do tracto urinário, a terapia empírica é seleccionada com base na resistência anterior aos antibióticos. Por outro lado, deve ser feito contacto com o centro de transplante a fim de esclarecer possíveis causas (por exemplo, refluxo na idade do transplante, etc.). Além disso, o consumo de arandos resp. O sumo de arando recomendado como medida profiláctica, em alguns casos o uso de L-metionina para acidificação urinária também pode ser discutido.
Hiperuricemia e gota
Devido à redução da depuração do ácido úrico renal, a hiperuricemia é uma complicação frequentemente observada da terapia com inibidores de calcineurina. Especialmente com ciclosporina, os ataques de gota têm sido descritos em 5-10% dos pacientes.
Para o tratamento de um ataque agudo de gota, a administração a curto prazo de esteróides durante três a cinco dias (aproximadamente. 20-50 mg/d) é recomendado. Os NSAID devem ser estritamente evitados. A profilaxia com alopurinol não deve ser administrada a doentes em terapia contínua com azatioprina porque esta combinação pode levar a neutropenia/agranulocitose grave.
Diarreia e queixas gastrointestinais
A diarreia e as queixas gastrointestinais são um problema comum em doentes imunocomprometidos. Se um doente se queixar de diarreia (>3 fezes líquidas/púricas) que durem mais de dois dias, deve procurar-se primeiro uma causa infecciosa (bacteriologia geral das fezes, norovírus). Em caso de persistência e/ou febre concorrente, o doente deve ser enviado para o centro de transplante (esclarecimento de infecção por CMV/Colite CMV, etc.). Se houver suspeita de diarreia induzida por drogas, que é frequentemente observada com micofenolato, especialmente quando desencadeada por infecções, a dose de imunossupressores pode ser ajustada. No caso de diarreia, o controlo precoce do nível de tacrolimus é também sempre indicado, uma vez que pode ocorrer uma maior absorção do tacrolimus e, portanto, níveis elevados.
Factores de risco cardiovascular
Os factores de risco cardiovascular devem ser tratados de forma consistente. A hipertensão arterial está presente em 60-80% dos doentes com transplante renal [6]. Em princípio, todas as classes de substâncias de anti-hipertensivos podem ser utilizadas; inicialmente, utiliza-se geralmente um antagonista do cálcio, com inibidores da ECA ou bloqueadores da ATII (Bloqueio RAAS) também utilizados se a função renal de transplante for estável. Se a proteinúria exceder 1 g/24 h, uma substância para o bloqueio RAAS é a primeira escolha. A pressão arterial alvo para a maioria dos pacientes transplantados é de 130/80 mmHg (em medições domésticas), em alguns casos os valores alvo têm de ser definidos individualmente.
A dislipidemia também deve ser tratada intensivamente com medidas de estilo de vida, especialmente de controlo de peso. No entanto, a terapia medicamentosa com uma estatina também é frequentemente necessária. O valor-alvo LDL é <2,6 mmol/l. As interacções com os imunossupressores também devem ser tidas em conta aqui.
Os fumadores devem ser sempre motivados a deixar de usar nicotina e devem ser-lhes oferecidos programas de cessação do tabagismo. Os doentes obesos podem beneficiar de aconselhamento nutricional. A profilaxia com ácido acetilsalicílico é recomendada para doenças cardiovasculares ateroscleróticas.
Diabetes mellitus
Diabetes mellitus só reaparece frequentemente após o transplante. Em particular, o tacrolimus, o sirolimus, a terapia com esteróides e a idade mais avançada são factores de risco para o chamado “Novo Inicio da Diabetes após Transplante” (NODAT). Para além das medidas habituais de estilo de vida e medicamentos antidiabéticos orais, tais como inibidores do DPP4 (sitagliptin), a insulina é muitas vezes considerada precocemente no tratamento do NODAT. Se a imunossupressão puder ser reduzida no decurso do tratamento, o metabolismo da glucose volta ao normal em alguns pacientes. O objectivo da terapia de acordo com as directrizes do KDIGO é um HbA1C <7-7,5%.
Desejo de ter filhos
Se desejar ter filhos, é essencial contactar o centro de transplante para discutir abertamente os riscos e perigos. Uma mudança na medicação é também geralmente obrigatória antes de uma possível gravidez. Uma gravidez numa mulher após um transplante renal é basicamente uma gravidez de alto risco e requer cuidados interdisciplinares de malha apertada no centro de transplante.
Vacinas e viagens
Como regra, as vacinas completas – de acordo com a Recomendação de Vacinação Suíça para Pessoas antes e depois do Transplante de Órgãos Sólidos – já deveriam ter sido realizadas antes do transplante no momento da listagem. Após o transplante, as vacinas vivas como as contra a rubéola ou o sarampo são contra-indicadas devido à imunossupressão. Todas as vacinas não vivas devem ser regularmente actualizadas de acordo com as recomendações de vacinação. Também é recomendada a vacinação anual contra a gripe. No entanto, deve ser lembrado que a resposta de vacinação é frequentemente um pouco atenuada sob terapia imunossupressora.
Quando se viaja para países com um risco acrescido de infecções gastrointestinais, recomenda-se a consulta prévia, por exemplo, num centro de medicina de viagem. Podem ser obtidas aqui informações sobre a situação da resistência. Nesta base, é determinada a terapia empírica recomendada a ser tomada em caso de emergência.
Conclusão
Em resumo, o sucesso de um transplante, especialmente no que diz respeito à sobrevivência do transplante e à qualidade de vida do paciente, depende decisivamente da estreita cooperação entre o médico de família, o nefrologista, o centro de transplantes e o paciente.
Literatura:
- Matas AJ, et al: OPTN/SRTR 2012 Relatório Anual de Dados: Rim.
- Kumar D, et al: The AST Handbook of Transplant Infections, Wiley-Blackwell, 2011.
- Zwald FO, et al: Cancro da pele em receptores de transplantes de órgãos sólidos: avanços na terapia e gestão parte I: Epidemiologia do cancro da pele em receptores de transplantes de órgãos sólidos. J Am Acad Dermatol 2011; 65(2): 253-261.
- Engels E, et al: Spectrum of Cancer Risk Among US Solid Organ Transplant Recipients. JAMA 2011; 306(17): 1891-1901.
- Kasiske B, et al: KDIGO clinical practice guideline for the care of kidney transplant recipients: a summary. Kidney Int 2010; 77: 299-311.
- Danovitch G: Handbook of Kidney Transplantation, Wolters Kluver, 2010.
PRÁTICA DO GP 2015; 10(12): 20-24