A cirurgia é a forma mais importante de tratamento para o meningioma, seguida de radioterapia. Este último é utilizado para tumores de grau superior, aqueles com restos não removíveis ou para certos meningiomas na base do crânio.
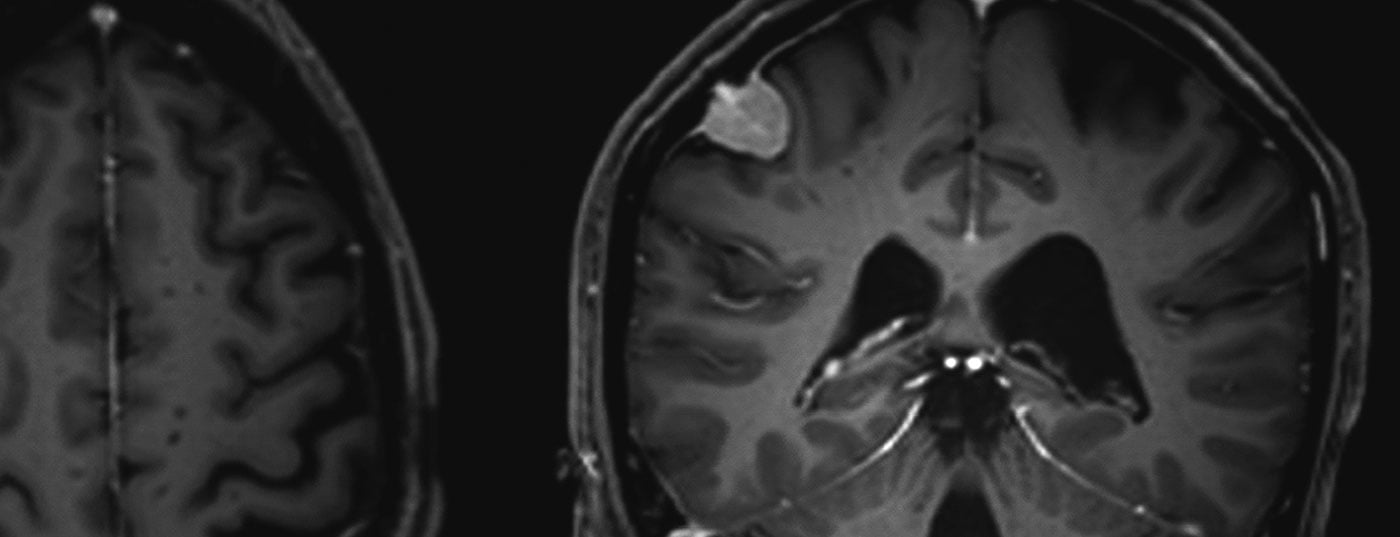
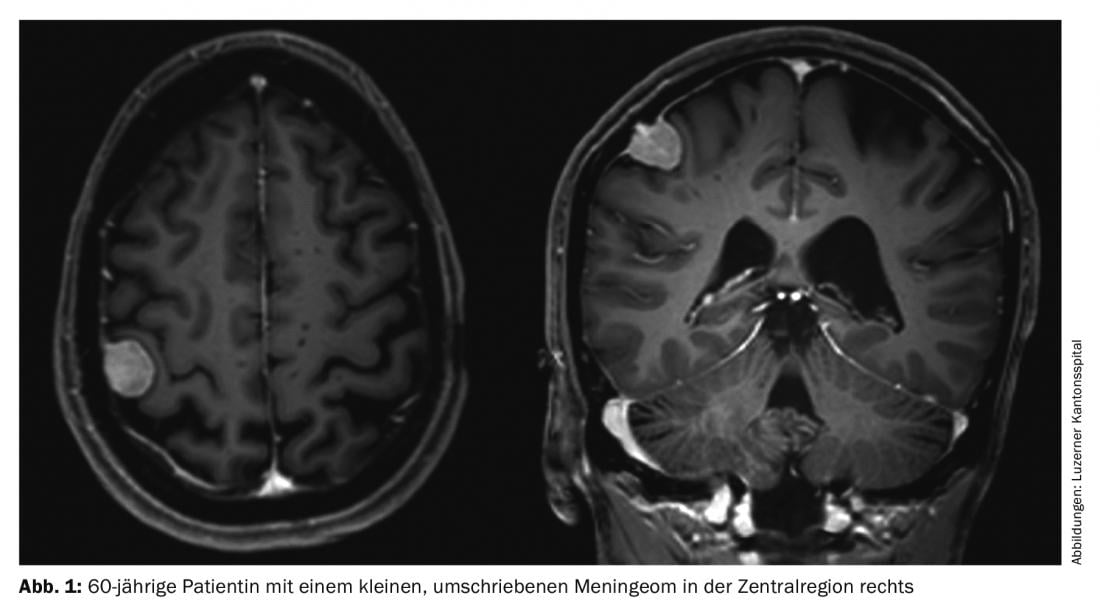
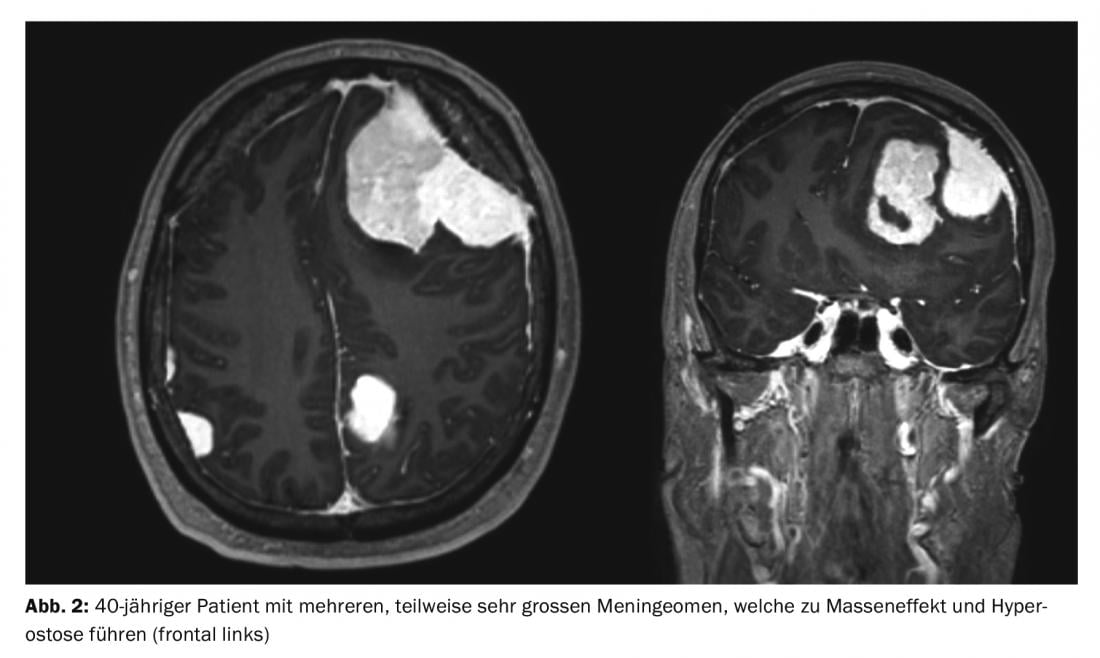
Os meningiomas são responsáveis por cerca de um terço de todos os tumores primários do sistema nervoso central. É relatada uma incidência de 7,61/100.000 habitantes dos EUA nos anos de 2008 a 2012 [1]. Estes são predominantemente tumores benignos e de crescimento lento. Estes podem afectar todo o eixo neural. Surgem das células meningotélicas aracnoides e são, portanto, na sua maioria intracranianas-extra-axiais (cranianas) ou intradurais-extramedulares (espinhais). Os tumores múltiplos estão presentes em 8% dos casos (Fig. 1 e 2) [2], especialmente em síndromes genéticas como a neurofibromatose. A localização da coluna vertebral é encontrada em cerca de 10% dos casos. Os meningiomas intracranianos estão mais frequentemente localizados ao longo do falx cerebri, da asa esfenoidal ou sobre a convexidade [3].
Histologia e Classificação da OMS 2016
Os meningiomas são classificados de acordo com a classificação da OMS de tumores cerebrais em graus I (benigno), II (atípico) e III (meningiomas anaplásicos, que podem metástasear sistemicamente e ter altas taxas de recorrência após a ressecção) [4].
O diagnóstico de um meningioma é geralmente feito histologicamente em secções coradas com hematoxilina e eosina com base em critérios típicos, tais como a formação de whorl, pseudo-inclusões nucleares ou provas de corpos de psammoma (calcificações em camadas concêntricas) [4,5]. O diagnóstico histológico pode ser confirmado com imuno-histoquímica, por exemplo, para os marcadores antigénio de membrana epitelial (EMA) ou receptor de somatostatina 2a.
Desde a nova classificação da OMS de 2016, a invasão do tecido cerebral, que não é rara em si mesma, é agora avaliada como critério para o grau II da OMS (meningioma atípico), mesmo que não estejam presentes outros critérios atípicos [4]. Isto baseia-se nas taxas comparáveis de recorrência e mortalidade de meningiomas com invasão parenquimatosa cerebral e aqueles que contêm sinais histológicos de atipia [6]. Além disso, estes critérios atípicos aplicam-se (pelo menos três dos cinco critérios histológicos seguintes foram cumpridos):
- Necrose
- Folha (perda da formação do vórtice ou do
- histoarquitectura fascicular)
- Núcleos proeminentes
- Alta celularidade
- Células pequenas [4,6].
Os meningiomas anaplásicos de grau III da OMS, aproximadamente 2% de todos os meningiomas, mostram mitoses frequentes (>20 mitoses em dez campos visuais) e invasão do tecido cerebral, recaem frequentemente cedo mesmo após ressecção total e podem muito raramente metástase fora do sistema nervoso central [7].
Marcadores moleculares
O diagnóstico molecular está também a desempenhar um papel cada vez mais importante nos meningiomas. Por exemplo, existem provas preliminares de que as mutações da transcriptase reversa da telomerase (TERT) levam a um crescimento mais agressivo dos tumores nos meningiomas, independentemente do grau individual da OMS [8,9].
A maioria dos meningiomas tem apenas uma cópia do longo braço do cromossoma 22 (22q) [10]. A neurofibromina 2, um gene localizado no 22q, também sofre frequentemente mutações adicionais; este é também o caso da neurofibromatose 2, que se caracteriza por meningiomas múltiplos, entre outras coisas [11]. Certas aberrações cromossómicas, como a perda do braço curto do cromossoma 1 (1p), o braço longo do cromossoma 10 (10q) ou 14 (14q), estão associadas a um risco acrescido de malignidade e recidiva [12,13]. Está a ser realizada uma investigação intensiva com o objectivo de integrar os marcadores moleculares na classificação da OMS, à semelhança de outros tumores cerebrais, permitindo assim diagnósticos mais direccionados e possivelmente também uma terapia mais individualizada no sentido das chamadas “terapias direccionadas” no futuro.
Clínica
A clínica depende da localização e do tamanho dos meningiomas. Os meningiomas supratentoriais podem apresentar défices neurológicos de qualquer tipo ou convulsões epilépticas. Os pacientes com epilepsia sintomática são ajustados com medicação antiepiléptica, que pode então ser interrompida após a remoção completa dos meningiomas no decurso de algumas semanas de pós-operatório após a normalização da electroencefalografia. Os meningiomas espinais causam tipicamente dores nocturnas, que são geralmente difusas mas também podem ser radiculares cingidos ao nível do tumor. Uma paraparesia insidiosa e lentamente progressiva, manifestando-se inicialmente simplesmente como uma perturbação da marcha, não é raramente reconhecida tardiamente porque envolve normalmente doentes mais velhos onde outras formas de perturbações da marcha são comuns. Como a clínica é geralmente causada por compressão local em vez de invasão pelo próprio tumor, o prognóstico de recuperação de défices neurológicos é favorável se a cirurgia for realizada prontamente.
Devido ao uso crescente da RM na prática clínica, os meningiomas estão a ser descobertos cada vez mais frequentemente por acaso (em até 1% de todas as RMIs).
Imagiologia
Normalmente, a ressonância magnética com contraste é utilizada para o diagnóstico e acompanhamento de meningiomas; em casos de contra-indicações, a tomografia computorizada com contraste é utilizada como alternativa [14,15].
A ressonância magnética de perfusão pode ser utilizada para diferenciar os meningiomas de outras entidades, uma vez que os meningiomas têm normalmente um aumento do volume relativo de sangue cerebral (rCBV) e outras lesões (por exemplo, metástases duras) não [16]. Usando ligandos peptídeos como 90Y-dotatoc ou 68Ga-dotatate como traçadores para tomografia por emissão de pósitrons (PET), a expressão somatostatina receptor 2 pode ser usada para diferenciar meningiomas de tecido saudável [17,18]. Na espectroscopia de ressonância magnética, os meningiomas mostram um pico alanino característico entre 1,3 e 1,5 ppm (“partes por milhão”) [19].
Gestão e terapia
Actualmente, os meningiomas são frequentemente descobertos por acaso: uma ressonância magnética para esclarecer dores de cabeça raramente revela uma causa de dor, mas não raro um achado acidental. Há poucas e relativamente fracas provas na literatura sobre o tratamento posterior destas lesões assintomáticas com acompanhamento clínico e imagiológico a intervalos de seis meses e depois anuais [14,20–22]. Se a terapia se tornar necessária devido a sintomas clínicos ou crescimento documentado por imagem, a ressecção microneurocirúrgica é praticamente sempre a primeira terapia de escolha [14]. O objectivo da cirurgia deve ser – sempre que possível – uma ressecção completa do tumor incluindo a dura-máter e o osso afectado. A extensão da ressecção dos meningiomas e, consequentemente, o seu risco de recorrência é ainda classificada de acordo com a classificação Simpson de 1957 [23] (Tab. 1) [22,24].
A embolização pré-operatória dos meningiomas pode simplificar a cirurgia em casos individuais, por exemplo, se o fornecimento de sangue ao tumor não puder ser bem controlado por meios cirúrgicos ou, por razões anatómicas, apenas no final da ressecção. OMS grau III, ou seja, os meningiomas anaplásicos devem ser operados o mais radicalmente possível, a fim de reduzir o mais possível o risco de recorrência e metástase [14].
A radiocirurgia (radiação estereotáxica convergente de dose única) pode ser utilizada para pequenos tumores, para os que não podem ser operados ou só podem ser operados de forma incompleta, para a localização na área do seio cavernoso ou na ponta do osso temporal, ou para pacientes idosos e com elevada comorbidade. Em certos casos, por exemplo, no caso de tumores maiores na área do ápice do petroso ou do seio cavernoso, a dose de radiação também pode ser aplicada como radioterapia fraccionada dividida em várias doses. Nos meningiomas de grau II da OMS, o ensaio ROAM/EORTC 1308 (ISRCTN71502099) está actualmente a recrutar pacientes com ressecções tumorais de grau I-III de Simpson para serem aleatoriamente atribuídos à radioterapia pós-operatória precoce ou placebo para investigar se a radioterapia pode reduzir o risco de recorrência de tumores ou prolongar o período sem recorrências [25]. A radioterapia fraccionada adjuvante é actualmente recomendada para meningiomas de grau II da OMS ressecados incompletamente ou para tumores de grau II da OMS com progressão [26–28], embora estudos individuais tenham mostrado resultados pouco claros ou nenhum benefício convincente [29–32]. Do mesmo modo, a radioterapia fraccionada é recomendada no pós-operatório para meningiomas de grau III da OMS, independentemente da extensão da ressecção [14].
A farmacoterapia desempenha um papel completamente subordinado no tratamento dos meningiomas. Isto poderá mudar no futuro através da descoberta de potenciais alvos de “terapias orientadas”.
Operação
Um meningioma é removido utilizando uma técnica microcirúrgica. Se a localização estiver próxima de estruturas eloquentes tais como o tronco cerebral ou a medula espinal, a cirurgia é realizada com monitorização neurofisiológica intra-operatória, especialmente os potenciais evocados motores.
Para tumores intracranianos, a tecnologia de neuronavegação é utilizada para o planeamento cirúrgico, a fim de alcançar uma abordagem tão centrada quanto possível no tumor. Esta deve ser tão pequena e suave quanto possível, mas ainda suficientemente grande para poder ver suficientemente as bordas do tumor. A localização da altura da coluna vertebral é simplesmente feita com raios X ou fluoroscopia. Após a laminotomia ou hemilaminectomia e antes da abertura da dura-máter, a exposição correcta é verificada com ultra-sons. Para acesso, as laminas dos corpos vertebrais afectados são reinseridas e refixadas com mini placas de titânio (laminotomia/laminoplastia). Abordagens minimamente invasivas como as hemilaminectomias, que requerem apenas uma exposição unilateral e permitem uma cura mais rápida e menos dolorosa, estão a ser usadas cada vez mais frequentemente.
Após a realização da craniotomia, os meningiomas são removidos tão completamente quanto possível, de preferência numa só peça e com o seu ponto de fixação à dura-máter. O osso afectado também é removido, se tecnicamente possível. A dura-máter é reconstruída com materiais próprios (periósteo do crânio) ou estranhos (manchas de substituição de dura-máter feitas de materiais sintéticos ou xenogénicos) do paciente. Esta ressecção com remoção completa do tumor, incluindo a excisão da fixação dural e a excisão do osso afectado é classificada de acordo com Simpson grau I (tab. 1) . Nos casos em que isto não é tecnicamente possível, por exemplo, perto da base do crânio, é realizada uma ressecção menos destrutiva (grau Simpson II-III). As biópsias (Simpson V) para meningiomas são uma excepção extremamente rara.

No pós-operatório, os pacientes são monitorizados na unidade de cuidados intensivos durante uma noite como padrão. No primeiro dia pós-operatório, uma RM é também tomada como padrão para documentar tumores residuais e quaisquer complicações (isquemia, hemorragia, hidrocefalia). Um tumor residual inesperado, que poderia levar a uma reoperação precoce, quase nunca ocorre em operações de meningioma. A duração média da estadia no hospital é de quatro a cinco dias em casos não complicados e a convalescença é de cerca de seis semanas.
Pós-tratamento
O acompanhamento pós-operatório é efectuado por meio de exames de RM em série. Para os meningiomas de grau I da OMS, recomenda-se um intervalo anual para os primeiros cinco anos e um intervalo de acompanhamento clínico e imagiológico bienal a seguir [14]. Para meningiomas de grau II da OMS, recomenda-se um intervalo de controlo mais curto de seis meses [33], e para meningiomas de grau III da OMS, recomenda-se mesmo um intervalo de controlo de três a seis meses [14].
Previsão
A taxa de sobrevivência de 5 anos de todos os meningiomas combinados é de cerca de 90% e depende principalmente da taxa de recorrência (OMS grau I: 10%/OMS grau II: 30%/OMS grau III: 50%) [34].
A extensão da ressecção de tumores segundo a classificação Simpson (Tab. 1) estáligada ao prognóstico, especialmente para meningiomas de convexidade, a classificação parece ser menos relevante para os meningiomas falx ou meningiomas da base do crânio [35]. Parece existir uma correlação global mais com a sobrevivência sem recorrência e menos com a sobrevivência global [36].
Mensagens Take-Home
- Até novo aviso, a terapia cirúrgica é a primeira e mais importante forma de terapia, seguida de radioterapia.
- A radioterapia é utilizada para tumores de grau superior, aqueles com restos não removíveis ou para certos meningiomas na base do crânio.
- Os meningiomas com invasão cerebral são classificados como tumores de grau II de acordo com a nova classificação da OMS 2016.
Literatura:
- Ostrom QT, et al: CBTRUS Statistical Report: Primary Brain and Central Nervous System Tumors Diagnosed in the United States in 2008-2012. Neuro Oncol 2015; 17(Suppl 4): iv1-iv62.
- Sheehy JP, Crockard HA: meningiomas múltiplos: uma revisão a longo prazo. J Neurocirurgia 1983; 59(1): 1-5.
- Yamashita J, et al: Recorrência de meningiomas intracranianos, com especial referência à radioterapia. Surg Neurol 1980; 14(1): 33-40.
- Louis DN, et al: The 2016 World Health Organization Classification of Tumours of the Central Nervous System: a summary. Acta Neuropathol 2016; 131(6): 803-820.
- Nowosielski M, et al: Desafios diagnósticos no Meningioma. Neuro Oncol 2017. DOI: 10.1093/neuonc/nox101 [Epub ahead of print].
- Perry A, et al: Meningioma grading: uma análise dos parâmetros histológicos. Am J Surg Pathol 1997; 21(12): 1455-1465.
- Thomas HG, Dolman CL, Berry K: Meningioma maligno: características clínicas e patológicas. J Neurocirurgia 1981; 55(6): 929-934.
- Sahm F, et al: AKT1E17K aglomerações de mutações com meningotelial e meningiomas de transição e podem ser detectadas pela SFRP1 imunohistochemistry. Acta Neuropathol 2013; 126(5): 757-762.
- Goutagny S, et al.: Alta incidência de activação de mutações promotoras de TERT em meningiomas em progressão maligna. Brain Pathol 2014; 24(2): 184-189.
- Dumanski JP, et al: Deletion mapping of a locus on human chromosome 22 involved in the oncogenesis of meningioma. Proc Natl Acad Sci U S A 1987; 84(24): 9275-9279.
- Rouleau GA, et al: Alteração num novo gene que codifica uma suposta proteína organizadora da membrana causa neurofibromatose tipo 2. Nature 1993; 363(6429): 515-521.
- Tabernero MD, et al: Characterization of chromosome 14 abnormalities by interphase in situ hybridization and comparative genomic hybridization in 124 meningiomas: correlation with clinical, histopathologic, and prognostic features. Am J Clin Pathol 2005; 123(5): 744-751.
- Maillo A, et al.: As recidivas precoces nos meningiomas histologicamente benignos/ grau I estão associadas a grandes tumores e à coexistência da monossomia 14 e del(1p36) no clone das células tumorais ancestrais. Neuro Oncol 2007; 9(4): 438-446.
- Goldbrunner R, et al: Directrizes EANO para o diagnóstico e tratamento dos meningiomas. Lancet Oncol 2016; 17(9): e383-391.
- Saloner D, et al: Técnicas modernas de imagiologia do meningioma. J Neurooncol 2010; 99(3): 333-340.
- Kremer S, et al: Contribuição da imagem dinâmica de contraste MR para a diferenciação entre metástase dural e meningioma. Neuroradiologia 2004; 46(8): 642-648.
- Collamati F, et al: Rumo à cirurgia radioguiada com o β-decisos: captação de um análogo de somatostatina, DOTATOC, em meningioma e glioma de alta qualidade. J Nucl Med 2015; 56(1): 3-8.
- Rachinger W, et al: O aumento da captação de 68Ga-DOTATO na imagem PET discrimina o meningioma e o tecido livre de tumores. J Nucl Med 2015; 56(3): 347-353.
- Majós C, et al: Meningiomas intraventriculares: imagens de MR e descobertas espectroscópicas de MR em dois casos. AJNR Am J Neuroradiol 1999; 20(5): 882-885.
- Vernooij MW, et al: Descobertas acidentais sobre a RM do cérebro na população em geral. N Engl J Med 2007; 357(18): 1821-1828.
- Sughrue ME, et al: Tomada de decisões de tratamento com base na história natural publicada e na taxa de crescimento de pequenos meningiomas. J Neurocirurgia 2010; 113(5): 1036-1042.
- Sughrue ME, et al: The relevance of Simpson Grade I and II resection in modern neurosurgical treatment of World Health Organization Grade I meningiomas. J Neurocirurgia 2010; 113(5): 1029-1035.
- Simpson D: A recorrência de meningiomas intracranianos após tratamento cirúrgico. J Neurol Neurosurg Psychiatry 1957; 20(1): 22-39.
- Gousias K, Schramm J, Simon M: A classificação Simpson revisitada: cirurgia agressiva e o seu lugar na gestão moderna do meningioma. J Neurocirurgia 2016; 125(3): 551-560.
- Jenkinson MD, et al: The ROAM/EORTC-1308 trial: Radiação versus Observação após ressecção cirúrgica do Meningioma Atípico: protocolo de estudo para um ensaio controlado aleatório. Ensaios de 2015; 16: 519.
- Aghi MK, et al: Taxas de recidiva a longo prazo de meningiomas atípicos após ressecção total bruta com ou sem radiação adjuvante pós-operatória. Neurocirurgia 2009; 64(1): 56-60; discussão 60.
- Komotar RJ, et al: O papel da radioterapia após a ressecção grosseira total dos meningiomas atípicos. J Neurocirurgia 2012; 117(4): 679-686.
- Park HJ, et al: O papel da radioterapia adjuvante no meningioma atípico. J Neurooncol 2013; 115(2): 241-247.
- Hammouche S, et al.: Análise de sobrevivência a longo prazo de meningiomas atípicos: taxas de sobrevivência, factores prognósticos, tratamento operatório e radioterápico. Acta Neurochir (Viena) 2014; 156(8): 1475-1481.
- Mair R, et al: Radioterapia para meningiomas atípicos. J Neurocirurgia 2011; 115(4): 811-819.
- Stessin AM, et al.: A radioterapia de feixe externo adjuvante melhora os resultados dos meningiomas não-benignos? Uma análise baseada na vigilância, Epidemiologia e Resultados Finais (SEER). J Neurocirurgia 2012; 117(4): 669-675.
- Yoon H, et al.: Meningioma atípico: são necessários ensaios aleatórios para resolver resultados retrospectivos contraditórios no que diz respeito ao papel da radioterapia adjuvante. J Cancer Res Ther 2015; 11(1): 59-66.
- Marosi C, et al: Meningioma. Critério Rev Oncol Hematol 2008; 67(2): 153-171.
- Mahaley MS, et al: Estudo nacional dos padrões de cuidados de saúde para doentes com tumor cerebral. J Neurocirurgia 1989; 71(6): 826-836.
- Voss KM, et al: A classificação Simpson na cirurgia do meningioma: a localização do tumor influencia o valor prognóstico? J Neurooncol 2017; 133(3): 641-651.
- Nanda A, et al: Relevância do sistema de classificação Simpson e sobrevivência sem recorrência após cirurgia para o meningioma de grau I da Organização Mundial de Saúde. J Neurocirurgia 2017; 126(1): 201-211.
InFo ONCOLOGy & HaEMATOLOGy 2017; 5(6): 11-15