No tratamento da diabetes mellitus tipo 2, os últimos anos trouxeram algumas inovações em termos de diagnóstico, objectivos terapêuticos e escolha de medicamentos antidiabéticos. “Uma abordagem centrada no doente” são as palavras-chave do documento de posição conjunta das sociedades americana e europeia de diabetes, no qual é proposta uma individualização mais forte dos objectivos terapêuticos no que diz respeito ao controlo da glicemia e aos factores de risco cardiovascular [1]. A duração da diabetes, idade do paciente, risco de hipoglicémia, comorbilidades e conformidade devem ser tidos em conta na determinação dos objectivos da terapia. A implementação de modificações no estilo de vida é ainda a medida mais importante no tratamento da diabetes mellitus. Os medicamentos antidiabéticos disponíveis permitem uma terapia adaptada às necessidades e comorbilidades do paciente. No entanto, o número crescente de medicamentos antidiabéticos também requer formação e experiência constantes para os médicos que os tratam. Este artigo visa fornecer uma visão geral dos objectivos e opções de tratamento para pacientes com diabetes tipo 2.
O HbA1c foi recentemente introduzido como critério de diagnóstico para a diabetes em 2009. É menos sensível do que o jejum da glicemia, mas é um instrumento prático devido ao seu tempo de teste independente do dia. Os critérios de diagnóstico da diabetes mellitus pré e manifesta estão listados no Quadro 1. O rastreio é sugerido em todos os doentes com mais de 45 anos de idade e em indivíduos com excesso de peso com IMC ≥25 kg/m2 com um factor de risco adicional para a diabetes mellitus [1].

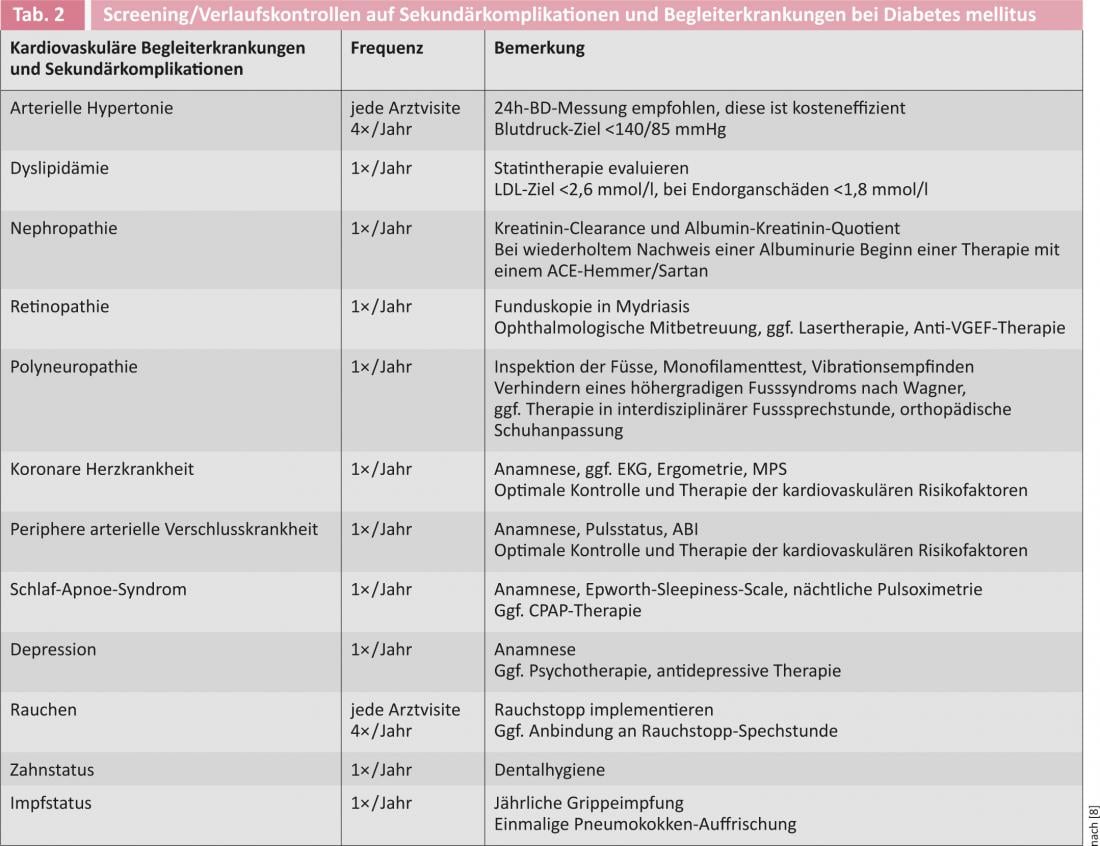
Uma vez que uma desordem de tolerância à glicose existia geralmente durante anos quando a diabetes mellitus foi diagnosticada pela primeira vez, recomenda-se o rastreio de complicações secundárias associadas à diabetes e comorbilidades cardiovasculares na altura do diagnóstico (Tab. 2) . O rastreio deve ser repetido a intervalos anuais.
Objectivos terapêuticos
Grandes ensaios clínicos como o Prospective Diabetes Study (UKPDS) ou o estudo Steno-2 mostraram que o controlo glicémico óptimo, juntamente com o tratamento dos outros factores de risco cardiovascular, leva a uma redução significativa das complicações micro e macrovasculares [2–6]. Os dados de seguimento de 10 anos do UKPDS ensinaram-nos que o controlo glicémico rigoroso após o diagnóstico inicial da diabetes continua a reduzir as complicações tardias e a mortalidade uma década após o fim do estudo (“memória metabólica”) [5]. Três grandes ensaios com objectivos de tratamento muito mais agressivos (HbA1c <6% vs. 7-7,9% [7]) do que, por exemplo, no UKPDS (7% vs. 7,9% [2]) mostraram um aumento da mortalidade, pelo que um objectivo “individualizado” é agora favorecido [1, 2, 7, 8]. A duração da diabetes, idade do paciente, comorbilidades e conformidade devem ser tidas mais em conta. Para a maioria dos pacientes (ou seja, pacientes com uma longa esperança de vida, curta duração da diabetes, sem comorbilidades graves e boa adesão à terapia), um HbA1c de <7% é ainda considerado o objectivo do tratamento, evitando ao mesmo tempo a hipoglicémia. Se houver comorbilidades significativas, especialmente comorbilidades cardiovasculares, curta esperança de vida, elevado risco de hipoglicemia e risco de quedas, deve ser reconsiderado um relaxamento do alvo de HbA1c para 7-8%.
Opções terapêuticas
A terapia da diabetes mellitus tipo 2 deve ter uma abordagem holística, ou seja, a redução do peso, a optimização do perfil de risco cardiovascular e a prevenção da hipoglicémia devem ser sempre orientadas para A hipoglicemia recorrente, tal como a hiperglicemia, é provavelmente responsável pelas complicações a longo prazo e deve ser evitada.
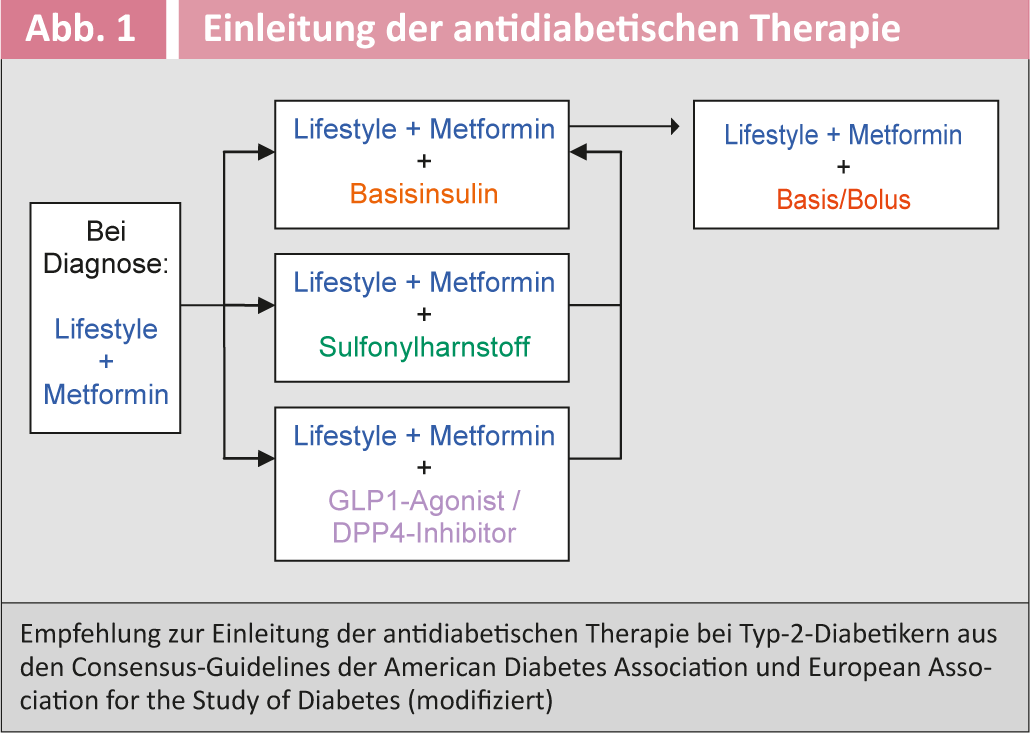
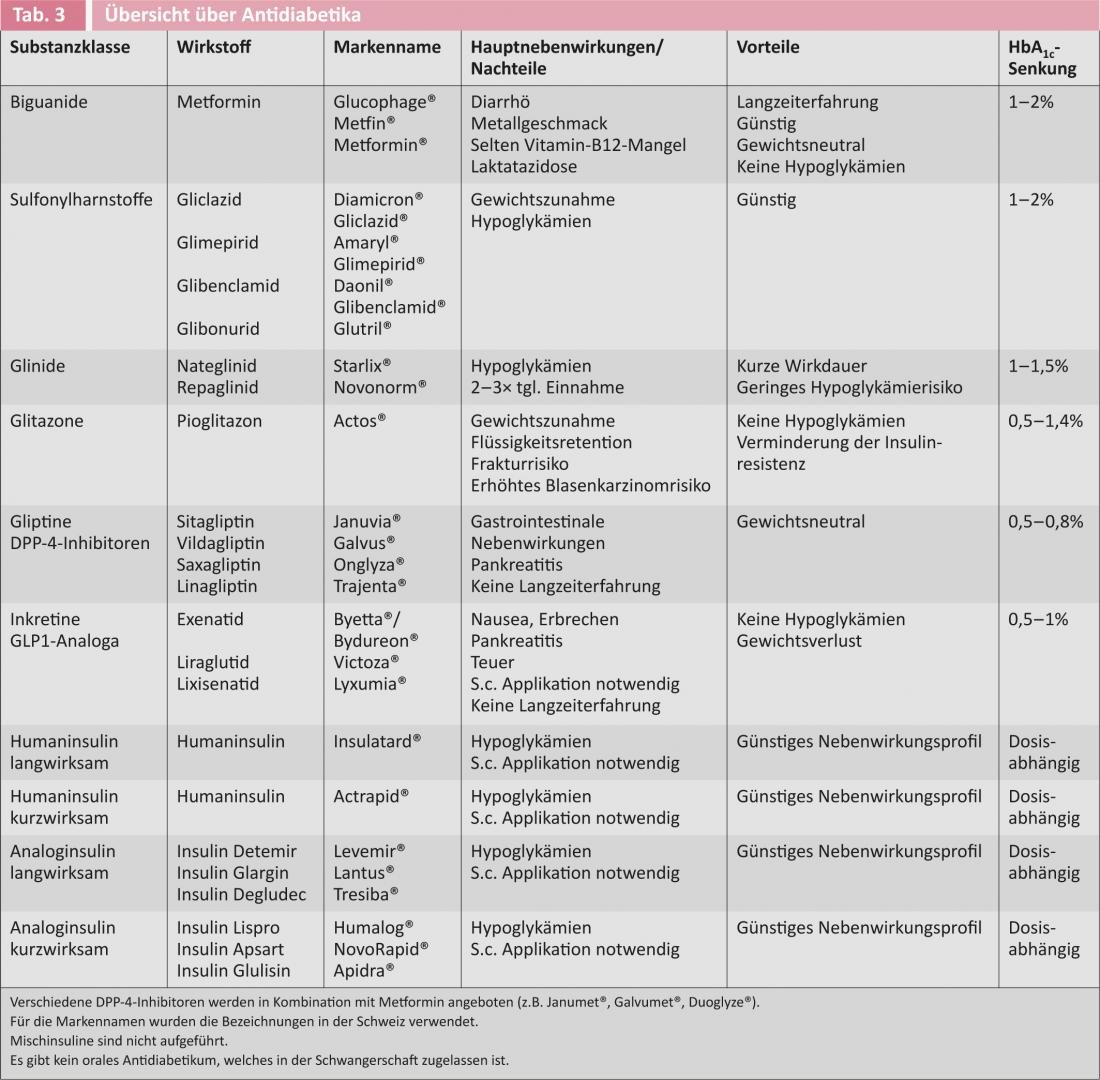
A figura 1 mostra a recomendação actual para iniciar a terapia antidiabética em diabéticos de tipo 2 das sociedades americanas e europeias de diabetes [6]. O quadro 3 dá uma visão geral dos medicamentos antidiabéticos disponíveis.
Intervenção no estilo de vida, desporto
A inactividade física e o sobreaquecimento, que levam à obesidade e resistência à insulina, são os principais factores ambientais que aumentam o risco de diabetes. Mesmo uma perda de peso moderada de 5-10% do peso corporal leva a uma melhoria significativa do estado metabólico diabético e do perfil de risco cardiovascular e pode tornar desnecessária a terapia medicamentosa para a diabetes. As modificações do estilo de vida incluem uma dieta saudável, equilibrada e com redução de calorias ao longo da vida e uma actividade física regular (por exemplo, pelo menos 150 min/semana) [8]. As intervenções nutricionais e desportivas acompanhadas têm frequentemente efeitos sustentáveis (por exemplo, Diafit.ch).
Metformin
Desde que não haja contra-indicações, metformina é o antidiabético oral de primeira escolha, devido ao seu perfil de eficácia favorável e a muitos anos de experiência. A metformina é neutra em termos de peso a ligeiramente inferior e não causa hipoglicémia. Os seus principais efeitos são a redução da gluconeogénese hepática, a melhoria da absorção de glucose pelas células musculares e adiposas e a redução dos triglicéridos [9]. Recentemente, a sua utilização tem sido recomendada para pacientes com poucas perspectivas de mudanças drásticas no estilo de vida já no momento do diagnóstico. Estudos actuais postulam uma redução da incidência e mortalidade por cancro sob terapia com metformina. Os principais efeitos secundários são queixas gastrointestinais, que podem ser reduzidas através da introdução lenta do medicamento e da prestação de boa informação ao doente [9]. Em casos extremamente raros (<1 caso/100 000 doentes), a ocorrência de acidose láctica foi descrita em doentes com insuficiência renal grave, pelo que a metformina está contra-indicada em doentes com uma depuração de creatinina <30 ml/min.
Sulfonilureias
As sulfonilureias (glibenclamida, gliclazida, glimepirida, glibonurida) estimulam a secreção de insulina independentemente do consumo alimentar, aumentando assim o risco de hipoglicémia e levando frequentemente ao aumento de peso. A hipoglicemia ocorre principalmente nos idosos e na presença de insuficiência renal grave (depuração de creatinina <30 ml/min), sendo o risco mais elevado com as glibenclamidas. A vantagem das sulfonilureias é que foram estabelecidas há muitos anos e os seus efeitos secundários são, portanto, bem conhecidos. Os doentes em terapia com sulfonilureia devem ser capazes de medir a glucose no sangue e ser educados sobre hipoglicemia e medidas comportamentais antes de conduzir [1, 6].
Glinide
Tal como as sulfonilureias, os glinídeos (nateglinide/repaglinida) também estimulam a secreção de insulina, pelo que a combinação destas preparações não é aconselhável. Os Glinides têm uma meia-vida mais curta e são dados a cada refeição. O grau de ganho de peso é semelhante ao das sulfonilureias, e o risco de hipoglicémia é menor [1,6].
Glitazones
As glitazonas são também chamadas “sensibilizadores da insulina” porque melhoram a sensibilidade insulínica do músculo, da gordura e do fígado. A rosiglitazona foi retirada do mercado na Suíça em 2010 devido ao aumento do risco cardiovascular, de modo que a pioglitazona é a única substância aprovada na Suíça. Além do conhecido ganho de peso, a terapia com glitazonas pode levar à retenção de líquidos, edema periférico e consequente insuficiência cardíaca, bem como a uma diminuição da densidade óssea, a um aumento do risco de fracturas e a um aumento da incidência de carcinomas da bexiga [1, 6]. A Sociedade Suíça de Endocrinologia e Diabetologia recomenda o uso de pioglitazona apenas em pacientes seleccionados com resistência insulínica severa e sem contra-indicações, especialmente insuficiência cardíaca.
Incrementos
Agonistas receptores da GLP1: O chamado efeito incremental descreve o fenómeno de que uma ingestão oral de glucose induz uma maior libertação de insulina do que uma administração intravenosa de glucose. O efeito incremental é responsável por cerca de 60% da secreção de insulina pós-prandial. Os dois incrementos conhecidos do peptídeo 1 (GLP1) e do peptídeo insulino-trópico dependente do glucose-dependente (GIP) são libertados das células enteroendócrinas da parede intestinal após a ingestão alimentar peroral. Estas activam as células pancreáticas β e, assim, levam ao aumento da secreção de insulina. Além disso, inibem a gluconeogénese através do seu efeito sobre as células α, atrasam o esvaziamento gástrico e inibem centralmente o apetite. Uma vez que o efeito do aumento é dependente do glucose-dependente, a hipoglicémia não ocorre com a monoterapia. Como mais um efeito positivo, os agonistas da GLP1 promovem a redução do peso. Os análogos GLP1 são caros e têm de ser aplicados de forma subcutânea. Os principais efeitos secundários são náuseas, vómitos e diarreia [1, 6].
Inibidores de Gliptins/DPP-4: GIP e GLP1 são rapidamente degradados por peptidase-4 dipetidyl (DPP-4), de modo que os inibidores DPP-4 foram desenvolvidos como mais uma classe de substâncias. A hipoglicémia não ocorre durante a terapia com inibidores do DDP-4 e são neutros em termos de peso. A tolerabilidade dos inibidores DPP-4 é boa, as queixas gastrointestinais raramente ocorrem. Contudo, há provas de um risco acrescido de cancro pancreático e pancreático. Esperam-se para breve estudos a longo prazo com pontos finais difíceis e ocorrência de efeitos secundários. Na insuficiência renal, é necessário o ajuste da dose para a maioria dos inibidores de DPP-4 [1, 6].
Insulina
A deficiência de insulina existe em todas as formas de diabetes, pelo que a substituição da insulina é sempre, em princípio, uma opção terapêutica adequada. Todos os doentes que estão ajustados à insulinoterapia devem ser treinados em aconselhamento sobre diabetes no que diz respeito ao autocontrolo e comportamento em caso de hipoglicémia. Para diabéticos do tipo 2, a insulina para dormir é iniciada antes da hora de dormir a 0,2 E/kgKG ou 10 E e lentamente titulada até os níveis de glicemia em jejum serem inferiores a 7 mmol/l. A insulina de base pode ser combinada com um antidiabético oral, de preferência metformina. A combinação com sulfonilureias não tem um efeito aditivo significativo na redução de HbA1c. Se o HbA1c ainda for >7%, mudar para um regime de base/bolus [1, 6].
Operações bariátricas
A operação mais comummente executada é a operação de bypass gástrico (chamada Roux-en-Y), na qual o estômago é significativamente reduzido em tamanho e o intestino delgado é ligado directamente ao estômago. Os resultados destas operações são muito convincentes a curto prazo, com uma perda de peso há muito esperada que pode atingir 30-40% em muitos casos. Os efeitos secundários incluem sinais de má absorção, especialmente ferro e deficiência de vitamina B12, que precisam de ser substituídos. No pós-operatório, ocorrem frequentemente problemas psicológicos, em parte devido à perda do efeito compensador dos alimentos. A mortalidade da cirurgia de bypass gástrico é de cerca de 0,5%. Se a cirurgia bariátrica é a panaceia na luta contra a diabetes mellitus não pode ser respondida até à data, uma vez que não estão disponíveis dados a longo prazo relativos à remissão da diabetes e à redução da mortalidade. Num documento de posição da Federação Internacional de Diabetes (IDF) de 2011, a cirurgia bariátrica é recomendada principalmente para diabéticos obesos tipo 2 (IMC ≥35kg/m2) que não atingem os objectivos de tratamento com medidas convencionais e têm comorbilidades cardiovasculares [10]. A cirurgia bariátrica não deve ser avaliada como um “último recurso” em diabéticos obesos com resistência à insulina, mas como uma opção de tratamento numa fase inicial.
Procedimento na prática clínica diária
Quando a diabetes mellitus é diagnosticada, devem ser iniciadas intervenções de estilo de vida juntamente com medicação com metformina. Para a intervenção no estilo de vida, existem programas de educação em ambulatório para diabéticos. Além disso, deve realizar-se neste momento um levantamento de todos os factores de risco cardiovascular e deve procurar-se eliminar os danos dos órgãos. Se a diabetes ainda estiver insuficientemente controlada sob estas medidas (HbA1c >7,0%), a metformina deve ser combinada com uma sulfonilureia ou com um aumento ou, em alternativa, com uma insulina para dormir. Se o controlo da diabetes ainda for inadequado, é indicada a implementação de uma insulina para dormir ou de um sistema básico de bolus. Recomendamos que os diabéticos obesos que não conseguem por si próprios uma redução de peso sejam encaminhados para um centro de obesidade experiente. Aí é possível a participação num grupo de obesidade ou num grupo de pessoas com obesidade. a opção de intervenção bariátrica é avaliada.
Bibliografia da editora
Stefanie Meyer, MD
CARDIOVASC 2013; 12(4): 20-24











