O Clostridium difficile é uma causa comum de diarreia e colite associadas a antibióticos. A incidência está a aumentar. As formas recorrentes da doença em particular levam a um elevado “fardo da doença”.
De acordo com dados epidemiológicos publicados em 2017, as estirpes toxigénicas de Clostridium difficile (C.difficile) estão presentes em até 15,5% dos doentes hospitalizados, com uma taxa de mortalidade entre 3% e 14% [2]. Em 10-20% dos casos de diarreia associada a antibióticos, trata-se de diarreia associada a C. difficile . O início dos sintomas é típico horas a semanas após o tratamento antibiótico; a prevalência varia dependendo do ingrediente activo utilizado (ampicilina 5-10%; ácido amoxicilina-clavulânico 10-25%; cefixima 15-20%; outros como cefalosporinas, fluoroquinolonas, macrolídeos, tetraciclina 2-5%), disse o orador [3]. O risco de recidiva após um primeiro episódio tratado com sucesso é de cerca de 20% e aumenta para 40-60% após o segundo episódio, explica o Prof. Ansgar W. Lohse, MD, Director Clínico e Especialista em Medicina Interna e Gastroenterologia, Centro Médico Universitário Hamburg-Eppendorf [1,3].
Diagnóstico: O que é que as directrizes actuais recomendam?
Segundo o Professor Lohse, as características clínicas clássicas de uma infecção por C.difficile (CDI) são as seguintes: diarreia aquosa (raramente com sangue), febre (28%), dores abdominais (22%), íleo, megacólon tóxico, perfuração intestinal, sepsis [3]. Para o trabalho de diagnóstico, os seguintes factores de risco podem ser indicativos de um possível CDI como tentativa de diagnóstico no caso de sintomas correspondentes: terapia antibiótica (cefalosporinas, quinolonas, clindamicina, ácido clavulânico); inibidores da bomba de protões; imunossupressão; idade>65 anos; colonização com C. difficile (0-3% em pessoas não hospitalizadas; 20-40% em doentes hospitalizados; doença inflamatória crónica do intestino [2–4].
De acordo com a directiva S2k, C. difficile gastrointestinal e norovírus são possíveis causas de gastroenterite nosocomial; outros agentes patogénicos são irrelevantes e não precisam de ser testados, explicou o orador. Como medida de precaução, os doentes devem ser isolados do contacto até 48 horas após o início dos sintomas clínicos se houver suspeita de gastroenterite infecciosa (ver caixa) [3,5]. O orador acrescentou que 48 h após o fim dos sintomas, a desisolação poderia ser realizada sem novo teste [3].

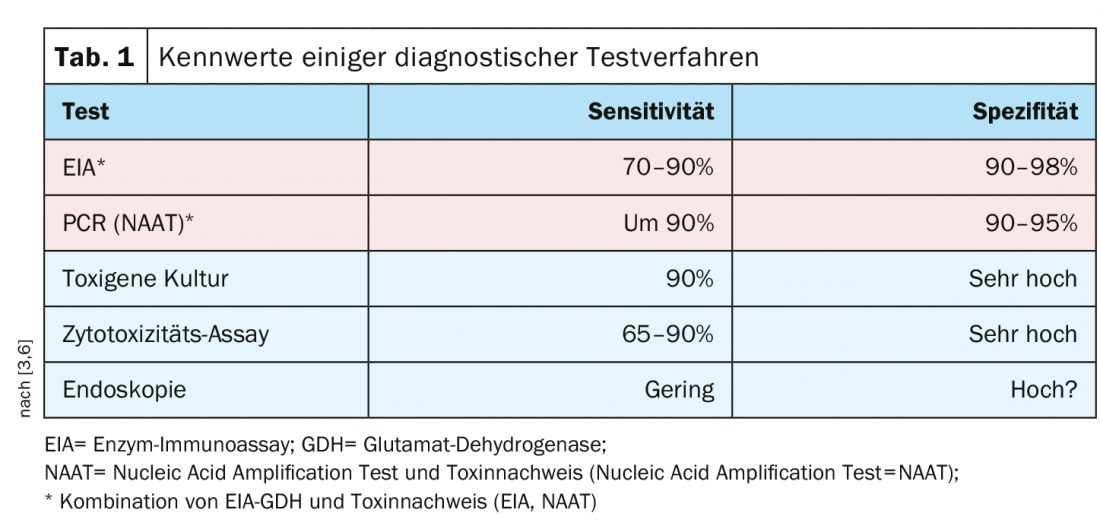
Existem vários métodos de ensaio com uma elevada sensibilidade e especificidade, sendo recomendada uma combinação de imunoensaio enzimático/glutamato desidrogenase (EIA-GDH) e detecção de toxinas (imunoensaio enzimático=EIA; teste de amplificação de ácido nucleico=NAAT) (Tab. 1).
A vancomicina é agora considerada terapia de primeira linha
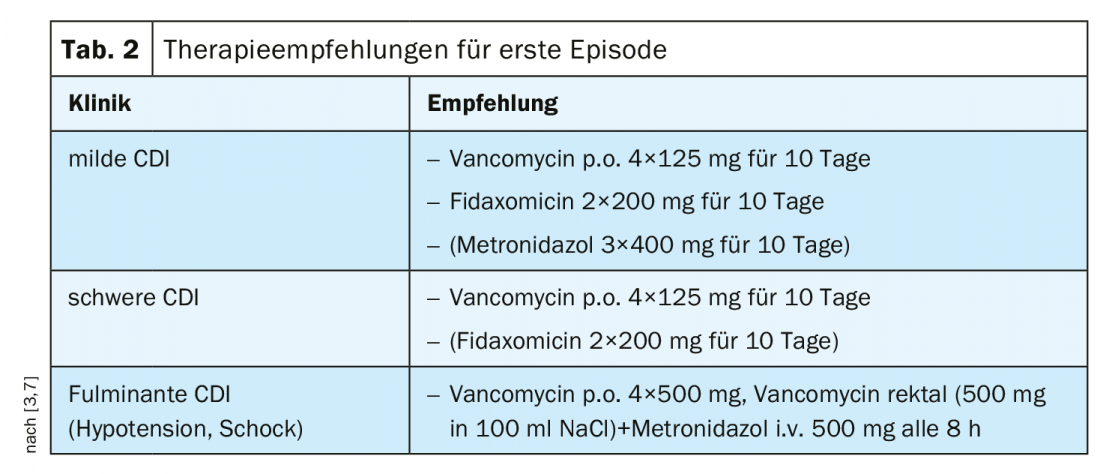
Anteriormente, o metronidazol era recomendado para CDI leve a moderado como tratamento rentável [1]. A vancomicina tem sido utilizada em casos de intolerância ao metronidazol e/ou aumento do risco de recidiva [1]. Com base nos resultados relevantes do estudo, a recomendação de acordo com as directrizes IDSA/SHEA de 2018 foi ajustada em função da severidade do CDI [1]. De acordo com as recomendações de consenso actuais, a vancomicina é considerada terapia de primeira linha tanto para graus moderados como severos de CDI. (Tab. 2). Se o CDI for suave e houver risco de recorrência, a fidaxomicina pode ser utilizada; contrariamente a avaliações anteriores, o uso de metronidazol deve ser limitado a casos de falta de disponibilidade ou intolerância dos outros dois agentes [7]. Em formas graves e cursos complicados de CDI, a vancomicina deve ser sempre utilizada como tratamento de primeira linha [3]. Os preditores de CDI severo de acordo com a directriz S2k são apresentados na visão geral 1. A vancomicina ou fidaxomicina pode ser utilizada para o tratamento de CDI recorrente [3,7] (Tab. 3).

A profilaxia de recaída é muito importante
Os dados mostram que mesmo após um tratamento bem sucedido com alívio dos sintomas, uma proporção significativa de pacientes recai e o risco de recaída aumenta com cada recidiva [8]. O critério temporal para uma recaída é uma nova ocorrência de sintomas no período de pelo menos duas semanas a no máximo dois meses após a melhoria dos sintomas iniciais (nova infecção versus reinfecção), de acordo com o orador [3].

Nos dois ensaios randomizados controlados por placebo MODIFY I e MODIFY II, a administração concomitante de uma dose única de bezlotoxumab (10 mg por quilograma de peso corporal) durante a terapia padrão (vancomicina, metronidazol ou fidaxomicina) para C. difficile resultou numa redução de 38% na taxa de recidivas no prazo de 12 semanas [9].
Na Suíça, bezlotoxumab, um anticorpo monoclonal com alta afinidade com a toxina B C. difficile, foi aprovado desde o final de 2017 para a prevenção de recidivas de Clostridioides difficile. Bezlotoxumab é dirigida contra a toxina B C. difficile. Outra opção para a profilaxia de recaída com uma elevada taxa de sucesso é a transferência de microbiomas fecais (FMT) [2,3,12].

Existem novos resultados de investigação sobre estratégias preventivas, tais como a utilização de probióticos, a microbiomanipulação intestinal durante a antibiose, vacinas, bem como novos antibióticos que reduzem os efeitos negativos sobre o microbioma intestinal [1]. Relativamente à opção de vacinação, um ensaio da fase III ainda está na fase de recrutamento até 2020 [3,13].
Fonte: DGIM, Wiesbaden (D)
Literatura:
- Dieterle MG, Rao K, Young VB: Novas terapias e estratégias preventivas para infecções primárias e recorrentes por Clostridium difficile. Edição especial: Antimicrobianos Terapêuticos de 2019; 1435 (1): 110-138.
- Solbach P, Dersch P, Bachmann O: Estratégias de tratamento individualizado para infecções por Clostridium difficile [Article in German]. Internista (Berl) 2017; 58(7): 675-681. doi: 10.1007/s00108-017-0268-2.
- Lohse A: Apresentação deslizante, DGIM 2019, 05.05.2019, Abdómen agudo: Unidade 1: C. diff. Colitis, Prof. Dr. med. A. Lohse, Director Clínico, Especialista em Medicina Interna e Gastroenterologia, Centro Médico Universitário Hamburg-Eppendorf.
- Gould LH, Limbago B: Clostridium difficile em alimentos e animais domésticos: um novo agente patogénico de origem alimentar. Clin Infect Dis 2010; 51(5): 577-582. doi: 10.1086/655692.
- AWMF: Infecções gastrintestinais e a doença de Whipple, S2k guideline 2015, AWMF online. O portal da medicina científica, número de registo 021-024, a partir de 31.01.2015 , válido até 30.01.2020. www.awmf.org/leitlinien/detail/ll/021-024.html, acedido pela última vez a 15 de Maio de 2019.
- Manthey CF, Eckmann L, Fuhrmann C: Terapia para a infecção por Clostridium difficile – alguma notícia para além de Metronidazole e Vancomycin? Revisão especializada de Farmacologia Clínica 2017; 10 (11). www.tandfonline.com, acedido pela última vez a 15 de Maio de 2019.
- McDonald LC, et al: Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin. Infect Dis 1018; 66: e1-e48.
- Deshpande A, et al: Factores de risco de infecção recorrente por Clostridium difficile: uma revisão sistemática e uma meta-análise. Infect Control Hosp Epidemiol 2015; 36: 452-460.
- Wilcox MH, et al: Bezlotoxumab para a Prevenção de Clostridium difficile Recurrent Infection. N Engl J Med 2017; 376(4): 305-317.
- Curry SR, et al: Alta frequência de resistência à rifampicina identificada numa epidemia Clostridium difficile clone de um grande hospital universitário. Clin Infect Dis 2009; 48: 425-429.
- Muller L, Halfmann A, Herrmann M: [Current data and trends on the development of antibiotic resistance of Clostridium difficile]. Bundesgesundheitsblatt Health Research Protecção da Saúde 2012; 55: 1410-1417.
- Van Nood, E: Infusão duodenal de fezes de doadores para Clostridium difficile recorrente. NEJM 2013; 368(5): 407-415.
- Pfizer Inc: Ensaio de eficácia da vacina Clostridium difficile: NCT03090191. www.pfizer.com/science/find-a-trial/nct03090191, acedido pela última vez a 15 de Maio de 2019.
HAUSARZT PRAXIS 2019; 14(6): 32-33 (publicado 24.5.19, antes da impressão).