Sendo a doença pulmonar crónica mais comum em bebés, a displasia broncopulmonar (DPB) está associada a consequências a longo prazo que se estendem até à idade adulta. Apesar de melhorias significativas nos cuidados perinatais, a incidência de DPB entre os bebés mais imaturos permaneceu inalterada ou até aumentou. A diferente incidência de DPB nos vários centros perinatais reflecte tanto as diferenças na população de doentes como nos métodos de tratamento.
Sendo a doença pulmonar crónica mais comum nos lactentes, a displasia broncopulmonar (DPB) está associada a consequências a longo prazo que se estendem até à idade adulta [1,2]. Apesar de melhorias significativas nos cuidados perinatais, tais como o tratamento pré-natal com esteróides para atingir um “surto” de maturação dos pulmões, a terapia surfactante e o desenvolvimento de estratégias de ventilação adaptadas, a incidência de DPB nos bebés mais imaturos manteve-se inalterada ou até aumentou [3]. Isto deve-se provavelmente a uma redução significativa das taxas de mortalidade juntamente com um aumento do número total de bebés tratados nascidos significativamente prematuros. A diferente incidência de DPB nos vários centros perinatais reflecte tanto as diferenças na população de doentes como nos métodos de tratamento [4–7]. As publicações relatam uma incidência de BPD de até 68% em bebés de muito baixo peso à nascença (401-1500 g) com idade gestacional inferior a 29 semanas de gestação, ou até 77% em bebés nascidos com menos de 32 semanas de gestação ou com um peso à nascença inferior a 1 kg [5,8,9]. Estes números provêm principalmente de países com um produto interno bruto elevado. Com aproximadamente 15 milhões de crianças nascidas prematuras todos os anos em todo o mundo, os números acima demonstram o significativo desafio clínico e socioeconómico [10].
A doença pulmonar neonatal crónica é classificada em três níveis de gravidade, tal como definido por Jobe e Bancalari: suave (suplementação com oxigénio durante pelo menos 28 dias pós-natal), moderada (suplementação com oxigénio <30% às 36 semanas de pós-menstrualidade) e grave (suplementação com oxigénio 30% e/ou suporte ventilatório às 36 semanas de pós-menstrualidade) [1].
Grandes estudos clínicos identificaram numerosos factores de risco para o desenvolvimento da DPB, incluindo infecções congénitas e nosocomiais, ventilação mecânica e toxicidade do oxigénio [11–16]. O impacto destes desafios pré e pós-natais é ainda determinado pela presença de deficiência calórica ou deficiência de vitaminas e oligoelementos, bem como pela secreção insuficiente de hormonas supra-renais e da tiróide, que aumentam ainda mais o risco de desenvolvimento de morbilidade pulmonar [17–19]. A vulnerabilidade do pulmão em desenvolvimento ao desenvolvimento de danos crónicos é também aumentada de 3 a 4 vezes pela presença de retardamento do crescimento intra-uterino [20–24], pelo que o desenvolvimento alveolar e vascular é decisivamente prejudicado pela transmissão de sinal alterado subjacente [25]. A exposição ao fumo de cigarros pré-natal – amplamente subestimada clinicamente devido à falta de história e de marcadores clínicos – também tem demonstrado contribuir significativamente para o desenvolvimento da doença, possivelmente para além de um impacto no crescimento somático [26,27].
O papel das terapias estabelecidas deve também ser constantemente revisto no que diz respeito a uma possível contribuição para o desenvolvimento de complicações crónicas. Os efeitos do tratamento com esteróides e antibióticos maternos são discutidos a seguir, neste contexto.
** Adaptado de: Pontuação baseada na ressonância magnética do pulmão doente no bebé prematuro com DPB. Kai Förster, Hannah Busen, Sophia Stöcklein, Olaf Dietrich, Harald Ehrhardt, Mark O. Wielpütz, Andreas W. Flemmer, Benjamin Schubert, Marcus A. Mall, Birgit Ertl-Wagner, Anne Hilgendorff. Este manuscrito está a ser submetido em Tórax.
A discussão sobre a importância de vários factores de risco deve, em última análise, ser conduzida no contexto do nosso conhecimento actual, em constante evolução, sobre a importância dos polimorfismos genéticos, e os estudos relatam que até 53% da variação na BPD pode ser devida a este [28]. As anomalias genéticas identificadas incluem mutações em genes relacionados com a síntese de surfactantes, resposta imunitária inata [29,30] e dismutase superóxida [31]. O maior risco de desenvolver DPB e hipertensão arterial pulmonar (HAP) em bebés pré-termo do sexo masculino [32] tem sido associado a diferenças na regulação hormonal [33]. Em contraste, mais abaixo, as mulheres com uma história de BPD são mais afectadas a longo prazo [34].
As dificuldades em identificar factores de risco genético clinicamente relevantes surgem tanto na diferenciação entre variáveis que influenciam o risco de nascimento prematuro per se [35] como na consideração de complicações agudas [36] e crónicas em relação umas às outras. O facto de grandes estudos de associações genéticas [37] ainda não terem sido capazes de acompanhar os sucessos noutras áreas da doença, tais como fibrose cística [38] ou HAP [39,40] em termos de resultados de definição de tendências com relevância clínica pode, contudo, para além das razões mencionadas, ser também uma indicação da heterogeneidade do diagnóstico da DPB. No futuro, a identificação de (sub)entidades subjacentes à doença pode permitir a atribuição mais clara de certos factores de risco e polimorfismos genéticos. Do mesmo modo, o conhecimento de sítios-chave na transdução de sinal que controlam a interacção de diferentes populações de células pulmonares permitirá a classificação dos genes candidatos. As secções seguintes abordam vários aspectos desta questão.
Da causa à consequência: inflamação e resposta ao stress oxidativo
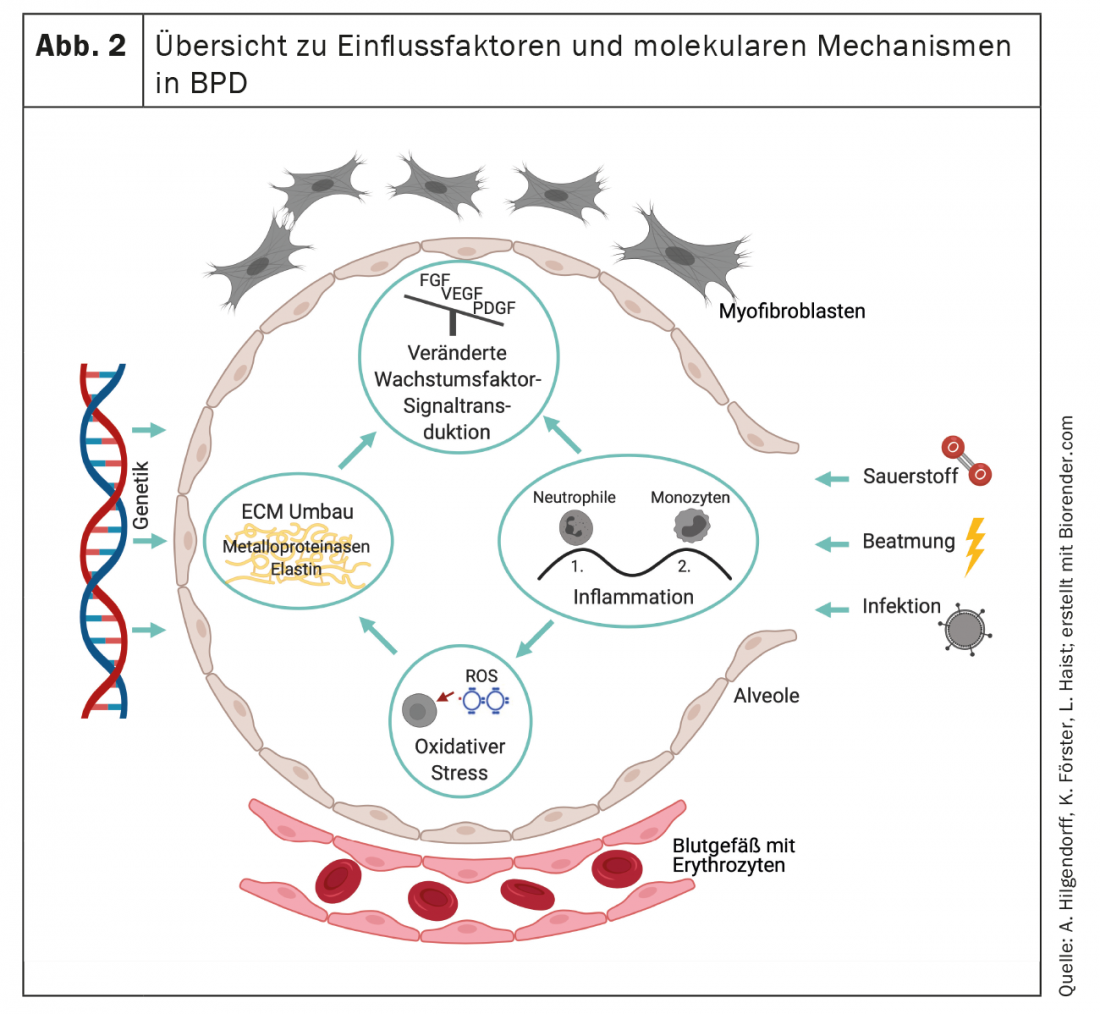
As influências exógenas descritas actuando pré e pós-natais sobre um pulmão estrutural e funcionalmente imaturo levam a uma resposta inflamatória persistente, remodelação da matriz extracelular (ECM) e alterações fibróticas difusas, incluindo hipertrofia muscular lisa nas pequenas artérias pulmonares e vias respiratórias [41]. As alterações histopatológicas características com o quadro de perturbação da alveolarização e vasculogénese [1] resultam na hipoventilação alveolar, que se expressa no quadro clínico de hipercapnia e hipoxemia e na descoordenação ventilação-perfusão [42].
Os processos inflamatórios agudos e crónicos que caracterizam a BPD são causados tanto por mecanismos pré como pós-natais. As infecções e a correspondente capacidade de gerar uma resposta imunitária competente desempenham um papel importante no desenvolvimento da BPD [13,43–45]. Os processos inflamatórios pré-natais, que são resumidos por exemplo pelo termo “síndrome de resposta inflamatória fetal (FIRS)” ou ocorrem no contexto de eventos infecciosos manifestos como a corioamnionite pré ou pós-natal no contexto de infecções congénitas e nosocomiais, levam a um influxo de granulócitos neutrófilos para o pulmão imaturo. Como resultado, há a presença de um número crescente de monócitos e macrófagos como parte da chamada “segunda onda” da resposta imunológica [24,46,47]. O papel da imunidade inata é aqui de particular importância, uma vez que a imunidade adaptativa também pode ser expressa de forma variável em função da idade gestacional [48]. Estudos com animais sugerem que a remodelação da matriz extracelular e a disfunção epitelial alveolar precoce não são apenas uma consequência da resposta inflamatória, mas também promovem-na [49,50] e assim causam alterações duradouras na função imunitária pulmonar. Prenatally, a utilização generalizada de tratamentos antibióticos maternos leva a uma mudança duradoura na flora bacteriana da criança [51] e à função imunológica da prole no modelo do rato [52].
Postnatalmente, a indução de lesões por baro- e volutrauma durante a ventilação mecânica e as consequências de hiperóxia moderada ou grave são factores de risco importantes para o início e manutenção dos processos inflamatórios acima salientados a nível local e mesmo sistémico [53–56]. A libertação de citocinas como o factor de crescimento transformador (TGF)-β, o factor de necrose tumoral (TNF)-alfa e interleucinas, por exemplo IL-1beta, contribui significativamente para o desequilíbrio da transdução de sinal de vários (outros) factores de crescimento e leva à activação de factores de transcrição que promovem a apoptose em diferentes células [57–59]. A discussão sobre o papel das células inflamatórias recrutadas e residentes [60–64] proporcionará importantes insights sobre as relações mecanicistas e para a identificação de opções terapêuticas. Neste contexto, contudo, a suspeita de influência das células inflamatórias no desenvolvimento pulmonar irá também gerar novas abordagens de investigação [65].
Os processos inflamatórios agudos e crónicos devem ser considerados no contexto da capacidade celular de responder a desafios pós-natais persistentes ou recorrentes. Aqui, a relativa falta de antioxidantes e inibidores das enzimas proteolíticas torna o pulmão imaturo particularmente vulnerável aos efeitos dos metabolitos tóxicos do oxigénio e das proteases libertadas da matriz extracelular e dos granulócitos e macrófagos neutrófilos residentes ou recrutados [66-69]. Vários estudos demonstraram provas de um aumento do stress oxidativo no bebé prematuro. Assim, as concentrações de malondialdeído urinário são elevadas na primeira semana de vida devido à peroxidação das membranas lipídicas na sequência de danos mediados oxidativamente e demonstraram estar correlacionadas com o risco de doenças radicais do oxigénio, incluindo a BPD [70]. As concentrações diminuídas de antioxidantes pulmonares foram medidas na lavagem de bebés prematuros [71], e outros estudos indicam que os pacientes adolescentes com DPB são caracterizados por sinais de aumento do stress oxidativo nas vias respiratórias, um sinal de alterações a longo prazo no sistema respiratório após o nascimento prematuro [72]. As terapias estabelecidas também precisam de ser revistas criticamente no que diz respeito ao seu papel no desenvolvimento pulmonar à luz de novas provas, como, por exemplo, a administração pré-natal de betametasona, apesar da sua utilização pré-natal mais generalizada para promover a maturação pulmonar e prevenir o desconforto respiratório, reduzindo simultaneamente as taxas de DPB [73,74] demonstraram aumentar os indicadores de peroxidação da membrana lipídica [70].
Estas alterações a longo prazo na resposta ao stress oxidativo e outros processos reflectem-se em respostas alteradas às infecções virais mais tarde na vida [75]. A resposta do pulmão em desenvolvimento aos danos iniciais, também no que diz respeito às consequências a longo prazo, é específica e diferente da resposta do organismo adulto. Enquanto a exposição crónica ao oxigénio (60% durante 14 dias) nos pulmões de rato neonatais aumenta a contracção dos vasos pulmonares e do músculo liso das vias respiratórias e reduz o relaxamento do óxido nítrico, o fenómeno oposto ocorre em animais adultos [76]. Os efeitos a longo prazo após a exposição à hiperoxia na primeira semana de vida (100% durante 4 dias) incluem principalmente complicações cardiovasculares, nas quais se desenvolveu uma tensão ventricular direita na HAP e um aumento consecutivo da mortalidade como consequência de doença vascular pulmonar em modelos animais [77]. A transdução de sinal alterada pela proteína morfogénica óssea (BMP) oferece uma explicação patomecânica. Outros mecanismos que explicam o aumento da susceptibilidade a danos agudos e a longo prazo no pulmão recém-nascido são demonstrados por outro estudo sobre efeitos induzidos pela hiperoxia. No rato neonatal – ao contrário do animal adulto – as células progenitoras da medula óssea, circulantes e endoteliais do pulmão são significativamente reduzidas aqui [78], o que pode levar a um esgotamento precoce das capacidades de reparação e regeneração. A influência em outros processos centrais, tais como a regulação do ciclo celular com uma upregulação de P21 após hiperoxia e uma actividade reduzida deacetylase histonal [79], bem como os efeitos na metilação do ADN [80] também apontam para o desenvolvimento precoce de efeitos cumulativos relevantes a longo prazo no contexto de mecanismos compensatórios reduzidos no pulmão imaturo.
Características histopatológicas – gerador de relógio e função “memória
A interacção do compartimento epitelial, mesenquimal e endotelial das células na sua interacção para o desenvolvimento da área de troca de gás é essencialmente orquestrada pela regulação de vários factores de crescimento. Estes incluem Notch e Wingless Int-1 (Wnt), fibroblasto e factor de crescimento derivado de plaquetas (FGF e PDGF), BMP e factor de crescimento endotelial vascular (VEGF) [81–87]. A interferência precoce com estes factores de transcrição perturba a morfogénese pulmonar normal [88], resultando na falta de diferenciação das estruturas alveolares [89]. Do mesmo modo, a regulação de factores centrais de transcrição como o factor nuclear kappa B (NF-kB) desempenha um papel e contribui para o mal desenvolvimento da superfície de troca de gás [88,90,91]. A associação característica da alveolarização deficiente com a presença de capilares dismórficos é impulsionada pela expressão alterada dos factores de crescimento angiogénicos, que incluem a expressão pulmonar reduzida do factor de crescimento endotelial vascular (VEGF) e dos receptores VEGF. [92–94] bem como óxido nítrico sintase endotelial reduzido (eNOS) e guanilato ciclase solúvel (sGC) em vasos sanguíneos pulmonares e vias respiratórias incluem [95,96]. As alterações são semelhantes às do organismo em envelhecimento e contribuem – também devido à reduzida plasticidade dos capilares e dos pequenos vasos – para o risco de HAP e para o desenvolvimento prejudicado do sistema linfático nos pulmões à medida que a doença progride [97–100].
A transdução perturbada do sinal, juntamente com os efeitos directos, por exemplo, do estímulo de estiramento devido à ventilação mecânica e à toxicidade do oxigénio, contribuem para alterações graves no cadafalso pulmonar [101,102]. O aumento da remodelação da matriz extracelular é indicado, por exemplo, pelo aumento da excreção urinária de desmosina, precedido pelo aumento da actividade de elastase [103–105] e é semelhante aos achados em doentes com síndrome do desconforto respiratório agudo (SDRA) [106]. No entanto, o desenvolvimento fisiológico dos pulmões também depende da presença de elastases pulmonares e metaloproteinases, uma vez que a deficiência de metaloproteinase de matriz completa promove a remodelação pulmonar do tipo BPD [107].
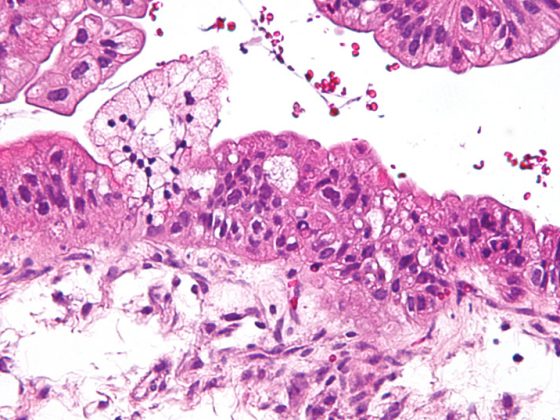
Como resultado da remodelação, a BPD é caracterizada por uma disposição patológica de elastina e mudanças qualitativas e quantitativas no quadro do colagénio. [108–110] Caracteriza a função estruturante da matriz como um andaime para a formação de novos alvéolos e capilares e define o destino das células que povoam o órgão em desenvolvimento [111,112] (Fig. 2). A reorganização irreversível da matriz extracelular conduzirá assim a mudanças a longo prazo que se manifestarão a vários níveis.
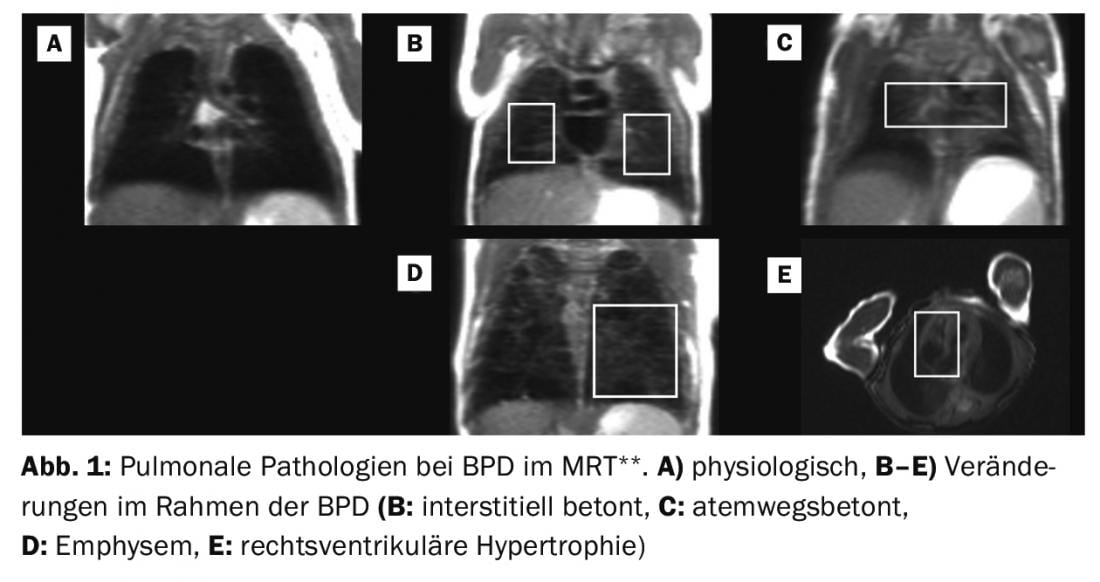
As alterações histopatológicas e o desenvolvimento e aspecto clinicamente heterogéneo da BPD sugerem a existência de (sub)entidades da doença ou pelo menos uma influência individualmente diferente de várias mudanças estruturais na aparência clínica e no curso a longo prazo. Neste contexto, a presença de processos primários enfisematosos ou intersticiais de remodelação, alterações vasculares e/ou patologias do tracto respiratório são presumivelmente “variáveis” indicativas da DPB, que em estudos iniciais também podem ser retratadas imagens-morfológicas em bebés prematuros através de estratégias de imagem clinicamente viáveis [113–117]. Ao replicar estudos bem sucedidos de outras áreas da doença, a utilização de outras estratégias de imagem [118–121] poderia melhorar ainda mais a estratificação dos doentes no futuro.
Função pulmonar na BPD – Alterações precoces e consequências a longo prazo
Apesar dos esforços sustentados nos cuidados perinatais para evitar complicações a longo prazo [122,123], a manifestação de sintomas respiratórios na idade adulta é comum e muitas vezes mal interpretada como asma ou DPOC, especialmente se os primeiros eventos da vida não forem conhecidos ou indagados sobre [124,125].
Clinicamente, a disfunção pulmonar caracteriza-se pela diminuição da complacência pulmonar, taquipneia e aumento da ventilação por minuto, reflectida pelo aumento do trabalho de respiração com e sem dependência de oxigénio. Este quadro clínico pode ser acompanhado por um aumento da pressão microvascular nos pulmões, o que contribui para o desenvolvimento de edema pulmonar intersticial. O aumento da resistência vascular pulmonar, tipicamente associado à redução da resposta à inalação de óxido nítrico e outros vasodilatadores, pode progredir para HAP reversível ou persistente e insuficiência cardíaca direita [99,100]. O conhecimento de alterações precoces na função pulmonar é crucial, uma vez que é mais provável que doenças pulmonares mais graves após o nascimento evoluam para uma DPB moderada/severa na data esperada do parto [126] e a função pulmonar é um bom preditor da morbilidade e mortalidade subsequentes [127]. BPD é caracterizada na função pulmonar pelo aumento da resistência das vias respiratórias e vias respiratórias hiper-reactivas [128]que se manifesta clinicamente – em conjunto ou independentemente de infecções pulmonares – por broncoconstrição episódica e cianose (Fig. 3). A proporção de patologia vascular-mediada que desempenha aqui um papel para além do efeito Euler-Liljestrand permanece muitas vezes pouco clara porque faltam indicadores sensíveis. Os bebés afectados podem permanecer dependentes de oxigénio durante meses ou anos, sendo que apenas uma minoria depende efectivamente de oxigénio para além dos dois anos de idade [129,130]. A dependência do oxigénio caracteriza a gravidade particular da doença pulmonar, e estes bebés são readmitidos no hospital duas vezes mais frequentemente do que os bebés não dependentes do oxigénio. No entanto, mesmo após o fim da oxigenoterapia, os pacientes com moderados ou severos em até 70% requerem hospitalizações repetidas, especialmente nos primeiros dois anos de vida [126,131,132]. No entanto, em geral, as infecções das vias respiratórias inferiores causadas pelo vírus sincicial respiratório (RS) continuam a ser a principal causa de readmissão hospitalar em bebés prematuros, independentemente do estado da DPB [133].
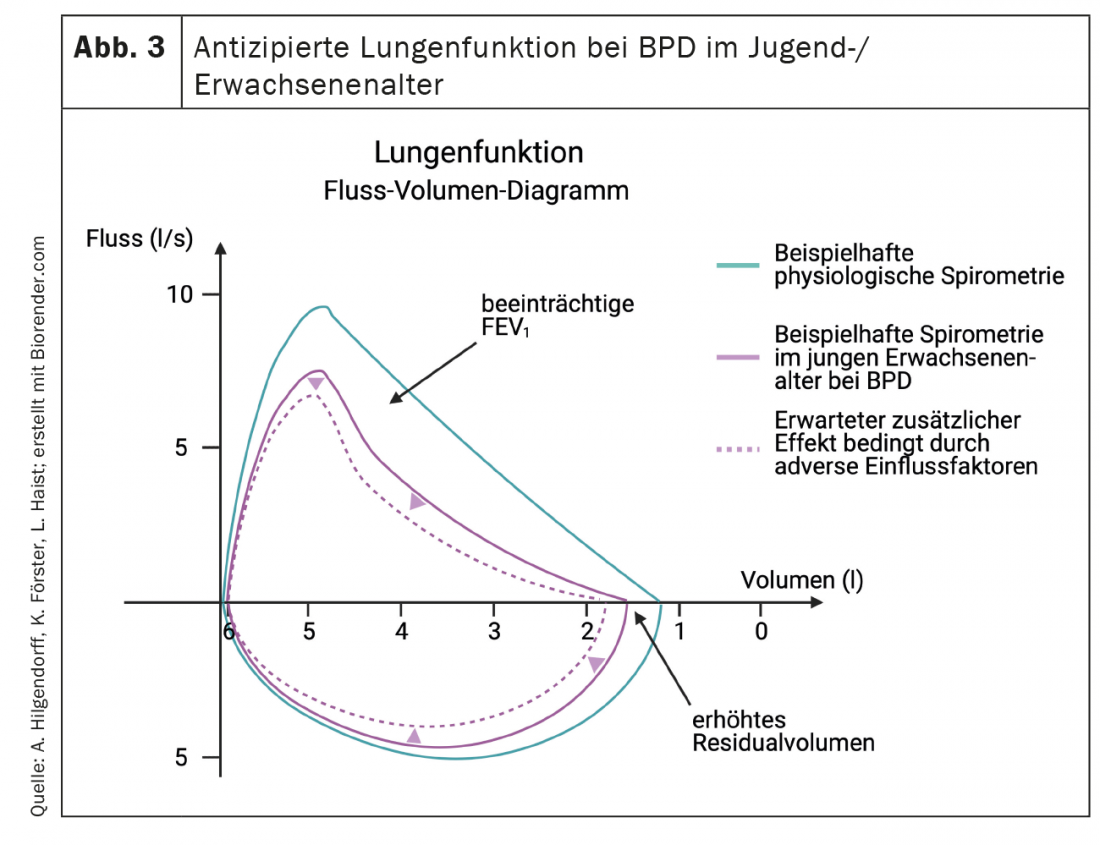
Mais tarde, no decurso da doença, a BPD é um factor de risco significativo para a sibilância persistente e para a necessidade de terapia inalatória (odds ratios 2.7 e 2.4, respectivamente), que afecta cerca de 20-30% dos bebés com BPD aos seis e 12 meses de idade [134,135]. Os sintomas respiratórios, especialmente em crianças com histórico de sibilância, permanecem frequentemente [129,136] em idade pré-escolar e escolar, e até 80% dos bebés prematuros apresentam frequentes obstruções sintomáticas das vias respiratórias na primeira infância e adolescência [137–139]. No estudo EPICure [140] foram obtidos dados importantes sobre os resultados a longo prazo após o nascimento prematuro. Os bebés prematuros com imaturidade extrema sofrem de picos significativamente mais baixos de consumo de oxigénio em idade escolar como uma avaliação directa da aptidão cardiorrespiratória, menor volume expiratório forçado a um segundo (VEF1) e transferência de gás deficiente. Aqui, picos de carga significativamente mais baixos e taxas respiratórias mais elevadas combinadas com volumes correntes mais baixos durante os picos de carga e aumento da capacidade residual podem reflectir o efeito da hiperinflação na obstrução das vias aéreas e/ou alterações na função quimiorreceptora pulmonar e indicar a presença de limitações persistentes na função das vias aéreas e uma redução na área de superfície alveolar. As alterações não fisiológicas baseadas no crescimento dos pulmões com VEF1 e VEF1/capacidade vital forçada na BPD foram confirmadas por vários estudos em crianças e jovens adultos [141–144].
O curso da doença até à idade adulta varia. Em alguns pacientes, particularmente aqueles com DPB grave, os sintomas persistem até à idade adulta [145]. Outros cursos indicam uma melhoria temporária (subjectiva) com uma posterior recorrência dos sintomas da doença que são o resultado de (mais) limitação da função pulmonar abaixo de um limiar clínico (ou individual). Esta redução pode ocorrer devido a processos de envelhecimento ou a uma desadequação emergente do rácio massa corporal e/ou gasto de energia. Enquanto um grupo relatou um curso divergente do crescimento pulmonar durante a adolescência de acordo com as medições espirométricas [141], o estudo EPICure não mostrou qualquer recuperação do crescimento pulmonar subótimo de 11-19 anos em adolescentes após o nascimento prematuro extremo, independentemente do estado da DPB, e até demonstrou uma diminuição significativa de todos os parâmetros da função pulmonar em doentes extremamente prematuros de 19 anos [144]. Entretanto, Vollsaeter e colegas relataram cursos paralelos de função pulmonar no início da idade adulta [146].
A melhor compreensão das características e efeitos do envelhecimento pulmonar prematuro após o nascimento prematuro [147,148] e para clarificar a caracterização do impacto das lesões secundárias, por exemplo do fumo, das exacerbações no contexto de infecções virais e de influências ambientais mais amplas no curso da função pulmonar. [149,150] será também crucial para o aconselhamento precoce das famílias no que diz respeito ao curso a longo prazo e o acordo sobre estratégias de controlo.
Outro campo é definido pela ocorrência de comorbidades para as quais a BPD representa um factor de risco por direito próprio [151]. Isto diz respeito às doenças neurológicas e cardiovasculares e inclui a consideração de complicações associadas à terapia. O tratamento com dexametasona, em particular, desempenha aqui um papel especial, com efeitos adversos sobre a função cardíaca, a esperança de vida e o desenvolvimento neurológico [152,153].
Resumo
A resposta do pulmão imaturo aos mecanismos de dano pré e pós-natal, manifestada por uma resposta inflamatória sustentada, uma resposta de stress oxidativo e uma sinalização alterada do factor de crescimento, levando a alterações graves no desenvolvimento alveolar e vascular, incluindo a remodelação da matriz extracelular, está associada a consequências significativas a longo prazo. As anomalias da função pulmonar (e imunidade) na infância e na primeira infância predispõem a redução da função pulmonar em sobreviventes adultos de nascimento pré-termo e alteração do processo de envelhecimento fisiológico através de um “efeito de memória” pulmonar em resposta a lesões precoces. A troca de conhecimentos interactivos entre pediatras, médicos de clínica geral e pneumologistas adultos é necessária para gerar uma melhor compreensão destes resultados a longo prazo, incluindo as características e efeitos do envelhecimento prematuro, e traduzi-los em estratégias de tratamento adaptadas e recomendações de estilo de vida para este grupo de pacientes. A interpretação dos resultados da função pulmonar deve também ter em conta a definição original subjacente à DPB e as normas aplicadas aos cuidados perinatais no contexto da idade em que a DPB foi diagnosticada.
Mensagens Take-Home
- A BPD é uma doença respiratória crónica da infância caracterizada por rarefacção alveolar, afecção de pequenas vias respiratórias e alterações vasculares pulmonares. As observações de acompanhamento da função pulmonar podem incluir a diminuição da capacidade de um segundo em crianças e adultos com um historial de BPD.
- A associação característica da alveolarização deficiente com a presença de capilares dismórficos é impulsionada pela expressão alterada de factores de crescimento angiogénicos. Algumas alterações são semelhantes às do organismo em envelhecimento e contribuem para o risco de HAP e para o desenvolvimento prejudicado do sistema linfático nos pulmões à medida que este avança.
- A BPD, como resultado da remodelação, caracteriza-se por uma disposição patológica da elastina e mudanças qualitativas e quantitativas no andaime de colagénio, que afectam a função estruturante da matriz como um andaime para a formação de novos alvéolos e capilares e definem o destino das células que povoam o órgão em desenvolvimento.
- Os primeiros danos no pulmão levam a uma resposta inflamatória persistente, a uma resposta oxidativa ao stress e a uma alteração da transdução do sinal de factores de crescimento importantes.
- A troca de conhecimentos interactivos entre pediatras, clínicos gerais e pneumologistas adultos é necessária para se conseguir uma melhor compreensão dos resultados a longo prazo, incluindo as características e os efeitos do envelhecimento prematuro.
- O impacto da doença pulmonar crónica precoce no desenvolvimento de comorbilidades precisa de ser considerado ao conceber estratégias de monitorização e tratamento e ao fazer recomendações de estilo de vida para este grupo de doentes.
Literatura:
- Jobe AH, Bancalari E: Displasia Bronchopulmonar. Am J Respir Crit Care Med 2001; 163(7): 1723-1729.
- Duijts L, van Meel ER, Moschino L, et al: European Respiratory Society guideline on long-term management of children with bronchopulmonary dysplasia. Eur Respir J 2020; 55(1).
- Doyle LW: Avaliação dos cuidados intensivos neonatais para bebés com peso extremamente baixo. Semin Fetal Neonatal Med 2006; 11(2): 139-145.
- Gortner L, Misselwitz B, Milligan D, membros do MRG, et al: Taxas de displasia broncopulmonar em neonatos muito prematuros na Europa: resultados da coorte MOSAIC. Neonatologia 2011; 99(2): 112-117.
- Stoll BJ, Hansen NI, Bell EF, Eunice Kennedy Shriver National Institute of Child H, Human Development Neonatal Research N, et al: Resultados neonatais de bebés extremamente prematuros da NICHD Neonatal Research Network. Pediatria 2010; 126(3): 443-456.
- Vachon E, Bourbonnais Y, Bingle CD, et al.: Efeito anti-inflamatório da pré-elafina na inflamação pulmonar aguda induzida por lipopolissacarídeos. Biol Chem 2002; 383(7-8): 1249-1256.
- Van Marter LJ, Pagano M, Allred EN, et al: Taxa de displasia broncopulmonar em função das práticas de cuidados intensivos neonatais. J Pediatr 1992; 120(6): 938-946.
- Ehrenkranz RA, Walsh MC, Vohr BR, National Institutes of Child H, Human Development Neonatal Research N, et al: Validation of the National Institutes of Health consensus definition of bronchopulmonary dysplasia. Pediatria 2005; 116(6): 1353-1360.
- Johnson AH, Peacock JL, Greenough A, United Kingdom Oscillation Study G, et al: High-frequency oscillatory ventilation for the prevention of chronic lung disease of prematurity. N Engl J Med 2002; 347(9): 633-642.
- Chawanpaiboon S, Vogel JP, Moller AB, et al: Estimativas globais, regionais e nacionais dos níveis de nascimento pré-termo em 2014; uma revisão sistemática e análise de modelos. Lancet Glob Health 2019; 7(1): e37-e46.
- Clyman R, Cassady G, Kirklin JK, et al: The role of patent ductus arteriosus ligation in bronchopulmonary dysplasia: reexaminando um ensaio controlado aleatório. J Pediatr 2009; 154(6): 873-876.
- Korhonen P, Tammela O, Koivisto AM, et al: Frequência e factores de risco na displasia broncopulmonar numa coorte de bebés de muito baixo peso à nascença. Early Hum Dev 1999; 54(3): 245-258.
- Kramer BW: inflamação pré-natal e lesão pulmonar: origem pré-natal da doença neonatal. J Perinatol 2008; 28 Suppl 1: S21-27.
- Mittendorf R, Covert R, Montag AG, et al: Relações especiais entre síndrome de resposta inflamatória fetal e displasia broncopulmonar em recém-nascidos. J Perinat Med 2005; 33(5): 428-434.
- Oh W, Poindexter BB, Perritt R, Neonatal Research N, et al: Associação entre a ingestão de líquidos e a perda de peso durante os primeiros dez dias de vida e o risco de displasia broncopulmonar em bebés com peso extremamente baixo ao nascer. J Pediatr 2005; 147(6): 786-790.
- Stevens TP, Harrington EW, Blennow M, Soll RF: Administração precoce de tensioactivos com breve ventilação versus tensioactivos selectivos e ventilação mecânica contínua para bebés prematuros com ou em risco de síndrome de desconforto respiratório. Cochrane Database Syst Rev 2007(4); CD003063.
- Biniwale MA, Ehrenkranz RA: O papel da nutrição na prevenção e gestão da displasia broncopulmonar. Semin Perinatol 2006; 30(4): 200-208.
- Shenai JP, Chytil F, Stahlman MT: estado de vitamina A dos recém-nascidos com displasia broncopulmonar. Pediatr Res 1985; 19(2): 185-188.
- Watterberg KL, Scott SM: Evidência de insuficiência adrenal precoce em bebés que desenvolvem displasia broncopulmonar. Pediatria 1995; 95(1): 120-125.
- Bose C, Van Marter LJ, Laughon M, Extremely Low Gestational Age Newborn Study I, et al: Fetal growth restriction and chronic lung disease among infants born before the 28th week of gestation. Pediatria 2009; 124(3): e450-458.
- Regev RH, Lusky A, Dolfin T, Israel Neonatal N, et al: Excesso de mortalidade e morbilidade entre bebés prematuros de pequena idade: um estudo baseado na população. J Pediatr 2003; 143(2): 186-191.
- Reiss I, Landmann E, Heckmann M, et al: Aumento do risco de displasia broncopulmonar e aumento da mortalidade em bebés muito prematuros por serem pequenos para a idade gestacional. Arco Gynecol Obstet 2003; 269(1): 40-44.
- Rieger-Fackeldey E, Schulze A, Pohlandt F, et al: Resultado a curto prazo em bebés com um peso à nascença inferior a 501 gramas. Acta Paediatr 2005; 94(2): 211-216.
- Walsh MC, Yao Q, Horbar JD, et al: Alterações no uso de esteróides pós-natais para displasia broncopulmonar em 3 grandes redes neonatais. Pediatria 2006; 118(5): e1328-1335.
- Rozance PJ, Seedorf GJ, Brown A, et al: A restrição do crescimento intra-uterino diminui o crescimento alveolar pulmonar e dos vasos e provoca disfunção das células endoteliais da artéria pulmonar in vitro em ovelhas fetais. Am J Physiol Lung Cell Mol Physiol 2011; 301(6): L860-871.
- Gilliland FD, Berhane K, McConnell R, et al: Fumo materno durante a gravidez, exposição ambiental ao fumo do tabaco e função pulmonar infantil. Tórax 2000; 55(4): 271-276.
- Vogt Isaksen C: Tabagismo materno, restrição do crescimento intra-uterino, e apoptose placentária. Pediatr Dev Pathol 2004; 7(5): 433-442.
- Bhandari V, Bizzarro MJ, Shetty A, Neonatal Genetics Study G, et al: Familial and genetic susceptibility to major neonatal morbidities in preterm twins. Pediatria 2006; 117(6): 1901-1906.
- Hallman M, Haataja R: Influências genéticas e doença pulmonar neonatal. Semin Neonatol 2003; 8(1): 19-27.
- Hilgendorff A, Heidinger K, Pfeiffer A, et al.: Associação de polimorfismos no gene da lectina de ligação ao manose-binding e morbilidade pulmonar em bebés prematuros. Genes Immun 2007; 8(8): 671-677.
- Poggi C, Giusti B, Vestri A, et al: Polimorfismos genéticos de enzimas antioxidantes em bebés prematuros. J Matern Fetal Neonatal Med 2012; 25 Suppl 4: 131-134.
- Binet ME, Bujold E, Lefebvre F, Canadian Neonatal N, et al: Role of gender in morbidity and mortality of extremely premature neonates. Am J Perinatol 2012; 29(3): 159-166.
- Trotter A, Maier L, Kron M, Pohlandt F: Efeito da substituição do estradiol e progesterona na displasia broncopulmonar em bebés extremamente prematuros. Arch Dis Child Fetal Neonatal Ed 2007; 92(2): F94-98.
- Vrijlandt EJ, Gerritsen J, Boezen HM, Duiverman EJ, Dutch P-CSG: Diferenças de género nos sintomas respiratórios em adultos de 19 anos nascidos antes do termo. Respir Res 2005; 6: 117.
- Wadon M, Modi N, Wong HS, et al: Avanços recentes na genética do nascimento prematuro. Ann Hum Genet 2020; 84(3): 205-213.
- Fraser J, Walls M, McGuire W: Complicações respiratórias do parto prematuro. BMJ 2004; 329(7472): 962-965.
- Wang H, St Julien KR, Stevenson DK, et al: Um estudo de associação de todo o genoma (GWAS) para a displasia broncopulmonar. Pediatria 2013; 132(2): 290-297.
- Lommatzsch ST, Aris R: Genética da fibrose cística. Semin Respir Critir Care Med 2009; 30(5): 531-538.
- Sztrymf B, Coulet F, Girerd B, et al: Resultados clínicos da hipertensão arterial pulmonar em portadores da mutação BMPR2. Am J Respir Crit Care Med 2008; 177(12): 1377-1383.
- Austin ED, Loyd JE: A genética da hipertensão arterial pulmonar. Circ Res 2014; 115(1): 189-202.
- Husain AN, Siddiqui NH, Stocker JT: Patologia do desenvolvimento de acinar preso na displasia broncopulmonar pós-surfactante. Hum Pathol 1998; 29(7): 710-717.
- Lopez E, Mathlouthi J, Lescure S, et al: Capnografia em bebés prematuros de respiração espontânea com displasia broncopulmonar. Pediatr Pulmonol 2011; 46(9): 896-902.
- Stoll BJ, Gordon T, Korones SB, et al: Early-onset sepsis in very low birth weight neonates: a report from the National Institute of Child Health and Human Development Neonatal Research Network. J Pediatr 1996; 129(1): 72-80.
- Watterberg KL, Demers LM, Scott SM, Murphy S: Chorioamnionite e inflamação pulmonar precoce em bebés em que se desenvolve a displasia broncopulmonar. Pediatria 1996; 97(2): 210-215.
- Yoon BH, Romero R, Jun JK, et al: citocinas do líquido amniótico (interleucina-6, factor de necrose tumoral alfa, interleucina-1 beta, e interleucina-8) e o risco de desenvolvimento de displasia broncopulmonar. Am J Obstet Gynecol 1997; 177(4): 825-830.
- Speer CP: Inflamação e displasia broncopulmonar: uma história contínua. Semin Fetal Neonatal Med 2006; 11(5): 354-362.
- Todd DA, Earl M, Lloyd J, Greenberg M, John E: Alterações citológicas nos aspirados endotraqueais associadas à doença pulmonar crónica. Early Hum Dev 1998; 51(1): 13-22.
- Ibrahim J, Garantziotis S, Savani R: Updates on Neonatal Chronic Lung Disease 2020, Chapter 9 – The Inflammation Superhighway: Pedágios, Sinais, e Caminhos para a Displasia Broncopulmonar. 131-150.
- Atochina-Vasserman EN, Bates SR, Zhang P, et al: A disfunção epitelial alveolar precoce promove a inflamação pulmonar num modelo de rato da síndrome de Hermansky-Pudlak. Am J Respir Crit Care Med 2011; 184(4): 449-458.
- Hilgendorff A, Parai K, Ertsey R, et al: A actividade inibidora da elastase pulmonar permite o crescimento pulmonar em ratos recém-nascidos ventilados mecanicamente. Am J Respir Crit Care Med 2011; 184(5): 537-546.
- Stoll BJ, Hansen N, Fanaroff AA, et al: Alterações nos agentes patogénicos que causam septicemia precoce em bebés de muito baixo peso. N Engl J Med 2002; 347(4): 240-247.
- Olszak T, An D, Zeissig S, et al.: A exposição microbiana durante o início da vida tem efeitos persistentes na função natural das células T assassinas. Ciência 2012; 336(6080): 489-493.
- Bose CL, Laughon MM, Allred EN, Investigators ES, et al: Inflamação sistémica associada à ventilação mecânica entre bebés extremamente prematuros. Cytokine 2013; 61(1): 315-322.
- Jobe AH, Kallapur SG: Consequências a longo prazo da oxigenoterapia no período neonatal. Semin Fetal Neonatal Med 2010; 15(4): 230-235.
- Kroon AA, Wang J, Huang Z, et al: Resposta inflamatória ao oxigénio e endotoxina em pulmões de ratos recém-nascidos ventilados com baixo volume corrente. Pediatr Res 2010; 68(1): 63-69.
- Polglase GR, Hillman NH, Ball MK, et al: Inflamação pulmonar e sistémica em cordeiros prematuros com pressão positiva contínua nas vias respiratórias ou ventilação convencional. Pediatr Res 2009; 65(1): 67-71.
- Kunzmann S, Speer CP, Jobe AH, Kramer BW: A inflamação pré-natal induziu TGF-beta1 mas suprimiu CTGF nos pulmões pré-termo. Am J Physiol Lung Cell Mol Physiol 2007; 292(1): L223-231.
- Kazzi SN, Kim UO, Quasney MW, Buhimschi I: Polimorfismo do factor alfa da necrose tumoral e risco e gravidade da displasia broncopulmonar entre bebés de muito baixo peso à nascença. Pediatria 2004; 114(2): e243-248.
- Nold MF, Mangan NE, Rudloff I, et al: O antagonista dos receptores da Interleucina-1 previne a displasia broncopulmonar murina induzida por inflamação perinatal e hiperoxia. Proc Natl Acad Sci U S A 2013; 110(35): 14384-14389.
- Ibrahim JG, Stavros; Savani, Rashmin: A Super-Estrada da Inflamação: Portagens, Sinais, e Caminhos para a Displasia Bronchopulmonar. Em: Kallapur SP, Gloria, ed. Actualizações sobre a Doença Pulmonar Crônica Neonatal. Elsevier 2020; 131-150.
- Lechner AJ, Driver IH, Lee J, et al: Monócitos Recrutados e Imunidade Tipo 2 Promover a Regeneração Pulmonar após Pneumonectomia. Cell Stem Cell 2017; 21(1): 120-134 e127.
- McQuattie-Pimentel AC, Budinger GRS, Ballinger MN: Macrófagos Alveolares Derivados de Monócitos: O Lado Negro da Reparação Pulmonar? Am J Respir Cell Mol Biol 2018; 58(1): 5-6.
- Olin A, Henckel E, Chen Y, et al: Stereotypic Immune System Development in Newborn Children. Célula 2018; 174(5): 1277-1292 e1214.
- Zaslona Z, Przybranowski S, Wilke C, et al: Os macrófagos alveolares residentes suprimem, enquanto que os monócitos recrutados promovem, inflamação pulmonar alérgica em modelos murinos de asma. J Immunol 2014; 193(8): 4245-4253.
- Yamada M, Fujino N, Ichinose M: Respostas inflamatórias no início da reparação e regeneração pulmonar: o seu papel na estimulação das células estaminais pulmonares residentes. Inflamm Regen 2016; 36: 15.
- Bose CL, Dammann CE, Laughon MM: Bronchopulmonary dysplasia e biomarcadores inflamatórios no neonato prematuro. Arch Dis Child Fetal Neonatal Ed 2008; 93(6): F455-461.
- Rose MJ, Stenger MR, Joshi MS, et al: O óxido nítrico inalado diminui o tráfico de leucócitos no pulmão neonatal do rato durante a exposição a >95% de oxigénio. Pediatr Res 2010; 67(3): 244-249.
- Vento G, Tirone C, Lulli P, et al: Bronchoalveolar lavage fluid peptidomics sugere um possível papel de matriz metaloproteinase-3 na displasia broncopulmonar. Intensive Care Med 2009; 35(12): 2115-2124.
- Watterberg KL, Carmichael DF, Gerdes JS, et al: Secretory leukocyte protease inhibitor e inflamação pulmonar no desenvolvimento de displasia broncopulmonar. J Pediatr 1994; 125(2): 264-269.
- Weinberger B, Anwar M, Henien S, et al: Associação de peroxidação lipídica com betametasona pré-natal e desordens radiais de oxigénio em bebés prematuros. Biol Neonate 2004; 85(2): 121-127.
- Collard KJ, Godeck S, Holley JE, Quinn MW: Concentrações de antioxidantes pulmonares e danos oxidativos em bebés prematuros ventilados. Arch Dis Child Fetal Neonatal Ed 2004; 89(5): F412-416.
- Filippone M, Bonetto G, Corradi M, et al: Evidência de stress oxidativo inesperado nas vias respiratórias de adolescentes nascidos muito antes do termo. Eur Respir J 2012; 40(5): 1253-1259.
- Hennessy EM, Bracewell MA, Wood N, Group EPS, et al: Saúde respiratória em crianças em idade pré-escolar e escolar após um parto extremamente prematuro. Arch Dis Child 2008; 93(12): 1037-1043.
- Merritt TA, Deming DD, Boynton BR: A ‘nova’ displasia broncopulmonar: desafios e comentários. Semin Fetal Neonatal Med 2009; 14(6): 345-357.
- Buczynski BW, Yee M, Paige Lawrence B, O’Reilly MA: O desenvolvimento pulmonar e a resposta do hospedeiro ao vírus da gripe A são alterados por diferentes doses de oxigénio neonatal em ratos. Am J Physiol Lung Cell Mol Physiol 2012; 302(10): L1078-1087.
- Belik J, Jankov RP, Pan J, Tanswell AK: A exposição crónica ao O2 aumenta a contracção vascular e a contracção muscular suave das vias respiratórias no rato recém-nascido mas não no adulto. J Appl Physiol (1985) 2003; 94(6): 2303-2312.
- Yee M, White RJ, Awad HA, Bates WA, et al: A hiperoxia neonatal causa doença vascular pulmonar e encurta a esperança de vida em ratos envelhecidos. Am J Pathol 2011; 178(6): 2601-2610.
- Balasubramaniam V, Mervis CF, Maxey AM, et al: Hiperoxia reduz a medula óssea, células progenitoras circulantes e endoteliais do pulmão em desenvolvimento: implicações para a patogénese da displasia broncopulmonar. Am J Physiol Lung Cell Mol Physiol 2007; 292(5): L1073-1084.
- Londhe VA, Sundar IK, Lopez B, et al: A hiperoxia prejudica a formação alveolar e induz a senescência através da diminuição da actividade da deacetylase histonal e do aumento da regulação da p21 no pulmão neonatal do rato. Pediatr Res 2011; 69(5 Pt 1): 371-377.
- Nanduri J, Makarenko V, Reddy VD, et al: A regulação epigenética da sensação hipóxica perturba a homeostase cardiorespiratória. Proc Natl Acad SciE U S A 2012; 109(7): 2515-2520.
- Jankov RP, Keith Tanswell A: Factores de crescimento, crescimento pulmonar pós-natal e displasia broncopulmonar. Paediatr Respir Rev 2004; 5 Suppl A: S265-275.
- Alejandre-Alcazar MA, Kwapiszewska G, Reiss I, et al: Hyperoxia modula a sinalização TGF-beta/BMP num modelo de rato de displasia broncopulmonar. Am J Physiol Lung Cell Mol Physiol 2007; 292(2): L537-549.
- Chao CM, Moiseenko A, Kosanovic D, et al: Impacto da deficiência de Fgf10 na formação da vasculatura pulmonar num modelo de displasia broncopulmonar em ratinhos. Hum Mol Genet 2019; 28(9): 1429-1444.
- Li C, Smith SM, Peinado N, et al: WNT5a-ROR Signaling Is Essential for Alveologenesis. Células 2020; 9(2).
- Oak P, Hilgendorff A: O trio de BPD? Interacção da sinalização desregulada PDGF, VEGF, e TGF na doença pulmonar crónica neonatal. Mol Cell Pediatr 2017; 4(1): 11.
- Sucre JM, Wilkinson D, Vijayaraj P, et al: Um modelo humano tridimensional da activação do fibroblasto que acompanha a displasia broncopulmonar identifica a fisiopatologia mediada por Notch. Am J Physiol Lung Cell Mol Physiol 2016; 310(10): L889-898.
- Sucre JMS, Deutsch GH, Jetter CS, et al: A Shared Pattern of beta-Catenin Activation in Bronchopulmonary Dysplasia and Idiopathic Pulmonary Fibrosis. Am J Pathol 2018; 188(4): 853-862.
- Iosef C, Alastalo TP, Hou Y, et al: Inibir a NF-kappaB no desenvolvimento pulmonar perturba a angiogénese e a alveolarização. Am J Physiol Lung Cell Mol Physiol 2012; 302(10): L1023-1036.
- Didon L, Roos AB, Elmberger GP, et al: A inactivação específica dos pulmões da proteína alfa de ligação CCAAT/enhancer causa um padrão patológico característico da DPOC. Eur Respir J 2010; 35(1): 186-197.
- Alvira CM, Abate A, Yang G, et al: activação do factor-kappaB nuclear no pulmão de rato neonatal protege contra inflamação induzida por lipopolissacarídeos. Am J Respir Crit Care Med 2007; 175(8): 805-815.
- Yang G, Abate A, George AG, et al: Diferenças maturacionais na activação da NF-kappaB pulmonar e o seu papel na tolerância à hiperoxia. J Clin Invest 2004; 114(5): 669-678.
- De Paepe ME, Greco D, Mao Q: Perfil de expressão genética relacionada com a angiogénese em pulmões humanos pré-termo ventilados. Exp Lung Res 2010; 36(7): 399-410.
- De Paepe ME, Mao Q, Powell J, et al: Crescimento da microvasculatura pulmonar em bebés prematuros ventilados. Am J Respir Crit Care Med 2006; 173(2): 204-211.
- Thebaud B: Angiogénese no desenvolvimento, lesão e reparação pulmonar: implicações para a doença pulmonar crónica da prematuridade. Neonatologia 2007; 91(4): 291-297.
- Ito Y, Betsuyaku T, Nagai K, et al.: A expressão da família VEGF pulmonar decresce com a idade e é ainda mais desregulada em lesão pulmonar induzida por lipopolissacarídeos (LPS). Exp Gerontol 2005; 40(4): 315-323.
- Vyas-Read S, Shaul PW, Yuhanna IS, Willis BC: O óxido nítrico atenua a transição epitelial-mesquelimal em células epiteliais alveolares. Am J Physiol Lung Cell Mol Physiol 2007; 293(1): L212-221.
- Bland RD, Ling CY, Albertine KH, et al: Disfunção vascular pulmonar em cordeiros prematuros com doença pulmonar crónica. Am J Physiol Lung Cell Mol Physiol 2003; 285(1): L76-85.
- Kamba T, Tam BY, Hashizume H, Haskell A, et al: plasticidade dependente de VEGF de capilares fenestrados na microvasculatura normal de adultos. Am J Physiol Heart Circ Physiol 2006; 290(2): H560-576.
- Kinsella JP, Greenough A, Abman SH: Displasia Bronchopulmonar. Lancet 2006; 367(9520): 1421-1431.
- Steinhorn RH: Hipertensão pulmonar neonatal. Pediatr Criteria Care Med 2010; 11(2 Suppl): S79-84.
- Torday JS, Rehan VK: Mechanotransduction determina a estrutura e função do pulmão e do osso: um modelo teórico para a fisiopatologia da doença crónica. Cell Biochem Biophys 2003; 37(3): 235-246.
- Mizikova I, Morty RE: A Matriz Extracelular em Displasia Bronchopulmonar: Alvo e Fonte. Front Med (Lausanne) 2015; 2: 91.
- Bruce MC, Schuyler M, Martin RJ, et al: Factores de risco para a degradação das fibras elásticas pulmonares no neonato ventilado. Implicações para o desenvolvimento pulmonar deficiente na displasia broncopulmonar. Am Rev Respir Dis 1992; 146(1): 204-212.
- Bruce MC, Wedig KE, Jentoft N, et al: Alterada excreção urinária de elastina em crianças prematuras que desenvolvem displasia broncopulmonar. Am Rev Respir Dis 1985; 131(4): 568-572.
- Merritt TA, Cochrane CG, Holcomb K, et al: Elastase e actividade inibidora de alfa 1-proteinase em aspirados traqueais durante a síndrome do desconforto respiratório. O papel da inflamação na patogénese da displasia broncopulmonar. J Clin Invest 1983; 72(2): 656-666.
- Tenholder MF, Rajagopal KR, Phillips YY, et al: Urinary desmosine excretion as a marker of lung injury in the adult respiratory distress syndrome. Peito 1991; 100(5): 1385-1390.
- Lukkarinen H, Hogmalm A, Lappalainen U, Bry K: A deficiência de Matrix metalloproteinase-9 agrava a lesão pulmonar num modelo de displasia broncopulmonar. Am J Respir Cell Mol Biol 2009; 41(1): 59-68.
- Pierce RA, Albertine KH, Starcher BC, et al: lesão pulmonar crónica em cordeiros prematuros: deposição desordenada de elastina pulmonar. Am J Physiol 1997; 272(3 Pt 1): L452-460.
- Thibeault DW, Mabry SM, Ekekezie, II, Truog WE: Maturação do tecido elástico pulmonar e perturbações durante a evolução da doença pulmonar crónica. Pediatria 2000; 106(6): 1452-1459.
- Thibeault DW, Mabry SM, et al: Andaimes de colagénio durante o desenvolvimento e a sua deformação com doença pulmonar crónica. Pediatria 2003; 111(4 Pt 1): 766-776.
- Bonvillain RW, Danchuk S, Sullivan DE, et al.: Um modelo de regeneração pulmonar de primatas não humanos: descelularização mediada por detergente e recelularização inicial in vitro com células estaminais mesenquimais. Tissue Eng Parte A 2012; 18(23-24): 2437-2452.
- Jensen T, Roszell B, Zang F, et al.: Um protocolo de rápida descelularização pulmonar apoia a diferenciação de células estaminais embrionárias in vitro e após a implantação. Tissue Eng Parte C Métodos 2012; 18(8): 632-646.
- Förster K, Ertl-Wagner B, Ehrhardt H, et al: Os tempos de relaxamento alterados na RM indicam displasia broncopulmonar. Thorax 2019; thoraxjnl-2018-212384.
- Oda K, Ishimoto H, Yatera K, et al: A escala de classificação baseada no sistema de pontuação CT de alta resolução prevê os resultados clínicos em pacientes com fibrose pulmonar idiopática. Respir Res 2014; 15: 10.
- Walkup LL, Tkach JA, Higano NS, et al: Ressonância Magnética Quantitativa de Displasia Broncopulmonar no Ambiente da Unidade de Cuidados Intensivos Neonatais. Am J Respir Crit Care Med 2015; 192(10): 1215-1222.
- Washko GR: Diagnóstico por imagem no COPD. Semin Respir Criteria Care Med 2010; 31(3): 276-285.
- Weatherley ND, Eaden JA, Stewart NJ, et al: Técnicas de imagiologia experimental e quantitativa na doença pulmonar intersticial. Tórax 2019; 74(6): 611-619.
- Capaldi DP, Zha N, Guo F, et al: Pulmonary Imaging Biomarkers of Gas Trapping and Emphysema in COPD: (3)He MR Imaging and CT Parametric Response Maps. Radiologia 2016; 279(2): 597-608.
- De Boeck K, Derichs N, Fajac I, Grupo EDNW, EuroCare CFWPGoCFd, et al: Novos procedimentos de diagnóstico clínico para fibrose cística na Europa. J Cyst Fibros 2011; 10 Suppl 2: S53-66.
- Sileo C, Corvol H, Boelle PY, et al: HRCT e MRI do pulmão em crianças com fibrose cística: comparação de diferentes sistemas de pontuação. J Cyst Fibros 2014; 13(2): 198-204.
- Tulek B, Kivrak AS, Ozbek S, et al: Fenotipagem de doença pulmonar obstrutiva crónica usando o sistema de pontuação Bhalla modificado para tomografia computorizada de alta resolução. Can Respir J 2013; 20(2): 91-96.
- Jobe AH, Ikegami M: Prevenção da displasia broncopulmonar. Curr Opinião Pediatr 2001; 13(2): 124-129.
- Newman JB, DeBastos AG, Batton D, Raz S: Disfunção respiratória neonatal e desempenho neuropsicológico na idade pré-escolar: um estudo de bebés muito prematuros com displasia broncopulmonar. Neuropsicologia 2011; 25(5): 666-678.
- Bolton CE, Bush A: Vindo agora para uma clínica de tórax perto de si. Tórax 2013; 68(8): 707-708.
- Bolton CE, Bush A, Hurst JR, et al: Consequências pulmonares em adultos nascidos prematuramente. Tórax 2015; 70(6): 574-580.
- Maio C, Kennedy C, Milner AD, et al: Anomalias da função pulmonar em bebés que desenvolvem displasia broncopulmonar. Arch Dis Child 2011; 96(11): 1014-1019.
- Miller MR, Pedersen OF, Lange P, Vestbo J: Melhoria da previsão de sobrevivência a partir de dados da função pulmonar numa grande amostra populacional. Respir Med 2009; 103(3): 442-448.
- Hilgendorff A, Reiss I, Gortner L, et al: Impacto da obstrução das vias aéreas na função pulmonar em bebés muito prematuros a termo. Pediatr Criteria Care Med 2008; 9(6): 629-635.
- Greenough A, Alexander J, Burgess S, et al: Utilização de cuidados de saúde pré-escolares relacionados com o estado do oxigénio doméstico. Arch Dis Child Fetal Neonatal Ed 2006; 91(5): F337-341.
- Greenough A, Alexander J, Burgess S, et al: Estado do oxigénio doméstico e re-hospitalização e requisitos de cuidados primários de bebés com doença pulmonar crónica. Arch Dis Child 2002; 86(1): 40-43.
- Doyle LW, Cheung MM, Ford GW, et al: Peso de nascimento <1501 g e saúde respiratória aos 14 anos. Arch Dis Child 2001; 84(1): 40-44.
- Greenough A, Cox S, Alexander J, et al: Utilização de cuidados de saúde de bebés com doença pulmonar crónica, relacionados com a hospitalização por infecção por RSV. Arch Dis Child 2001; 85(6): 463-468.
- Broughton S, Roberts A, Fox G, et al: Estudo prospectivo da utilização de cuidados de saúde e morbilidade respiratória devido a infecção por RSV em bebés nascidos prematuros. Tórax 2005; 60(12): 1039-1044.
- Baraldi E, Carraro S, Filippone M: Displasia Broncopulmonar: definições e resultado respiratório a longo prazo. Early Hum Dev 2009; 85(10 Suppl): 1-3.
- Greenough A, Limb E, Marston L, et al: Factores de risco de morbilidade respiratória na infância após parto muito prematuro. Arch Dis Child Fetal Neonatal Ed 2005; 90(4): F320-323.
- Gross SJ, Iannuzzi DM, Kveselis DA, Anbar RD: Efeito do nascimento prematuro na função pulmonar em idade escolar: um estudo prospectivo controlado. J Pediatr 1998; 133(2): 188-192.
- Broughton S, Thomas MR, Marston L, et al: Bebés nascidos muito prematuramente a sibilar no seguimento: função pulmonar e factores de risco. Arch Dis Child 2007; 92(9): 776-780.
- Pelkonen AS, Hakulinen AL, Turpeinen M: Capacidade brônquica e de resposta em crianças nascidas muito prematuras na escola. Am J Respir Crit Care Med 1997; 156(4 Pt 1): 1178-1184.
- Yuksel B, Greenough A: Relação dos sintomas com anomalias da função pulmonar em bebés prematuros no acompanhamento. Pediatr Pulmonol 1991; 11(3): 202-206.
- Welsh L, Kirkby J, Lum S, Odendaal D, Group EPS, et al: The EPICure study: maximal exercise and physical activity in school children born extremely preterm. Tórax 2010; 65(2): 165-172.
- Doyle LW, Faber B, Callanan C, et al: Displasia broncopulmonar em sujeitos de muito baixo peso à nascença e função pulmonar no final da adolescência. Pediatria 2006; 118(1): 108-113.
- Greenough A, Dimitriou G, Bhat RY, et al: Volumes pulmonares em bebés que tiveram displasia broncopulmonar ligeira a moderada. Eur J Pediatr 2005; 164(9): 583-586.
- Hjalmarson O, Sandberg KL: A função pulmonar a termo reflecte a gravidade da displasia broncopulmonar. J Pediatr 2005; 146(1): 86-90.
- Hurst JR, Beckmann J, Ni Y, et al: Respiratory and Cardiovascular Outcomes in Survivors of Extremely Preterm Birth at 19 Years. Am J Respir Crit Care Med 2020; 202(3): 422-432.
- Northway WH, Jr, Moss RB, Carlisle KB, et al: Sequelas pulmonares tardias de displasia broncopulmonar. N Engl J Med 1990; 323(26): 1793-1799.
- Vollsaeter M, Roksund OD, Eide GE, et al: Função pulmonar após o nascimento prematuro: desenvolvimento desde a meia infância até à idade adulta. Tórax 2013; 68(8): 767-776.
- Bolton CE, Bush A, Hurst JR, et al: Os factores de vida precoce são considerados na gestão de doenças respiratórias? Um inquérito da British Thoracic Society sobre a prática actual. Tórax 2012; 67(12): 1110.
- Crump C: O historial médico que se faz em adultos deve incluir perguntas sobre o parto prematuro. BMJ 2014; 349: g4860.
- Baraldi E, Filippone M: Doença pulmonar crónica após nascimento prematuro. N Engl J Med 2007; 357(19): 1946-1955.
- Filippone M, Carraro S, Baraldi E: De BPD para COPD? A hipótese é intrigante, mas faltam-nos dados de patologia pulmonar nos seres humanos. Eur Respir J 2010; 35(6): 1419-1420; resposta do autor 1420.
- Anderson PJ, Doyle LW: Resultado neurodesenvolvido da displasia broncopulmonar. Semin Perinatol 2006; 30(4): 227-232.
- Bal MP, de Vries WB, van Oosterhout MF, et al: Long-term cardiovascular effects of neonatal dexamethasone treatment: hemodynamic follow-up by left ventricular pressure-volume loops in rats. J Appl Physiol (1985) 2008; 104(2): 446-450.
- Kamphuis PJ, de Vries WB, Bakker JM, et al: Redução da esperança de vida em ratos após tratamento neonatal com dexametasona. Pediatr Res 2007; 61(1): 72-76.
InFo PNEUMOLOGIA & ALERGOLOGIA 2021; 3(2): 10-15