As infecções agudas activam vários mecanismos inflamatórios e procoagulatórios e são consideradas factores de risco transitórios de tromboembolismo venoso (VTE). As infecções que não estão associadas ao confinamento e hospitalização também aumentam o risco de TEV. A estrutura causa-efeito é complexa. Para avaliar o risco de trombose em pacientes com infecções, pode-se usar as “bandeiras vermelhas” como guia. No que diz respeito a doentes infectados com fibrilação atrial, a anticoagulação é indicada se não houver uma tendência específica de hemorragia.
Segundo os conhecimentos actuais, as infecções estão associadas a um aumento de risco comparável ao dos factores de risco tradicionais, que se sabe incluírem operações importantes nos últimos três meses, imobilização com duração mínima de três dias, ou uma doença tumoral activa nos últimos seis meses, explica o Prof. Philip Tarr, MD, Kantonsspital Baselland, Bruderholz [1]. Embora as infecções ainda não estejam incluídas nos escores de diagnóstico para determinar a probabilidade clínica pré-teste, a sua associação com tromboembolismo venoso (TEV) está bem documentada na literatura [1].
Aumento do risco de TEV após infecções respiratórias ou do tracto urinário
Os doentes hospitalizados com uma infecção têm aproximadamente o dobro do risco de TEV do que os doentes hospitalizados sem uma infecção [1]. Mesmo as infecções banais sem internamento e hospitalização aumentam o risco de TEV, por exemplo infecções respiratórias e infecções do tracto urinário, que afectam várias centenas de milhares de pessoas na Suíça todos os anos. “O risco de tromboembolismo é mais elevado nas primeiras 1-2 semanas após uma infecção, mas – e isto é excitante – o risco aumentado de trombose persiste durante vários meses, até meio ano após uma infecção – pelo menos estatisticamente”, disse o orador. Pensa-se que o risco de TEV aumente de 2 a 5 vezes, durante cerca de 2 a 4 semanas, após uma simples infecção respiratória ou do tracto urinário [1,6]. Embora este risco diminua com o tempo, permanece elevado durante 6-12 meses após a infecção, tanto em doentes hospitalizados como não hospitalizados, segundo análises científicas (Tab. 1) [1].
Reconhecer sinais de alerta: que doentes infecciosos estão particularmente em risco?
Uma associação entre inflamação e a tendência para trombose parece plausível, mas o papel do PRC ainda não foi completamente esclarecido (caixa) [2]. Em relação ao D-dímero, o Prof. Tarr aconselha contra a determinação rotineira, com base no facto de haver frequentemente uma elevação. No entanto, um D-dímero normal é um bom argumento contra o DVT/LE [1]. O orador resumiu da seguinte forma as “bandeiras vermelhas” relativamente à trombose venosa profunda / embolia pulmonar em doentes infecciosos [1]:
- Dispneia / dor torácica
- Extremidade da diferença circunferencial (também braço com cateter venoso central, porto, linha picc)
- Se o curso clínico estiver mais de acordo com a DVT/LE e não com a infecção (suspeita)
- Se a febre não baixar, apesar de uma terapia antibiótica adequada
- Em caso de febre sem uma causa identificável
- Erysipelas: a TVP está presente em 2-3% dos casos.
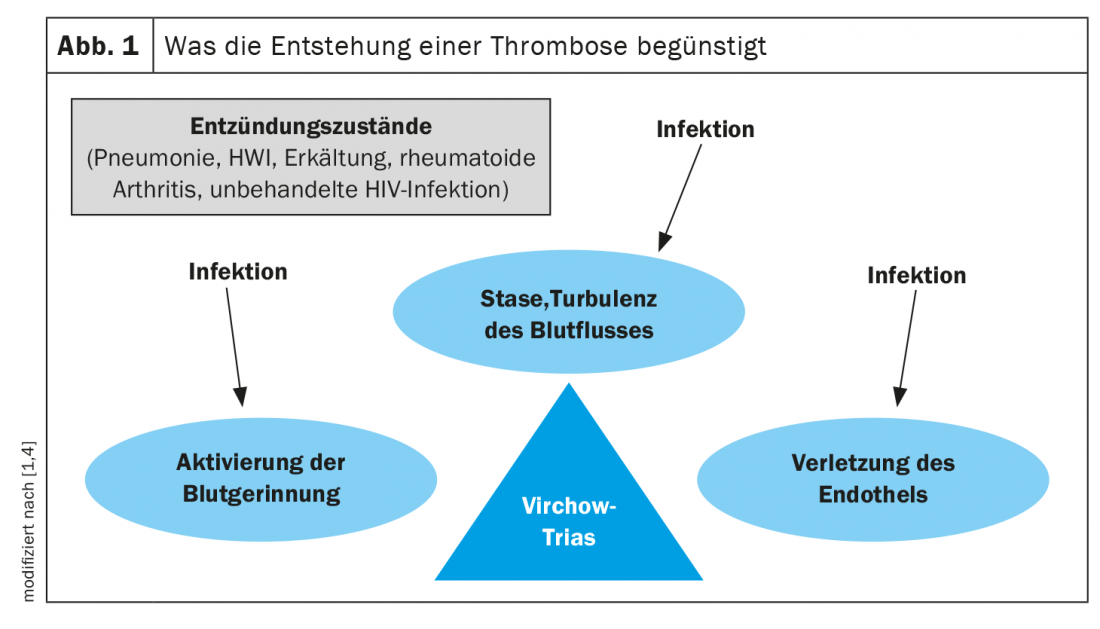
Pathomechanisms: Tríade Virchow
A relação causa-efeito entre infecção e trombose é extremamente complexa. É sabido que a infecção aguda activa vários mecanismos inflamatórios e procoagulatórios [1–3]. A famosa tríade de Rudolf Virchow afirma que a trombose é promovida por três factores: Activação da coagulação sanguínea (hipercoagulabilidade), estase venosa e lesão endotelial (Fig. 1) [1,2,4]. Estes mecanismos são influenciados por infecções. Assim, um estado inflamatório activa várias proteínas de fase aguda da cascata de coagulação, que têm um efeito procoagulador e aumentam assim o risco de trombose. Estes incluem, por exemplo, CRP, fibrinogénio, factor VIII, interleucina-6 e factor von Willebrand (vWF) [1,2]. Não se compreende completamente se a inflamação relacionada com infecções, local ou sistémica desempenha o papel fundamental e se bactérias específicas (por exemplo, S. aureus ou varas gram-negativas) aumentam particularmente o risco de VTE [2,5]. Os anticorpos antifosfolípidos (aPL), que raramente são desencadeados por infecções e mais frequentemente por doenças auto-imunes como o lúpus eritematoso, estão também associados à ocorrência de tromboses e são um desencadeador da chamada síndrome dos antifosfolípidos (SAF) [2]. Além disso, certas toxinas bacterianas e infecções virais como o SARS-CoV-2, citomegalovírus ou o vírus Epstein-Barr podem danificar o endotélio [2]. Os factores de risco de VTE, tais como imobilização, idade, doença tumoral ou imunossupressão, aumentam ainda mais o risco de infecção [2].
Anticoagulação em doentes infecciosos com fibrilação atrial
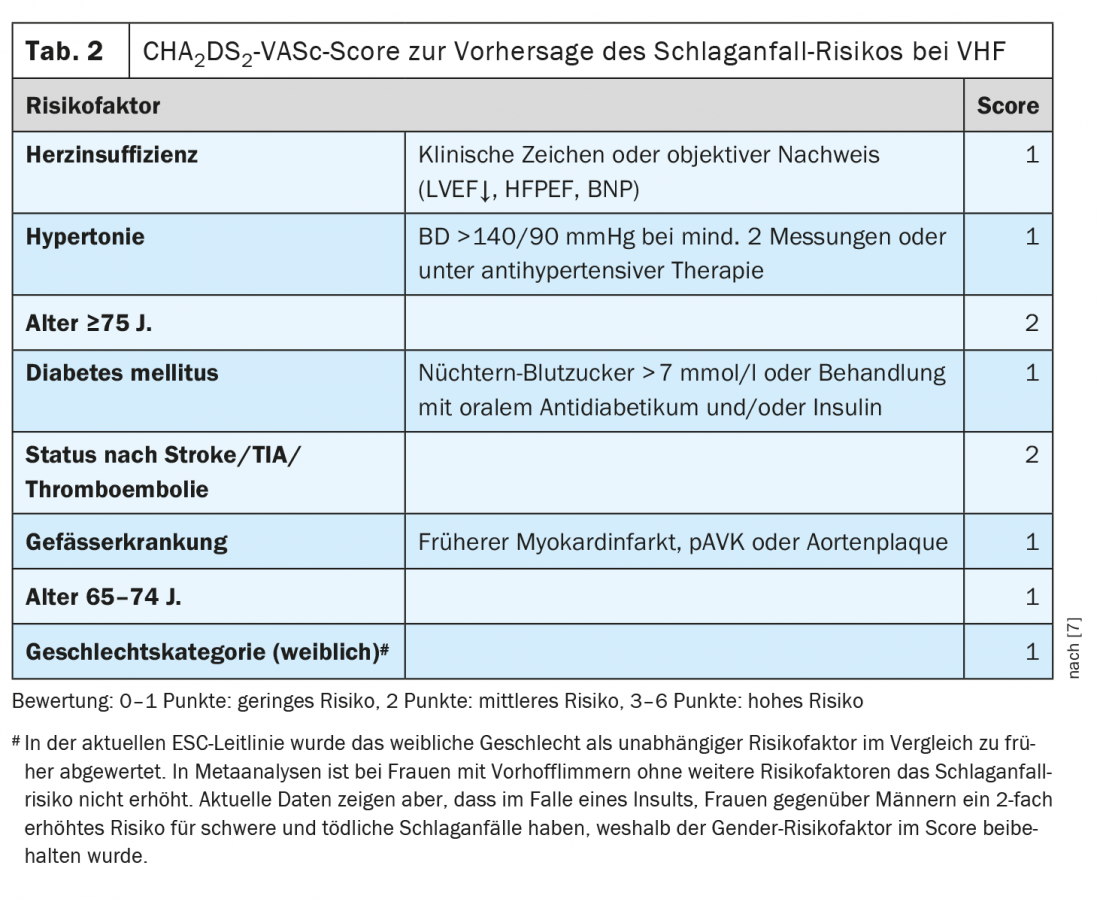
“A pneumonia está associada a um evento cardiovascular em cerca de 1 em cada 5 pacientes”, sublinha o orador [1]. Esta pode ser uma síndrome coronária (aguda) ou um ataque cardíaco, mas também pode ocorrer uma arritmia (especialmente fibrilação atrial) ou uma descompensação na insuficiência cardíaca conhecida. “A pneumonia leva a mecanismos pró-coagulatórios que são activados pela inflamação”, explica o Prof. Tarr [1]. Os eventos cardiovasculares na pneumonia são frequentemente perdidos e estão associados ao aumento da mortalidade. O risco de síndrome coronária aguda (SCA) aumenta proporcionalmente com o aumento da gravidade da pneumonia, mas também aumenta com um ligeiro curso de pneumonia ao longo de várias semanas a meses. A associação com ACS está documentada não só para a pneumonia, mas também para a gripe, infecções do tracto urinário e bacteriemia. As infecções também podem desencadear fibrilação atrial. Isto aumenta o risco de golpes embólicos. Isto tem implicações terapêuticas. “Se um paciente entra em fibrilação atrial no contexto de uma pneumonia: será esta agora provocada fibrilação atrial que só precisa de ser anticoagulada por um curto período de tempo?”. Da perspectiva de hoje, a resposta é “infelizmente não”, diz o Prof. “Devemos ignorar a infecção como o desencadeador da fibrilação atrial”, acrescenta o conferencista e acrescenta: “O facto de a fibrilação atrial ter ocorrido devido a um desencadeador infeccioso indica que o átrio está doente/dilatado. No contexto da infecção, inflamação e deslocamentos electrolíticos, pode ocorrer uma actividade parassimpática ou simpática alterada, o que acabou por desencadear a fibrilação atrial” [1]. Dependendo da pontuação CHA2DS2-VASc, as directrizes ESC e AHA recomendam a anticoagulação vitalícia se ocorrer fibrilação atrial (tab. 2) [1,7–9]. Aparentemente, há uma predisposição para a fibrilação atrial e, de acordo com os conhecimentos actuais, o risco de embolia em fibrilação atrial paroxística provocada por enfarte é comparável ao da fibrilação atrial permanente [1].
Fonte: Congresso Médico Davos
Literatura:
- Tarr P: Infecção e trombose: Folie à deux. Prof. Philip Tarr, MD. Congresso Médico Davos, 10-11.02.2022
- Pfister T, et al: Infecção e trombose, parte 1: Antecedentes. Prim Hosp Care Allg Inn Med 2021; 21(04): 125-130.
- Riva N, Donadini MP, Ageno W: Epidemiologia e fisiopatologia do tromboembolismo venoso: semelhanças com a aterotrombose e o papel da inflamação. Thromb Haemost 2015; 113(6): 1176-1183.
- Bagot CN, Arya R: Virchow e a sua tríade: uma questão de atribuição. British Journal of Haematology 2008; 143(2): 180-190.
- White RH: Identificação de Factores de Risco para o Tromboembolismo Venoso. Circulação 2012; 125(17): 2051-2053.
- Smeeth L, et al: Risco de trombose venosa profunda e embolia pulmonar após infecção aguda num ambiente comunitário. Lancet 2006; 367(9516): 1075-1079.
- Rosemann A: Fibrilação atrial, 11/2018, www.medix.ch/media/gl_vorhofflimmern_2018_31.10.19_mh.pdf, (último acesso 28.03.2022).
- Kirchhof P, et al: European Heart Journal. 2016 Oct 7;37(38): 2893-2962.
- Janeiro CT, et al: Circulation 2019 Jul 9; 140(2).
HAUSARZT PRAXIS 2022; 17(4): 36-37 (publicado 6.4.22, antes da impressão).