O rastreio tumoral apenas com marcadores tumorais não é útil, excepto para o cancro de PSA/prostate. O rastreio do cancro da próstata deve ser discutido individualmente com o doente. Os marcadores tumorais podem complementar o padrão no diagnóstico inicial de um tumor, no acompanhamento terapêutico e nos cuidados de seguimento.
Os marcadores tumorais séricos ou marcadores tumorais sistémicos (doravante designados por marcadores tumorais) são formados e secretados em células tumorais malignas. Os marcadores tumorais podem ser detectados no sangue periférico. Os marcadores bioquímicos comuns são moléculas específicas de tumores, tais como enzimas, hormonas, factores de crescimento ou metabolitos. Com base na sua especificidade e sensibilidade, os marcadores tumorais são utilizados para rastreio, diagnóstico, monitorização da terapia tumoral ou em cuidados de seguimento. Alguns marcadores tumorais ganharam assim um lugar firme na prática clínica diária, embora as indicações se refiram a um grupo relativamente pequeno de pacientes com tumores. Os autores deste artigo são de opinião que actualmente são efectuadas demasiadas determinações de marcadores tumorais, o que, em certos casos, também pode levar à ansiedade e incerteza entre os doentes. Este artigo visa fornecer uma breve visão geral da utilização recomendada de marcadores tumorais.
Marcadores tumorais para tumores de células germinativas
Os tumores de células germinativas (CST) incluem teratoma, disgerminoma, tumores do saco vitelino e carcinoma coriónico em mulheres, e seminoma e CST não sinomatoso (tumor do saco vitelino, carcinoma coriónico, carcinoma embrionário, teratoma) em homens. Nestes tumores, a alfafetoproteína (AFP), β-gonadotropina coriónica humana (β-HCG) e a desidrogenase láctica (LDH) têm significado como marcadores de tumores.
Alphafetoproteína (AFP)
A AFP é produzida no saco vitelino fetal, fígado fetal e intestino fetal. O espelho atinge o seu auge durante a 12ª-14ª semana. Atinge o auge na primeira semana de gravidez e depois cai linearmente. Com a idade de um ano, a AFP caiu para níveis baixos. A AFP pode ser detectada em carcinomas embrionários ou teratomas (20-25%), em CCT não sinomatosos (60%) e em carcinoma hepatocelular (41-65%) [1]. Os carcinomas coriónicos puros e os seminomas puros não produzem AFP. Se a AFP é elevada em seminomas e carcinomas coriónicos puros, esta é uma indicação importante de tumores mistos.
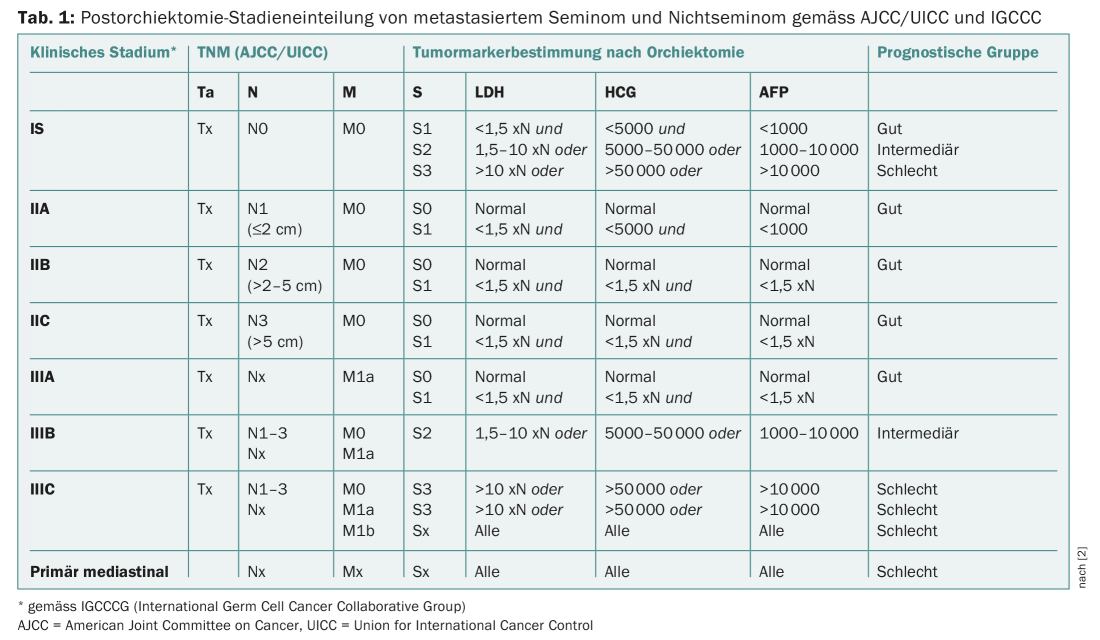
APF, β-HCG e LDH fazem parte da classificação diagnóstica e prognóstica da CCT (Tab. 1) . Falsos valores positivos podem ocorrer em hepatopatias (cirrose, hepatite), no abuso de drogas e álcool e raramente como uma forma idiopática familiar. A meia-vida da AFP é de cinco a sete dias. Após tratamento eficaz, os níveis de AFP devem normalizar de acordo com estas cinéticas. Um nível elevado de AFP (>10,000 ng/ml) está associado a um mau prognóstico em seminoma e CCT não sinomatoso [2]. A AFP e β-HCG também têm valor diagnóstico no seguimento de tumores.
β-gonadotropina coriónica humana (β-HCG)
β-HCG está significativamente elevado em carcinomas não femininos ou coriónicos e apenas moderadamente elevado em carcinomas de células embrionárias ou CCT mistos. Elevações de β-HCG são também observadas em toupeiras da bexiga e tumores trofoblásticos da placenta. A meia-vida do soro de β-HCG é de 24-36 horas. As concentrações plasmáticas de β-HCG normalizam após orquiectomia de acordo com estas cinéticas ou persistem em doenças tumorais residuais [3].
Falsos valores positivos β-HCG ocorrem em hipogonadismo, síndrome de lise tumoral, anticorpos heterofílicos, uso de marijuana e gravidez. No seminoma da fase I, β-HCG é elevado em 10-20% dos pacientes, e no seminoma disseminado (secundário à presença de fracções de trofoblasto sincítico) em 30-50% dos pacientes (raramente >500 mIU/ml). Na toupeira, os níveis sistémicos β-HCG excedem tipicamente 100.000 mIU/ml e são mesmo superiores aos da gravidez. Os tumores trofoblásticos placentários mostram uma baixa elevação β-HCG, enquanto que os tumores trofoblásticos epithelioides mostram uma baixa ou mesmo ausente expressão β-HCG.
Lactato desidrogenase (LDH)
O LDH é um marcador de tumores menos sensível e menos específico em pacientes com CCT não sinomatosos. O LDH é elevado em 40-60% dos homens com CCT testicular. O grau de elevação do LDH tem valor prognóstico em homens com CCT avançado.
Aplicação clínica da AFP, β-HCG e LDH
Os níveis séricos de AFP, β-HCG e LDH são determinados para uma correcta encenação no diagnóstico inicial de CCT. Uma determinação adicional destes marcadores tumorais é efectuada após a orquiectomia, seguida de controlos semanais até à normalização completa dos marcadores tumorais inicialmente elevados. Após a orquiectomia, os três marcadores tumorais são utilizados para estratificação de risco (tab. 1). Os homens com CCT nãoeminomatosos e AFP persistentemente elevado ou β-HCG após a orquiectomia devem ser considerados como tendo uma fase de tumor metastático. Após a conclusão da terapia primária, os marcadores tumorais (β-HCG, AFP e LDH) são utilizados como um suplemento para o seguimento radiológico. Dependendo da histologia, fase e terapia anterior, o algoritmo prevê verificações trimestrais até ao terceiro ano, seguidas de verificações semestrais até ao quinto ano e verificações anuais até ao décimo ano [4]. Num estudo retrospectivo mais antigo, foram examinados 125 pacientes com CCT recorrentes. Um aumento dos marcadores tumorais foi o indicador mais precoce de recorrência em não-seminomas (35/87 pacientes = 40%). Em seminoma, a imagiologia foi o primeiro indicador de recorrência (9/36 pacientes = 42%) [5].
PSA como um marcador tumoral no cancro da próstata
O PSA (antigénio específico da próstata) é produzido nas células glandulares da próstata como uma pró-enzima (proPSA). O proPSA é convertido no PSA activo por proteólise. O PSA activo ou é proteolizado e passa para a corrente sanguínea de forma não limitada (PSA livre), ou é rapidamente ligado como PSA não proteolizado a inibidores de protease, tais como α1-antichimotripsina ou α2-macroglobulina. Os PSA livres e vinculados são determinados em conjunto como PSA total. A meia-vida do PSA é de dois a três dias.
Rastreio de PSA na prática
Não é recomendado o rastreio geral do PSA. O rastreio selectivo de PSA após uma educação detalhada dos pacientes pode ser considerado, especialmente em pacientes de alto risco que têm um risco significativamente maior de desenvolver cancro da próstata biologicamente relevante:
- Homens de etnia africana
- Homens com um pai ou irmão com cancro da próstata
- Pacientes com mutações na linha germinal do BRCA 1 ou BRCA 2
- Homens com síndrome de Lynch (cancro do cólon hereditário não-polipose).
O rastreio de PSA começa com uma determinação inicial de PSA aos 50 anos de idade (45 anos para doentes de alto risco) e é normalmente combinado com um exame digital-rectal. Um único valor elevado de PSA deve ser repetido. Várias influências no valor do PSA são significativas: aumento fisiológico com maior idade, diferenças étnicas e efeito dos fármacos (aumento com esteróides anabolizantes, diminuição até 50% com inibidores de redutase em α1). Homens assintomáticos com mais de 70 anos de idade não devem receber o rastreio PSA [6].
Como orientação, para o rastreio do cancro da próstata e um PSA <1 ng/ml, pode ser feito um próximo controlo após três anos, para o PSA de 1 a <2 ng/ml após dois anos e para o PSA de 2 a <3 ng/ml após um ano [7]. Falsos níveis elevados de PSA também podem ocorrer em doentes com hiperplasia benigna da próstata e prostatites inflamatórias ou infecciosas. A palpação digital-rectal ou a ciclagem prolongada também pode causar um aumento do PSA, pelo que o nível de PSA deve ser determinado de antemão. Após a ejaculação, o nível de PSA pode ser elevado em 0,4-0,5 ng/ml durante dois a três dias.
Foram recentemente publicadas propostas alternativas para uma análise mais ampla dos PSA. A importância prognóstica a longo prazo do PSA é interessante. Foi demonstrado que homens de 60 anos com PSA >2 ng/ml têm um risco significativamente maior de morrer de cancro da próstata [8]. Os doentes com um PSA >100 ng/ml no momento do diagnóstico reduziram significativamente a sobrevivência global. Alguns homens com carcinomas da próstata agressivos (neuroendócrinos, indiferenciados) têm um PSA baixo como sinal de baixa diferenciação das células tumorais. A baixa sensibilidade do PSA é problemática: atinge 20% com um corte do PSA de 4,0 ng/ml e um risco médio de doença resp. 50% para doentes em risco. Isto pode levar a um número significativo de biópsias negativas com a correspondente incerteza do paciente. As biopsias da próstata também comportam o risco de complicações como febre, arrepios, dor, hematúria, hematochezia (sangue fresco nas fezes) e ejaculação sanguinolenta.
Estudos de rastreio de PSA
O benefício clínico do rastreio do PSA foi investigado em dois grandes ensaios aleatórios (ERSPC = European Randomized Study for Screening for Prostate Cancer [9] e PLCO = Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial [10]), ambos com o ponto final da mortalidade específica do cancro da próstata.
No estudo ERSPC, 162 243 homens entre 55-69 anos de idade foram aleatorizados num grupo com determinação de PSA de quatro em quatro anos ou no grupo de controlo sem triagem de PSA. Após um seguimento médio de nove anos, a incidência acumulada de cancro da próstata foi de 8,2% no grupo de rastreio e 4,8% no grupo de controlo. A proporção de mortes devidas ao carcinoma da próstata foi de 0,8 (grupo de rastreio/grupo de controlo do PSA) (Fig. 1) . Isto resulta numa mortalidade 20% menor no grupo de rastreio, mas com um maior risco de sobre-diagnóstico. Os dados após onze anos de acompanhamento mostraram que, para evitar uma morte, 1055 homens tiveram de ser rastreados e 37 cancros da próstata diagnosticados [9].
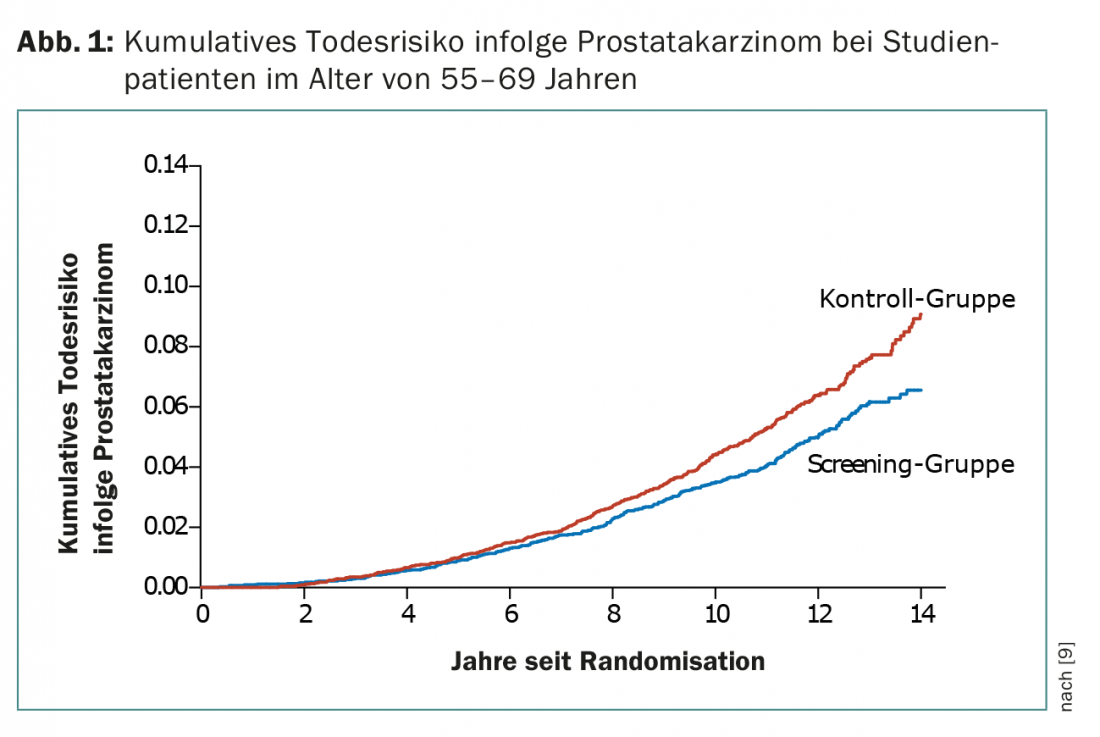
No estudo PLCO, 76.693 homens foram afectados quer ao grupo de rastreio (PSA anual durante seis anos e exame digital rectal anual durante quatro anos) quer ao grupo de controlo. Não foi demonstrada qualquer redução na mortalidade no grupo de rastreio [10]. Após sete anos de seguimento, a incidência de cancro da próstata por 10.000 pessoas-anos foi de 116 (2820 tumores) no grupo de rastreio e 95 (2322 tumores) no grupo de controlo (RR 1,22). A incidência de mortes por 10.000 pessoas-ano foi de 2,0 (50 mortes) no grupo de rastreio e 1,7 (44 mortes) no grupo de controlo (rácio 1:1,13) [10].
A capacidade de avaliação dos grandes estudos de rastreio do PSA é limitada, entre outras coisas, pela “contaminação” (rastreio do PSA no braço de controlo) e pelo facto de alguns dos sujeitos já terem sido submetidos ao controlo do PSA antes do início do estudo. Com base nos dados apresentados, não é actualmente recomendado o rastreio não seleccionado do PSA.
Diagnósticos adicionais para valores elevados de PSA
Um desafio de diagnóstico particular são os valores PSA na gama de 2,5-10 ng/ml, que já podem representar um valor patológico dependendo da idade e do volume da próstata. Aqui, os chamados “derivados de PSA” podem ter um benefício de diagnóstico adicional:
- Rácio PSA: proporção de PSA livre para PSA total
- Densidade do PSA: volume da próstata dividido pelo PSA total
- Velocidade do PSA: o PSA aumenta ao longo do tempo.
Um aumento anual do PSA >0,75 ng/ml é suspeito para a presença de carcinoma da próstata. O rácio PSA melhora a sensibilidade do diagnóstico de carcinoma da próstata quando o valor total de PSA se situa num intervalo entre 4-10 ng/ml. Um baixo rácio de PSA indica a presença de um carcinoma da próstata [11], pelo que não foi utilizado um corte uniforme (10-25%). No caso de PSA anormal e/ou achados patológicos digitais-retais, deve ser considerada uma ressonância magnética da próstata, o que permite a realização de uma biopsia direccionada se a patologia for apropriada.
Controlo de PSA após prostatectomia
Os pacientes que foram submetidos a prostatectomia radical têm uma recorrência bioquímica se o nível sérico de PSA exceder 0,2 ng/ml duas vezes. A radioterapia de resgate deve ser administrada precocemente (PSA <0.5 ng/ml) [12]. Recidiva bioquímica após radioterapia com ou sem terapia hormonal ocorre quando o nível de PSA >2 ng/ml sobe acima do nadir [13,14].
Monitorização terapêutica por meio de PSA
O cancro da próstata resistente à castração está presente em doentes que experimentam a progressão da doença em terapia de privação de androgénio, definida como um aumento sequencial do PSA de ≥2 ng/ml sobre nadir dentro de pelo menos uma semana. Testosterona deve ser adequadamente suprimida, definida como testosterona sérica <50 ng/l (1,7 nmol/l). Após o início da terapia, os valores de PSA devem ser determinados novamente após doze semanas, no mínimo (caveat “PSA flair”); no caso de um aumento de PSA, isto deve ser confirmado por meio de uma segunda determinação de PSA após ≥3 semanas [15].
Outros marcadores tumorais
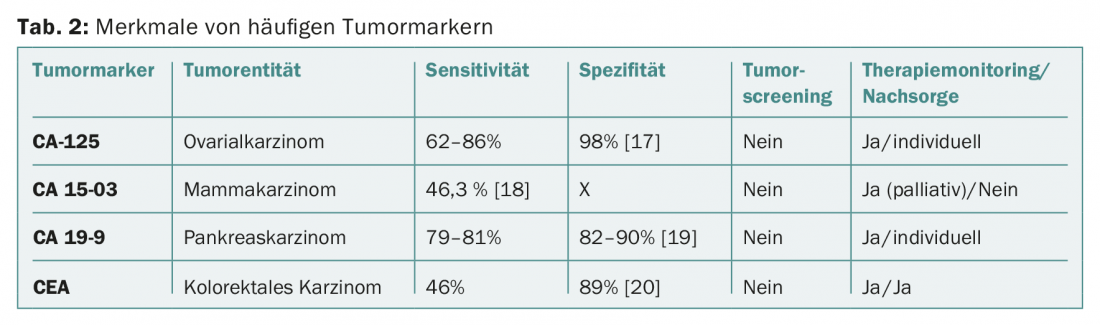
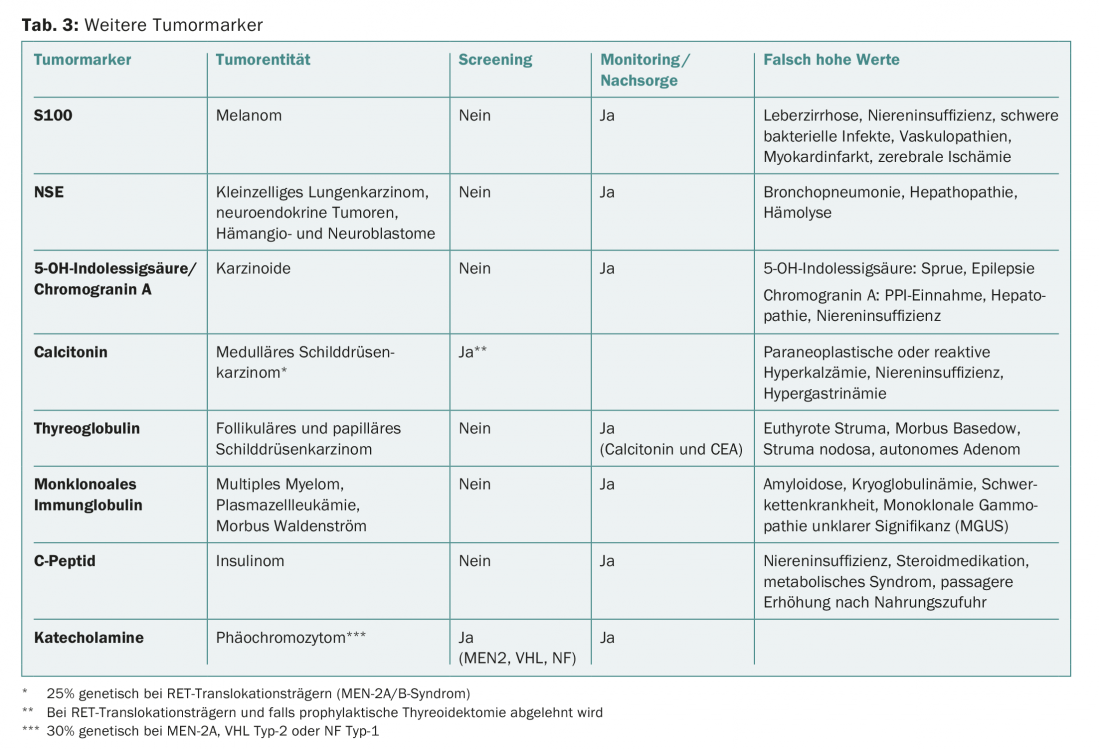
Os marcadores tumorais são mais comummente utilizados para monitorização terapêutica. A especificidade e sensibilidade da maioria dos marcadores tumorais de soro são demasiado baixas para serem aplicadas de forma útil no diagnóstico ou rastreio de tumores (Tab. 2). As excepções são as conhecidas síndromes de tumores familiares como a síndrome de Von Hippel-Lindau (BVS) ou a neoplasia endócrina múltipla (MEN) (Tab. 3).
O CEA é um marcador relativamente pouco específico, mas tem um lugar fixo no seguimento de tumores para carcinomas cólon ou rectal tratados curativamente (determinação de três em três meses no primeiro ano, de seis em seis meses no segundo e terceiro anos, anualmente no quarto e quinto anos).
O CA-125 é frequentemente utilizado na monitorização terapêutica e no acompanhamento do cancro dos ovários. No entanto, a recorrência bioquímica com CA-125 em aumento sequencial sem sintomas clínicos correspondentes não deve ser considerada uma indicação de tratamento de recorrência citotóxica [16].
Literatura:
- Gupta S, et al.: Características do teste de alfa-fetoproteína para detecção de carcinoma hepatocelular em doentes com hepatite C. Uma revisão sistemática e uma análise crítica. Ann Intern Med 2003; 139: 46-50.
- Oldenburg J, et al: Testicular seminoma e não-seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment, follow-up. Ann Oncol 2013; 24 Suppl 6: vi125-132.
- Bosl GJ, Motzer RJ: cancro de células germinais testiculares. N Engl J Med 1997; 337: 242-253.
- Milose JC, et al: Papel dos marcadores bioquímicos no cancro testicular: diagnóstico, encenação e vigilância. Acesso Livre J Urol 2011; 4: 1-8.
- Trigo JM, et al: Marcadores tumorais no momento da recidiva em doentes com tumores de células germinativas. Cancro 2000; 88: 162-168.
- Parker C, et al: Cancro da próstata: Directrizes de Prática Clínica da OMPE para diagnóstico, tratamento e acompanhamento. Ann Oncol 2015; 26 Suppl 5: v69-77.
- Gasser T, et al.: Determinação PSA – Recomendações da Sociedade Suíça de Urologia (SGU). Schweiz Med Forum 2012; 12(6): 126-128.
- Vickers AJ, et al: concentração de antigénio específico da próstata aos 60 anos e morte ou metástase do cancro da próstata: estudo de caso-controlo. BMJ 2010; 341: c4521.
- Schroder FH, et al: Screening and Prostate Cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet 2014; 384: 2027-2035.
- Andriole GL, et al: Rastreio do cancro da próstata no ensaio aleatório de rastreio da próstata, pulmão, colorectal e cancro do ovário: resultados de mortalidade após 13 anos de seguimento. J Natl Cancer Inst 2012; 104: 125-132.
- Catalona WJ, et al: Utilização da percentagem de antigénio livre específico da próstata para melhorar a diferenciação do cancro da próstata de doenças benignas da próstata: um ensaio clínico multicêntrico prospectivo. JAMA 1998; 279: 1542-1547.
- Lilja H, et al: Predição de cancro da próstata significativo diagnosticado 20 a 30 anos mais tarde com uma única medida de antigénio específico da próstata aos 50 anos ou antes. Cancro 2011; 117: 1210-1219.
- Declaração de consenso: directrizes para PSA após radioterapia. Painel de Consenso da Sociedade Americana de Radiologia Terapêutica e Oncologia. Int J Radiat Oncol Biol Phys 1997; 37: 1035-1041.
- Roach M, et al: Definição de falha bioquímica após radioterapia com ou sem terapia hormonal em homens com cancro da próstata clinicamente localizado: recomendações da Conferência de Consenso RTOG-ASTRO Phoenix. Int J Radiat Oncol Biol Phys 2006; 65: 965-974.
- Scher HI, et al: concepção e pontos finais de ensaios clínicos para doentes com cancro progressivo da próstata e níveis de castrato de testosterona: recomendações do Grupo de Trabalho sobre Ensaios Clínicos do Cancro da Próstata. J Clin Oncol 2008; 26: 1148-1159.
- Rustin GJ, et al: Tratamento precoce versus retardado do cancro dos ovários recidivado (MRC OV05/EORTC 55955): um ensaio aleatório. Lancet 2010; 376: 1155-1163.
- Menon U, et al: Estudo prospectivo utilizando o algoritmo do risco de cancro dos ovários para rastrear o cancro dos ovários. J Clin Oncol 2005; 23: 7919-7926.
- Molina R, et al: C-erbB-2, CEA e CA 15.3 níveis séricos no diagnóstico precoce de recidiva de doentes com cancro da mama. Anticancer Res 1999; 19: 2551-2555.
- Ballehaninna UK, Chamberlain RS: A utilidade clínica do soro CA 19-9 no diagnóstico, prognóstico e gestão do adenocarcinoma pancreático: Uma avaliação baseada em evidências. J Gastrointest Oncol 2012; 3: 105-119.
- Liu Z, et al: Uma revisão sistemática e meta-análise de biomarcadores séricos de diagnóstico e prognóstico do cancro colorrectal. PLoS One 2014; 9: e103910.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(4): 5-9