Os produtos biológicos provaram ser eficazes na gestão da psoríase devido à sua eficácia melhorada e ao seu perfil de segurança vantajoso em relação às terapias convencionais [4]. Que os biólogos individuais com diferentes citocinas-alvo podem diferir na sua eficácia é demonstrado pelos resultados de vários estudos frente a frente [1–3].
A maioria dos doentes com psoríase quer principalmente alcançar uma pele completamente sem aspecto [5]. Contudo, os tratamentos sistémicos convencionais como a fototerapia ou o metotrexato (MTX) muitas vezes não conduzem ao sucesso terapêutico desejado na psoríase moderada a grave [4].
Com os produtos biológicos das classes de inibidores da IL-12/23, TNF-alfa, IL-17A e IL-23, estes doentes podem agora beneficiar de opções de tratamento eficazes com um perfil de segurança vantajoso [4].®) em comparação directa com o inibidor ustekinumab IL-12/23, o inibidor TNF-alfa adalimumab e o inibidor secukinumab IL-17A nos estudos cabeça a cabeça UltIMMa-1 e -2, bem como IMMvent e IMMerge. [1-3]. Para além das diferenças de eficácia, os quatro biológicos também diferem na aplicação e dosagem(Quadro 1) [1-3, 6-9].
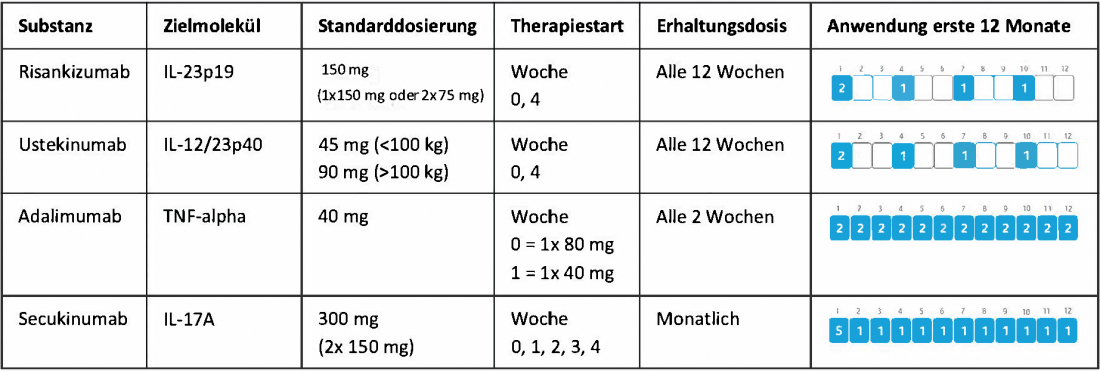 Quadro 1: Visão geral das diferentes opções de tratamento biológico da psoríase de placa moderada a grave em comparação com o risankizumab em estudos “cabeça a cabeça”. Adaptado de [6-9].
Quadro 1: Visão geral das diferentes opções de tratamento biológico da psoríase de placa moderada a grave em comparação com o risankizumab em estudos “cabeça a cabeça”. Adaptado de [6-9].
Risankizumab vs. ustekinumab: Estudos UltlMMa-1 e -2 [1].
Os dois estudos aleatorizados, controlados por placebo, duplo-cego fase III estudam UltIMMa-1 e UltIMMa-2 com um total de 997 doentes adultos com psoríase crónica moderada a grave, comparando a eficácia e segurança do risankizumab e do inibidor ustekinumab IL-12/23 [1]. Em ambos os ensaios, significativamente mais doentes do grupo risankizumab conseguiram uma resposta PASI-90 e PASI-100 com 16 e 52 semanas do que no grupo ustekinumab(Tabela 2). Assim, após 52 semanas, cerca do dobro de doentes sob risco de traumatismo craniano do que sob ustekinumabe mostraram total ausência de sintomas (PASI-100) [1].
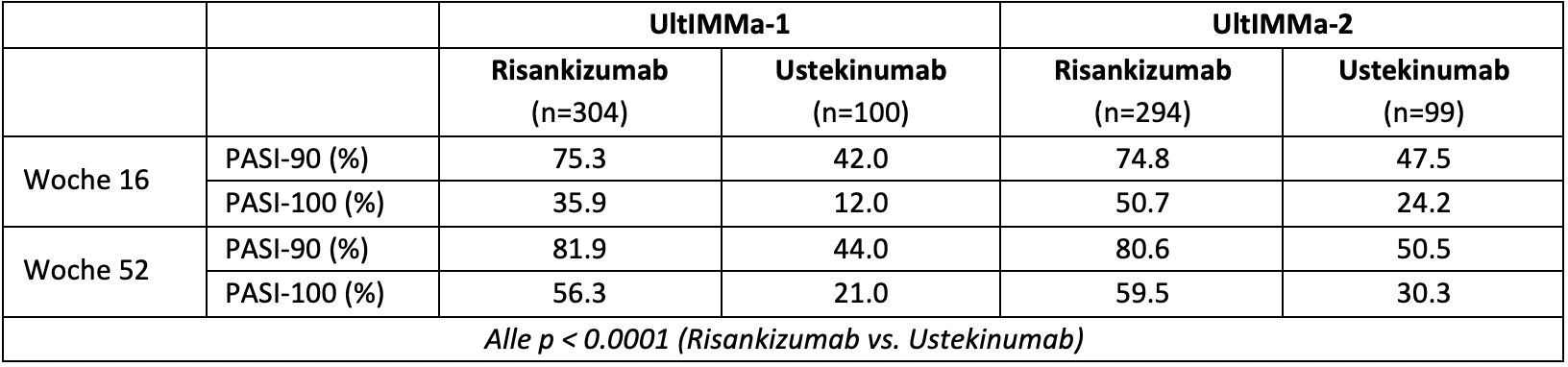 Quadro 2: Resposta PASI-90 e PASI-100 de doentes com psoríase crónica moderada a grave tratada com risankizumab ou ustekinumab nos estudos aleatórios, controlados por placebo, duplo-cego fase III UltIMMa-1 e UltIMMa-2. Adaptado de [1].
Quadro 2: Resposta PASI-90 e PASI-100 de doentes com psoríase crónica moderada a grave tratada com risankizumab ou ustekinumab nos estudos aleatórios, controlados por placebo, duplo-cego fase III UltIMMa-1 e UltIMMa-2. Adaptado de [1].
Como uma análise integrada dos dois estudos demonstrou, a eficácia superior do risankizumab era independente da demografia de base, das características da doença ou das terapias biológicas anteriores [12]. O perfil de segurança era comparável ao placebo tanto no braço risankizumab como no braço ustekinumab [1].
Risankizumab vs. adalimumab: Estudo IMMvent [2].
A eficácia e segurança do risankizumab e do inibidor de TNF-alfa adalimumab foram investigadas no estudo IMMvent fase III duplo-cego que envolveu 605 doentes adultos com psoríase crónica moderada a grave. Às 16 semanas após a aleatorização 1:1 para risankizumab ou adalimumab, significativamente mais pacientes mostraram respostas PASI-90 e PASI-100 com risankizumab do que com adalimumab (p<0,0001, Tabela 3) [2]. Os doentes do grupo adalimumab com uma resposta PASI intermédia de 50 a <90 foram novamente randomizados 1:1 para risankizumab ou adalimumab. Já 4 semanas depois, uma vantagem significativa em termos de PASI-90 foi observada nos pacientes que mudaram para risankizumab em comparação com os pacientes que continuaram a receber adalimumab. Uma melhoria significativa na resposta ao PASI-100 com risankizumab em comparação com o adalimumab foi observada às 8 semanas, com a diferença de eficácia a persistir ao longo do período de observação de 44 semanas (p<0,0001). Os eventos adversos associados ao tratamento ocorreram com frequência comparável em ambos os grupos de tratamento e não foram registados novos sinais de segurança após a mudança de adalimumab para risankizumab [2].
 Quadro 3: PASI-90 e PASI-100 resposta de doentes com psoríase crónica moderada a grave tratada com risankizumab ou adalimumab no estudo IMMvent fase III aleatorizado e duplo-cego. Após 16 semanas, os doentes em adalimumab com uma resposta PASI de 50 a <90 foram aleatorizados 1:1 para risankizumab ou adalimumab. Adaptado de [2].
Quadro 3: PASI-90 e PASI-100 resposta de doentes com psoríase crónica moderada a grave tratada com risankizumab ou adalimumab no estudo IMMvent fase III aleatorizado e duplo-cego. Após 16 semanas, os doentes em adalimumab com uma resposta PASI de 50 a <90 foram aleatorizados 1:1 para risankizumab ou adalimumab. Adaptado de [2].
Risankizumab vs. secukinumab: Estudo IMMerge [3].
A última comparação risankizumab cabeça a cabeça, o ensaio de IMMerge fase III com rótulo aberto, comparou a eficácia e segurança do inibidor da IL-23 e do inibidor da IL-17A secukinumab em psoríase crónica moderada a severa. Com 16 semanas após a aleatorização 1:1 de 327 pacientes adultos, o tratamento com risankizumab foi considerado não-inferior ao tratamento com secukinumab em termos de resposta ao PASI-90. Com 52 semanas, o risankizumab demonstrou superioridade sobre o secukinumab: cerca de um terço e um quarto mais doentes conseguiram um PASI-90 e PASI-100, respectivamente, com cinco doses de risankizumab do que com 16 doses de secukinumab(Quadro 4). As taxas de efeitos secundários eram comparáveis em ambos os grupos de tratamento [3].
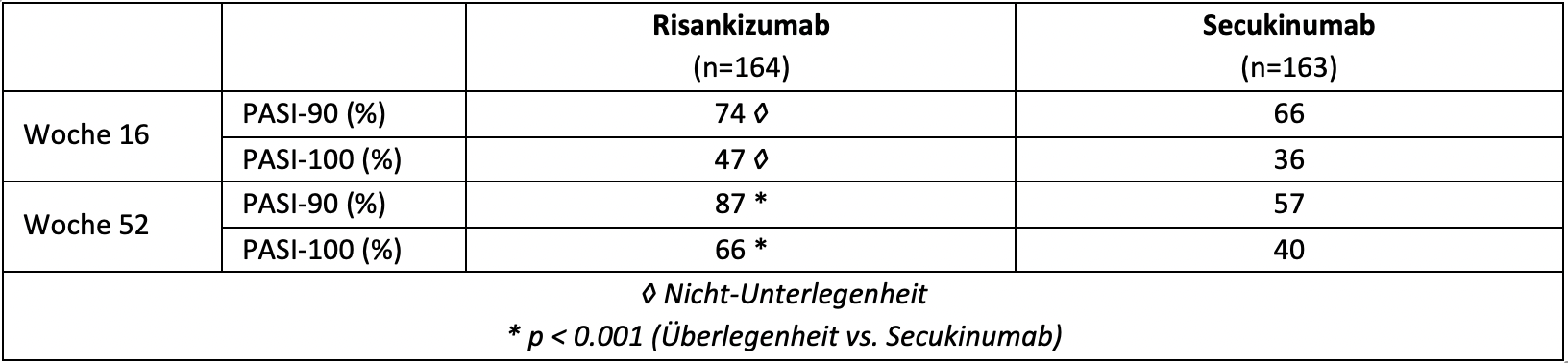 Quadro 4: PASI-90 e PASI-100 resposta de doentes com psoríase crónica moderada a grave tratada com risankizumab ou secukinumab no estudo IMMerge fase III aleatorizado e com rótulo aberto. Adaptado de [3].
Quadro 4: PASI-90 e PASI-100 resposta de doentes com psoríase crónica moderada a grave tratada com risankizumab ou secukinumab no estudo IMMerge fase III aleatorizado e com rótulo aberto. Adaptado de [3].
Conclusão: Risankizumab sai no topo em três comparações frente-a-frente [1-3]
As opções de tratamento biológico hoje disponíveis marcam um claro avanço na terapia de pacientes com psoríase de placa moderada a grave [4]. Contudo, nem todas as classes de medicamentos são igualmente eficazes, como mostram os resultados de várias comparações frente a frente com o risankizumab. Assim, significativamente mais pacientes conseguiram a cura completa ou quase completa da pele sob o inibidor da IL-23 do que sob o inibidor da IL-12/23 ustekinumab, o inibidor da TNF-alfa adalimumab e o inibidor da IL-17A secukinumab [1-3]. Além disso, os doentes em risankizumab podem beneficiar de um intervalo de dosagem de três meses em terapia de manutenção, para além do tratamento eficaz que lhes dá uma oportunidade de ter uma pele sem aspecto [1, 6].
Este texto foi produzido com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
CH-SKZD-210018_03/2021
Contribuição online desde 06.04.2021
Publicação actualizada 22.02.2022
Breve informação técnica Skyrizi®
Literatura
As referências podem ser solicitadas por profissionais em medinfo.ch@abbvie.com.