Desde há mais de uma década, os biomarcadores no LCR e, mais recentemente, na voz revolucionaram verdadeiramente o diagnóstico da doença de Alzheimer, permitindo uma deteção mais precisa e exacta da patologia. As diretrizes de 2024, com a sua abordagem clínico-biológica integrada, oferecem um procedimento mais completo para o diagnóstico e a gestão personalizada da doença, com cursos específicos para cada fase da patologia.
Pode fazer o teste CME na nossa plataforma de aprendizagem depois de rever os materiais recomendados. Clique no botão seguinte:
A doença de Alzheimer (DA) é a principal causa de demência no mundo, afectando mais de 50 milhões de pessoas. Esta patologia neurodégénérative progressiva caracteriza-se por problemas de memória, de codificação e de funções cognitivas causados pela acumulação de placas amilóides e de emaranhados neurofibrilares no cérebro. Historicamente, o diagnóstico baseava-se principalmente na observação de sintomas clínicos, muitas vezes confirmados post mortem por análises cervicais. No entanto, com o advento de tecnologias modernas, como a neuroimagem e a análise de biofluidos, a AM tem sido progressivamente redefinida como uma patologia biológica [1]. A introdução de biomarcadores, detectáveis em fluidos corporais como o líquido cefalorraquidiano (LCR) e, mais recentemente, na urina, alterou significativamente a forma como a doença é diagnosticada, permitindo uma deteção cada vez mais precisa da doença em estudos de investigação. Em 2018, o Institut National du Vieillissement (NIA) e a Association Alzheimer (AA) introduziram o quadro A/T/N (Amyloïde/Tau/Neurodégénérescence), que permite diagnosticar a fisiopatologia da AM com base em biomarcadores específicos [2]. Este quadro transformou assim a critériologia da AM e o seu diagnóstico. Este artigo propõe-se examinar esta transição da AM de uma interpretação clínica para uma validação clínico-biológica, com um foco particular nos biomarcadores mais proeminentes detectados no LCR e na voz, bem como nas novas diretrizes de 2024, que incorporam uma abordagem clínico-biológica complementar para um diagnóstico preciso [3].
Os biomarcadores no líquido céfalo-raquidiano (LCR)
O líquido céfalo-raquidiano é um fluido biológico essencial para o estudo dos biomarcadores da MA. Reflecte diretamente as alterações patológicas que ocorrem no colo do útero. Entre os biomarcadores mais importantes medidos no LCR encontram-se a amiloide-β 42 (Aβ42), a proteína tau total (t-tau) e a proteína tau fosforilada (p-tau).
Amyloïde-β 42 (Aβ42) et le ratioAβ42/Aβ40: L’amyloïde-β 42 (Aβ42) est une protéine clé qui forme les plaques amyloïdes dans le cerveau des patients atteints de la MA. Observa-se uma diminuição da concentração de Aβ42 no LCR devido à sua acumulação sob a forma de placas. Esta diminuição é um marcador precoce da patologia amiloide. [4,5] O rácio Aβ42/Aβ40 é um indicador utilizado para melhorar a precisão do diagnóstico. Quando o Aβ42 diminui no LCR devido à formação de placas, os níveis de Aβ40, uma forma da proteína amiloide menos específica da patologia, permanecem estáveis. O rácio Aβ42/Aβ40 permite corrigir as variações individuais dos níveis de amiloide-β e melhora a sensibilidade e a especificidade do diagnóstico da MA. Um rácio baixo indica uma acumulação significativa de amiloide e constitui um indicador fiável da doença.
A proteína Tau e a sua hiperfosforilação: A tau total (t-tau) no LCR é um marcador geral da neurodégénérescence. A proteína tau, em condições normais, está envolvida na estabilização dos microtúbulos dos neurónios. No entanto, na MA, os níveis elevados de tau total no LCR indicam uma degradação neuronal. Apesar de a tau ser um indicador de neurodégénérescence [6], não é específica da MA e pode ser elevada noutras patologias neurodégénératives ou após uma lesão cerebral elevada. A tau fosforilada (p-tau) é uma forma modificada da proteína tau, em que os grupos fosfatos são adicionados a sítios específicos, favorecendo assim a formação de estruturas neurofibrilares, uma caraterística típica da MA. As principais formas de p-tau observadas na LCR são p-tau181, p-tau217 e p-tau231. Estes biomarcadores são mais específicos para a MA do que o tau total.
- O P-tau181 é um dos primeiros biomarcadores tau fosforilados identificados para a doença de Alzheimer (MA). O seu aumento na LCR reflecte as alterações patológicas relacionadas com os crescimentos neurofibrilares, que são uma caraterística típica da MA [7]. O p-tau181 é um biomarcador sensível e relativamente específico da MA, permitindo diferenciar esta doença de outros problemas neurogénicos. No entanto, apesar de estar maioritariamente associado à MA, pode também ser muito elevado noutras formas de doença.
- O p-tau217 está mais estreitamente relacionado com a patologia da MA do que o p-tau181. [8,9] Estudos recentes demonstraram que o p-tau217 tem uma melhor correlação com a formação de placas amilóides e com os enchevêtrements de tau. Devido à sua maior sensibilidade e especificidade, o p-tau217 poderia substituir progressivamente o p-tau181 como biomarcador de referência para o diagnóstico pré-clínico, nomeadamente nas fases iniciais e tardias da doença.
- O P-tau231 é um biomarcador ainda em fase de estudo, mas poderá fornecer informações suplementares sobre as fases intermédias da AM. [10,11] A sua utilidade poderia residir principalmente na monitorização da transição entre o défice cognitivo ligeiro (MCI) e a demência. Embora seja um promotor, o p-tau231 necessita ainda de mais investigação para validar a sua especificidade e o seu potencial papel na prática clínica.
- MTBR-Tau243: O MTBR-Tau243 é um biomarcador específico e promissor para a deteção da patologia tau na doença de Alzheimer (MA). Este biomarcador caracteriza-se pela sua capacidade de detetar especificamente agregados de tau insolúveis, que estão fortemente associados aos sintomas clínicos da MA, nomeadamente ao declínio cognitivo. Estudos recentes demonstraram que o MTBR-Tau243, medido no líquido cefalorraquidiano (LCR), é o marcador mais correlacionado com a imagem tau-PET, ultrapassando outras formas de tau fosforiladas como o p-tau181 e o p-tau217. [12] Além disso, apresenta um aumento significativo durante as fases avançadas da doença, o que constitui um indicador relevante para o acompanhamento da evolução da patologia da tau.
Tecnologias avançadas para a deteção de proteínas no plasma
A deteção da proteína tau fosforilada (p-tau) no plasma representa um dos avanços recentes mais promissores no domínio dos biomarcadores da doença de Alzheimer (DA). Historicamente, a medição da p-tau no plasma tem sido limitada devido à sua concentração muito baixa e à presença de outras proteínas em circulação. [16–20] No entanto, as tecnologias ultra-sensíveis como o SIMOA (utilizado pela Quanterix) e os imunoensaios automatizados (desenvolvidos pela Roche e pela Fujirebio) ultrapassaram estes obstáculos. Permitem agora a deteção precisa de biomarcadores como p-tau181, p-tau217 e o rácio Aβ42/Aβ40, em concentrações muito baixas. Entre estes biomarcadores, o p-tau217 distingue-se pela sua capacidade de classificar melhor a patologia amiloide e tau, ultrapassando outros biomarcadores como o rácio Aβ42/Aβ40, que são frequentemente menos sensíveis devido a variações de pH. Estes testes estão a ser cada vez mais utilizados, não só na investigação, mas também para um diagnóstico pré-clínico mais acessível e menos invasivo. Outras empresas, como a C2N Diagnostics, optimizaram os testes de rastreio para a deteção de Aβ42/Aβ40 utilizando a espetrometria de massa. Embora este biomarcador apresente uma precisão inferior à do p-tau217, continua a ser crucial para a avaliação da carga amiloide cervical, mas a sua interpretação deve ser associada a outros biomarcadores para garantir uma avaliação clínica fiável. Embora estas inovações tenham demonstrado um grande potencial para vários biomarcadores, necessitam ainda de validação adicional antes de poderem ser amplamente utilizadas na prática clínica. No entanto, com as devidas precauções, estas tecnologias poderão ser progressivamente integradas na prática clínica, oferecendo perspectivas promissoras para um diagnóstico precoce, menos invasivo e potencialmente aplicável à depilação em massa no futuro.
Os biomarcadores sanguíneos
Nos últimos anos, os biomarcadores sanguíneos tornaram-se cada vez mais importantes como alternativa não invasiva às análises do líquido cefalorraquidiano (LCR). A sua facilidade de utilização e o seu potencial de deposição fazem deles uma ferramenta valiosa para o diagnóstico da doença de Alzheimer (DA). Entre os biomarcadores mais estudados, encontram-se as proteínas tau fosforiladas (p-tau), a cadeia leve dos neurofilamentos (NfL), as proteínas gliofibrilares ácidas (GFAP), bem como os biomarcadores amilóides, como o rácio Aβ42/Aβ40 no plasma. [17] Embora estes biomarcadores ofereçam perspectivas interessantes, o seu desempenho varia consoante a tecnologia utilizada e a fase da doença.
Amiloide-β no sangue: uma alternativa prometedora mas limitada: A deteção de proteínas amilóides no sangue, em particular o rácio Aβ42/Aβ40, representa um ponto de viragem para o diagnóstico não invasivo da MA. [16] No entanto, estudos comparativos recentes mostram que os testes baseados no rácio Aβ42/Aβ40 são globalmente menos eficazes do que os baseados nas proteínas p-tau217 . De facto, as flutuações devidas a factores periféricos não relacionados com a patologia cervical, como a presença de APP em diferentes tecidos, complicam a interpretação deste biomarcador. Tecnologias como o SIMOA e o Lumipulse permitem medir este rácio com precisão, mas as variações sistémicas podem reduzir a sua especificidade. Embora os biomarcadores amilóides possam ser utilizados para avaliar a carga amiloide cervical, necessitam frequentemente de ser combinados com outros biomarcadores para melhorar a precisão do diagnóstico.
Les protéines tau phosphorylées (p-tau) : différences technologiques et implications cliniques: Les formes de p-tau mesurées dans le sang, telles que p-tau181, p-tau217, et parfois p-tau231, jouent un rôle crucial dans le diagnostique précoce de la MA. De acordo com estudos recentes, o p-tau217 é um dos biomarcadores mais promissores, com melhor precisão diagnóstica do que o p-tau181, especialmente para diferenciar a MA de outras formas de depressão.
- P-tau181: Apesar de ser uma das primeiras formas utilizadas para o diagnóstico sanguíneo, o P-tau181 apresenta uma sensibilidade limitada, sobretudo nas fases mais precoces da doença [8]. [21] Testes como os propostos pela Roche e Quanterix mostram um desempenho aceitável, mas inferior ao p-tau217 em termos de correlação com os resultados da PET amiloide.
- [22]P-tau217: De acordo com estudos recentes, o p-tau217 detectado através de tecnologias como C2N e Fujirebio Lumipulse oferece uma melhor sensibilidade e especificidade para a deteção da patologia amiloide, ultrapassando outros biomarcadores em testes comparativos. [21] Os desempenhos do p-tau217 são particularmente elevados nas fases pré-clínicas da doença, o que o torna um instrumento essencial para um diagnóstico precoce.
Neurofilamento maior (NfL): um marcador não específico de neurodégénérescence: O NfL é um marcador de neurodégénérescence não específico, medido no sangue. Apesar de os níveis de NfL aumentarem em várias doenças neurodegenerativas, incluindo a MA, os seus desempenhos são inferiores aos do p-tau. O estudo mostra que testes como o Roche NeuroToolKit e o Quanterix Neurology 4-Plex permitem a deteção de NfL com uma boa sensibilidade, mas com uma especificidade inferior à do p-tau217. O NfL continua, no entanto, a ser um excelente marcador para monitorizar a evolução da degeneração neuronal e para avaliar tratamentos neuroprotectores.
Gliofibrillaire acide protéine (GFAP): un marqueur de l’inflammation gliale: GFAP reflète l’inflammation gliale liée à l’activation des astrocytes dans le cerveau. O estudo mostra que o GFAP é um marcador promotor da deteção da inflamação associada à patologia amiloide, com aumentos significativos observados em doentes amilóides positivos. No entanto, tal como a NfL, a GFAP não é específica da MA e pode ser observada noutras patologias neuroinflamatórias. [25] As tecnologias Roche e Quanterix permitem medir o GFAP com grande precisão, e a sua combinação com o p-tau melhora a avaliação clínica.
Nota: O gene APOE, e em particular o alelo ε4, é o principal fator de risco genético para a MA. [26,27] Os portadores do alelo ε4 correm o risco de desenvolver a doença. O alelo também está associado a níveis mais elevados de p-tau e de placas amilóides, o que aumenta a probabilidade de progressão rápida da patologia. Além disso, os portadores de APOE ε4 apresentam frequentemente níveis elevados de GFAP, indicando uma neuro-inflamação mais marcada, o que sugere que este alelo contribui não só para a acumulação de amiloide, mas também para a inflamação associada à MA. A consideração da genética também pode servir como um indicador para interpretar os resultados de uma análise do plasma de um doente sintomático.
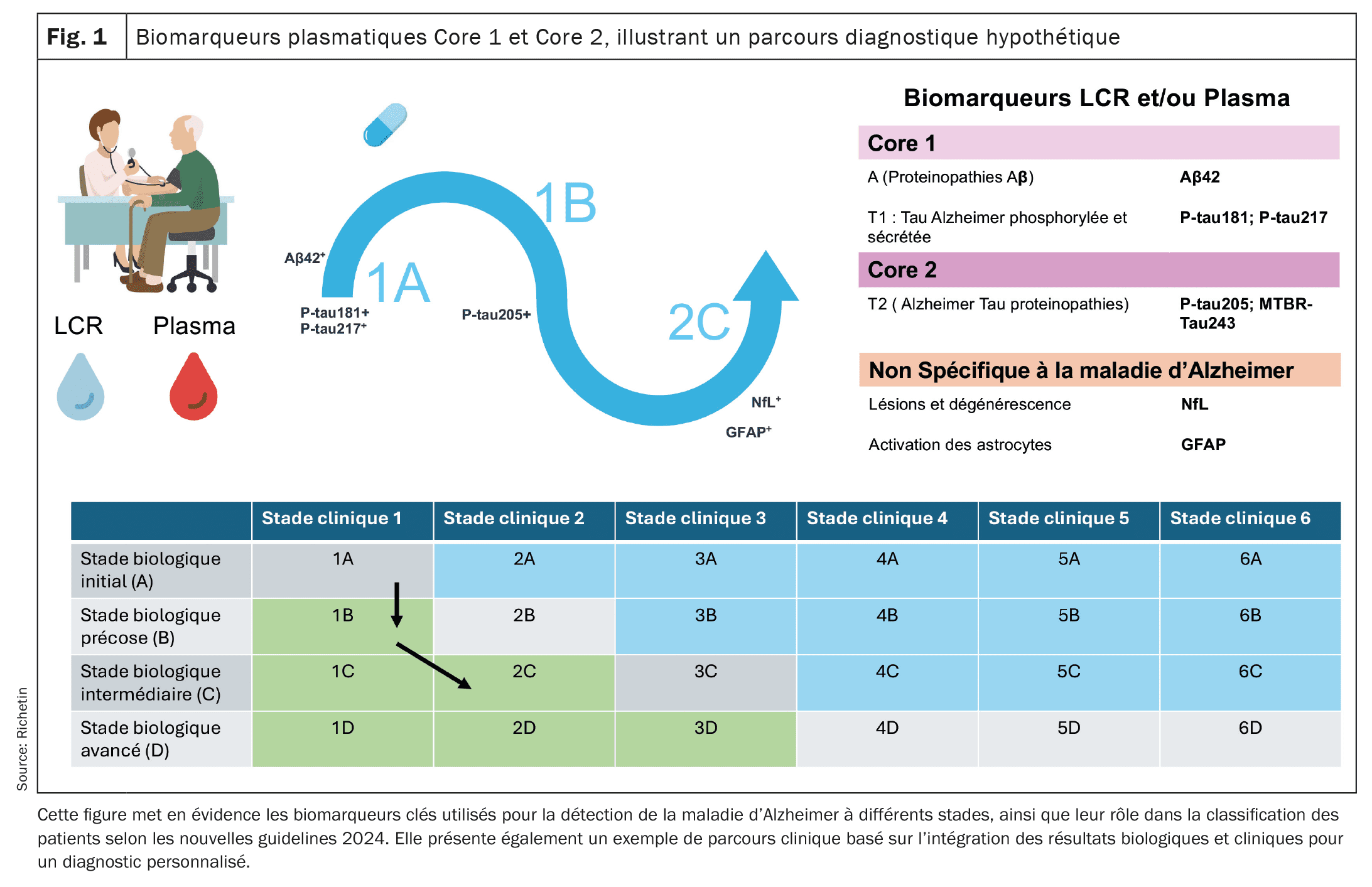
| Por conseguinte, está a ser desenvolvido um novo conceito de vias de diagnóstico, que será provavelmente aperfeiçoado nos próximos anos. A partir de agora, as vias classificarão os doentes de acordo com as anomalias dos biomarcadores Core 1 e Core 2, bem como com a presença ou ausência de sintomas clínicos, a fim de ajustar o diagnóstico e o acompanhamento. Estas novas diretrizes poderão fornecer um quadro mais preciso para a avaliação diagnóstica e o acompanhamento da evolução da MA de uma forma mais personalizada, integrando biomarcadores plasmáticos, LCR e avaliações clínicas. Facilitam igualmente uma abordagem adaptada a cada fase da doença, desde a fase pré-clínica até às fases avançadas da neurodegenerescência. |
Da investigação ao diagnóstico?
Nas últimas décadas, os progressos da investigação sobre os biomarcadores da doença de Alzheimer conduziram a uma transição crucial para a aplicação clínica e para um diagnóstico de precisão cada vez mais acessível. Os primeiros estudos centraram-se na identificação da patologia amiloide e da proteinopatia tau no líquido cefalorraquidiano (LCR), o que levou ao desenvolvimento de testes capazes de detetar estas anomalias com grande precisão. Estes biomarcadores, inicialmente utilizados na investigação, permitiram confirmar a presença de alterações fisiopatológicas antes dos sintomas. No entanto, o acesso a estes testes estava limitado a centros de investigação especializados devido às técnicas invasivas e dispendiosas utilizadas. Com a introdução dos biomarcadores plasmáticos, em particular as formas p-tau e o rácio Aβ42/Aβ40, a investigação deu um passo decisivo para uma aplicação clínica mais alargada. A capacidade de detetar estes biomarcadores no organismo, graças às tecnologias ultra-sensíveis, abriu a porta a uma deteção clínica não invasiva e mais facilmente realizável. Estas inovações poderão permitir confirmar facilmente a fisiopatologia da MA em doentes com um quadro clínico sugestivo e identificar indivíduos assintomáticos e em risco de desenvolver MA, mesmo antes do aparecimento de sintomas cognitivos. No entanto, continuam a existir desafios no que respeita à normalização dos testes, à sua variabilidade (variação circadiana, função renal, função vascular), à sua disponibilidade em grandes centros e à imputação de custos, nomeadamente para o reembolso dos testes plasmáticos. A integração progressiva dos biomarcadores nos cuidados diários, associada a tecnologias de imagem como a PET amiloide e a PET tau, permite não só um diagnóstico mais preciso, mas também uma melhor avaliação da progressão da doença. Esta transição da investigação para a clínica representa um avanço importante para a medicina personalizada e poderá permitir estratégias de prevenção de segundo ou terceiro nível, consoante a fase da doença.
Para uma abordagem clínico-biológica mais integrada
[16]Em 2024, o Institut National du Vieillissement (NIA) e a Associação de Alzheimer propuseram novas diretrizes baseadas numa abordagem que combina avaliações clínicas e biológicas para melhorar o diagnóstico e o acompanhamento da progressão da doença de Alzheimer (AM) . Estas diretrizes estão organizadas em torno de duas categorias de biomarcadores: Core 1 e Core 2, bem como de várias vias de diagnóstico (1A, 1B, etc.), que permitem classificar os doentes em função da evolução da sua patologia. Os biomarcadores do núcleo 1 medem diretamente a patologia amiloide e tau. Incluem indicadores como o rácio bêta-amiloïde Aβ42/Aβ40 e as formas de tau fosforilada (p-tau181, p-tau217). Estas anomalias aparecem nas fases iniciais da doença, frequentemente em correlação com os resultados da imagiologia amiloide PET, facilitando assim um diagnóstico preliminar antes do aparecimento dos sintomas clínicos. Os biomarcadores plasmáticos, em particular o p-tau217 e o p-tau181, demonstraram ser úteis para detetar estas anomalias no plasma, permitindo uma deteção mais extensa e menos invasiva. No entanto, a interpretação destes resultados deve ser associada a uma avaliação clínica exaustiva. Os biomarcadores do Core 2 reflectem o processo de neurodégénérescence e de protéinopatia tau mais avançado, tal como o MTBR-tau243. Estes tornam-se anormais nas fases mais avançadas da AM, em associação direta com o aparecimento de sintomas cognitivos. Biomarcadores como a cadeia leve do neurofilamento (NfL) e a protéina ácida gliofibrilar (GFAP), detectados no sémen e no líquido cefalorraquidiano (LCR), fornecem informações precisas sobre a degeneração neuronal e a inflamação, desempenhando um papel crucial na avaliação da progressão da doença e na adaptação de estratégias terapêuticas.Proposta de um cenário hipotético para o percurso diagnóstico e terapêutico de um doente afetado pela doença de Alzheimer
Étape 1: Depistage dans un centre de la memoire (Parcours 1A): O Sr. K., de 62 anos, é consultado numa consulta de rotina sem sintomas cognitivos perceptíveis. Tendo em conta a sua história familiar de doença de Alzheimer, seria orientado para uma avaliação preliminar num centro de memória. Um teste sanguíneo poderia revelar níveis anormalmente elevados de p-tau217, bem como um rácio Aβ42/Aβ40 reduzido, que são potenciais indicadores de uma patologia amiloide. Estes resultados foram confirmados por uma análise do líquido cefalorraquidiano (LCR), que demonstrou uma acumulação anormal de amiloide e de proteínas tau. Nesta fase, o Sr. K. não apresentava quaisquer sintomas clínicos, mas os seus biomarcadores core 1 (p-tau e Aβ) podiam indicar uma patologia pré-clínica de Alzheimer (curso 1A). Dada a deteção pré-clínica desta patologia amiloide, seria concebível propor uma terapia anti-amiloide, como o lecanemab ou o donanemab, para prevenir a formação de placas amilóides no cérebro. Estes tratamentos, administrados numa fase pré-clínica, poderiam ter como objetivo retardar a progressão dos sintomas cognitivos graves.
Étape 2: Aparição de problemas cognitivos maiores (Parcours 1B): Dois anos mais tarde, o Sr. K. começará a apresentar problemas de memória mais graves, tais como problemas de encontro. Seria então efectuada uma reavaliação clínica, incluindo uma nova série de análises sanguíneas e um teste lombaire. Os resultados poderiam mostrar anomalias persistentes nos biomarcadores do core 1, confirmando a continuidade da patologia amiloide e tau. Os testes neuropsicológicos podem revelar uma ligeira desorientação cognitiva. Nesta fase, o Sr. K. entrou no curso 1B, caracterizado pela presença de problemas cognitivos ligeiros (défice cognitivo ligeiro, ou MCI) associados a biomarcadores anormais. Esta evolução poderia justificar uma intensificação da vigilância e um aumento do potencial da terapia anti-amiloide para melhorar a prevenção de sintomas graves. Estes tratamentos continuariam a ser administrados com o objetivo de abrandar a progressão para uma doença confirmada.
Étape 3: Evolução para uma neurogénese avançada (Parcours 2C): Cinquenta anos após o diagnóstico inicial, os sintomas do Sr. K. agravaram-se. Podia apresentar problemas cognitivos mais graves que afectavam as suas actividades diárias, marcando assim a transição para uma demência mais avançada. Foi efectuada uma nova série de análises de biomarcadores, revelando anomalias nos biomarcadores Core 2, como a variação p-tau205. Além disso, os biomarcadores de neurodégénérescence, como o NfL (neurofilament light chain) e o GFAP (glial fibrillary acidic protein), podem indicar neuroinflamação e destruição neuronal ativa. Uma imagem tau-PET pode mostrar uma acumulação aumentada de tau nas regiões associadas à cognição. Nesta fase, o Sr. K. encontrava-se na fase 2C, com uma neurodégénérescence acentuada. O plano de tratamento centrou-se na gestão dos sintomas cognitivos e comportamentais, com uma combinação de tratamentos sintomáticos, cuidados personalizados e um maior apoio à família, de modo a manter a qualidade de vida do doente.
Conclusão: Este cenário hipotético realça a importância da pré-deteção por biomarcadores sanguíneos e LCR na doença de Alzheimer. Mostra também que a introdução de fármacos anti-amiloide poderia ajudar a abrandar a progressão da doença antes do início dos sintomas. A monitorização contínua dos biomarcadores, associada a avaliações neuropsicológicas, permite ajustar as intervenções terapêuticas em função da evolução biológica e clínica, garantindo assim uma abordagem personalizada do doente.
Vantagens clínicas do diagnóstico precoce
O diagnóstico precoce da doença de Alzheimer, possível graças aos biomarcadores presentes no LCR e na voz, traz grandes benefícios clínicos. Permite intervir numa fase em que os tratamentos, embora limitados na sua capacidade de reverter a doença, podem travar a progressão dos sintomas cognitivos. Ao identificar a patologia no estádio 1A, quando os doentes ainda não apresentam quaisquer sinais clínicos, os profissionais podem pôr em prática estratégias terapêuticas preventivas destinadas a retardar a transição para estádios mais sintomáticos. Outra vantagem fundamental da intervenção precoce é a possibilidade de um melhor planeamento dos cuidados a longo prazo. Uma vez identificada a patologia através de biomarcadores de amiloide ou tau, os doentes e as suas famílias podem beneficiar de uma melhor antecipação da evolução da doença. Isto inclui decisões mais informadas em termos de cuidados, de gestão financeira e de organização da vida quotidiana, bem como a criação de redes de apoio adaptadas. Esta abordagem proactiva permite melhorar a qualidade de vida do doente, abrandando os efeitos incapacitantes da demência e favorecendo uma abordagem personalizada dos cuidados.
O diagnóstico pré-clínico, graças a biomarcadores como o p-tau217 e o Aβ42/Aβ40, permite também tomar uma decisão terapêutica mais exacta e adaptada ao doente. Os médicos podem determinar mais rapidamente se um doente é elegível para ensaios clínicos de novas terapias ou para tratamentos destinados a modificar a doença, a fim de reduzir a acumulação de amiloide ou tau. Ao tratar os doentes nas fases iniciais da doença, é também possível limitar o impacto das complicações secundárias associadas ao desenvolvimento da MA, como a perda de autonomia, os problemas comportamentais e o aumento da carga sobre os prestadores de cuidados. [28] Por último, o diagnóstico precoce permite uma melhor gestão dos recursos médicos, nomeadamente nos países com poucos recursos. Ao identificar com maior precisão os doentes que mais necessitam de um acompanhamento rigoroso ou de intervenções específicas, os médicos podem adaptar as suas práticas e dar prioridade aos cuidados de acordo com a gravidade da doença. Isto também pode ter implicações económicas positivas, reduzindo os custos a longo prazo associados a intervenções tardias para a demência avançada, que frequentemente envolvem hospitalização e cuidados mais complexos.
Conclusão
Os biomarcadores no LCR e na voz revolucionaram verdadeiramente o diagnóstico da doença de Alzheimer, permitindo uma deteção mais precisa e exacta da patologia, mesmo antes do aparecimento dos sintomas clínicos. As diretrizes de 2024, com a sua abordagem clínico-biológica integrada, oferecem um procedimento mais completo para o diagnóstico e a gestão personalizada da doença, com cursos específicos para cada fase da patologia. No entanto, apesar destes avanços, é necessário prosseguir os esforços para tornar estas tecnologias mais acessíveis, nomeadamente alargando a sua disponibilidade para além dos centros especializados e abordando questões relacionadas com os custos e o reembolso. Estas iniciativas serão cruciais para melhorar a gestão desta doença em larga escala, permitindo um acesso mais equitativo ao diagnóstico precoce e a intervenções terapêuticas e de sobrevivência mais adequadas.
Mensagens para levar para casa
- Desde há mais de uma década, os biomarcadores no LCR e, mais recentemente, na voz, revolucionaram verdadeiramente o diagnóstico da doença de Alzheimer, permitindo um diagnóstico mais preciso e exato da patologia.
- As diretrizes de 2024, com a sua abordagem clínico-biológica integrada, oferecem um procedimento mais completo para o diagnóstico e o tratamento personalizado da doença, com cursos específicos para cada fase da patologia.
- No entanto, apesar destes avanços, é necessário prosseguir os nossos esforços para tornar estas tecnologias mais fiáveis e acessíveis. Nos próximos anos, os biomarcadores da doença de Alzheimer na voz poderão transformar a forma como a doença de Alzheimer é diagnosticada antecipadamente, oferecendo assim uma janela de oportunidade para a intervenção antes mesmo do início dos sintomas clínicos.
- Marcadores como o p-tau217 e o rácio Aβ42/Aβ40 promovem uma maior precisão diagnóstica, permitindo a definição de estratégias terapêuticas para minimizar a progressão da doença.
- Estes avanços ofereceram aos clínicos ferramentas mais sensíveis, menos invasivas e potencialmente aplicáveis na prática clínica de rotina.
- Embora existam desafios em termos de normalização e de custos para os sistemas de saúde, as orientações para 2024 abrem a porta a cuidados personalizados, combinando a avaliação biológica e clínica para otimizar os cuidados em cada fase da doença.
Literatura:
- Huang S, Wang YJ, Guo J: Biofluid Biomarkers of Alzheimer’s Disease: Progress, Problems, and Perspectives [Biomarcadores biofluidos da doença de Alzheimer: progressos, problemas e perspectivas]. Neuroscience Bulletin 2022 38: 6 38, 677-691 (2022).
- Jack CR, et al: Quadro de Investigação NIA-AA: Rumo a uma definição biológica da doença de Alzheimer. Alzheimer & Dementia 2018; 14: 535-562.
- Jack CR, et al: Revised criteria for diagnosis and staging of Alzheimer’s disease: Alzheimer’s Association Workgroup. Alzheimer e Demência 2024; 20: 5143-5169.
- Salvadó G, et al: Associações específicas entre biomarcadores plasmáticos e cargas de placas amilóides e emaranhados de tau postmortem. EMBO Mol Med 2023; 15.
- Hansson O, Lehmann S, Otto M, et al: Vantagens e desvantagens da utilização do rácio CSF Amyloid β (Aβ) 42/40 no diagnóstico da doença de Alzheimer. Alzheimers Res Ther 2019; 11: 1-15.
- Holper S, Watson R, Yassi N: Tau as a Biomarker of Neurodegeneration. Revista Internacional de Ciências Moleculares 2022; 23: 7307.
- Kurihara M, Komatsu H, Sengoku R: ARTIGO COMPLETO P-Tau181 no LCR e Outros Biomarcadores em Pacientes com Doença de Inclusão Intranuclear Neuronal. Cite como: Neurology® 2023; 100: 1009-1019.
- Janelidze S, et al: Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nat Med (2020), doi: 10.1038/s41591-020-0755-1.
- Janelidze S, et al: O p-tau217 do fluido cerebrospinal tem melhor desempenho do que o p-tau181 como biomarcador da doença de Alzheimer. Nature Communications 2020; 11(1): 1-12.
- Ashton NJ, et al: Plasma p-tau231: um novo biomarcador para a patologia incipiente da doença de Alzheimer. Ata Neuropathol 2021; 141: 709-724.
- Buerger K, et al: A proteína tau no LCR fosforilada na treonina 231 está correlacionada com o declínio cognitivo em indivíduos com DCL. Neurology 2002; 59: 627-629.
- Horie K, et al: CSF MTBR-tau243 is a specific biomarker of tau tangle pathology in Alzheimer’s disease. Nature Medicine 2023; 29(8): 1954-1963.
- Lantero-Rodriguez J, et al: CSF p-tau205: um biomarcador da patologia da tau na doença de Alzheimer. Ata Neuropathol 2024; 147: 1-17.
- Olsson B, et al: Biomarcadores do LCR e do sangue para o diagnóstico da doença de Alzheimer: uma revisão sistemática e meta-análise. Lancet Neurol 2016; 15: 673-684.
- Santangelo R, et al: O rácio CSF p-tau181/Aβ42 oferece uma boa precisão “in vivo” no diagnóstico diferencial da demência de Alzheimer. Curr Alzheimer Res 2019; 16: 587-595.
- Schindler SE, et al: Head-to-head comparison of leading blood tests for Alzheimer’s disease pathology (Comparação direta das principais análises ao sangue para a patologia da doença de Alzheimer). Alzheimer’s & Dementia (2024), doi: 10.1002/ALZ.14315.
- Hampel H, et al: Biomarcadores baseados no sangue para a doença de Alzheimer: estado atual e utilização futura num panorama global de cuidados de saúde transformado. Neurónio 2023; 111: 2781-2799.
- Hansson O, et al: Recomendações de utilização adequada da Associação de Alzheimer para biomarcadores sanguíneos na doença de Alzheimer. Alzheimer & Dementia 2022; 18: 2669-2686.
- Hansson O, Blennow K, Zetterberg H, Dage J: Biomarcadores sanguíneos para a doença de Alzheimer na prática clínica e em ensaios. Nat Aging 2023; 3: 506-519.
- Álvarez-Sánchez L, Peña-Bautista C, Baquero M, Cháfer-Pericás C: Novas tecnologias de deteção ultra-sensíveis para a identificação de biomarcadores sanguíneos precoces e minimamente invasivos da doença de Alzheimer. Journal of Alzheimer’s Disease 2022; 86: 1337-1369.
- Blennow K, et al: O valor clínico potencial dos biomarcadores plasmáticos na doença de Alzheimer. Alzheimer & Dementia 2023; 19: 5805-5816.
- Ashton NJ, et al: Precisão de diagnóstico de um imunoensaio de Tau 217 fosforilado no plasma para a patologia da doença de Alzheimer. JAMA Neurol 2024; 81: 255-263.
- Alcolea D, Beeri MS, Rojas JC, et al: Biomarcadores sanguíneos em doenças neurodegenerativas: Implicações para o Neurologista Clínico. Neurologia 2023; 101: 172-180.
- Palmqvist S, et al: Discriminative Accuracy of Plasma Phospho-tau217 for Alzheimer Disease vs Other Neurodegenerative Disorders. JAMA 2020; 324: 772-781.
- Kim KY, Shin KY, Chang KA: GFAP as a Potential Biomarker for Alzheimer’s Disease: A Systematic Review and Meta-Analysis (GFAP como um Potencial Biomarcador para a Doença de Alzheimer: Uma Revisão Sistemática e Meta-Análise). Cells 2023: 12.
- Yakoub Y, et al: Trajectórias longitudinais de biomarcadores sanguíneos na doença de Alzheimer pré-clínica. Alzheimers Dement 2023; 19: 5620-5631.
- Stevenson-Hoare J, et al: Plasma biomarkers and genetics in the diagnosis and prediction of Alzheimer’s disease. Brain 2023; 146: 690-699.
- Nwamekang Belinga L, et al: Circulating Biomarkers for Alzheimer’s Disease: Unlocking the Diagnostic Potential in Low- and Middle-Income Countries, Focusing on Africa [Biomarcadores Circulantes para a Doença de Alzheimer: Desbloqueando o Potencial de Diagnóstico em Países de Baixo e Médio Rendimento, com Foco em África]. Neurodegener Dis 2024; 24: 26-40.
InFo NEUROLOGIE & PSCHIATRIE 2024; 22(6): 14-19