O espectro de opções de tratamento sistémico para a dermatite atópica está actualmente em curso. Nos últimos anos, foi demonstrado que a via de sinalização interleucina (IL)-13 desempenha um papel essencial na patogénese da dermatite atópica. Enquanto a Dupilumab biológica inibe a sinalização IL-4/IL-13 e já está estabelecida na prática, Tralokinumab e Lebrikizumab abordam especificamente a IL-13. Os dados do estudo até agora são muito promissores.
Com base nos avanços na decifração da base imunopatológica da dermatite atópica, foram desenvolvidos conceitos de tratamento que visam especificamente os mecanismos imunitários de tipo 2 [1]. Terapias inovadoras sob a forma de anticorpos monoclonais específicos e as chamadas “pequenas moléculas” inauguraram uma nova era. Os agentes anti-inflamatórios e imunomoduladores correspondentes podem ser utilizados em doentes afectados por dermatite atópica moderada a grave e combinar efeitos de tratamento altamente eficazes com um perfil de segurança favorável, pelo que as várias opções terapêuticas devem ser adaptadas às respectivas características do doente no sentido de medicina personalizada. Este é um avanço significativo nas opções de tratamento para esta doença cutânea angustiante, uma vez que as opções de terapia sistémica convencional são muito limitadas tanto em termos de duração de utilização como de perfil de risco-benefício, e a terapia tópica por si só não é normalmente suficiente.
Via de sinalização Interleukin (IL)-13 como um alvo terapêutico
O dupilumab de anticorpos monoclonais – o primeiro biólogo aprovado para dermatite atópica – liga-se ao receptor IL-4 (IL-4Rα), impedindo a sinalização tanto da IL-4 como da IL-13 [1]. Estudos recentes identificaram a IL-13 como a citocina de tipo 2 mais abundante na pele lesional em dermatite atópica e mostraram que o nível de expressão de
IL-13 em lesões cutâneas correlacionadas com a gravidade da doença [2–6]. Pensa-se que a sobreexpressão da IL-13 na pele da dermatite atópica contribui para o ciclo vicioso da inflamação, perturbação da barreira cutânea e disbiose microbiana [2,3]. Tralokinumab, também um anticorpo monoclonal, neutraliza especificamente a IL-13 através da ligação a esta citocina, impedindo a interacção com o receptor IL-13Rα1 [1]. Esta é a base das propriedades anti-inflamatórias e imunomoduladoras do tralokinumabe. Uma biologia que também visa a IL-13 é o lebrikizumab. Este anticorpo monoclonal IgG4 liga-se a um epitópo IL-13 que impede o complexo IL-13/IL-13Rα1 de formar um heterodímero com IL-4Rα [2].
Tralokinumab: estudo bem sucedido na fase III como monoterapia e com TCS
A eficácia e segurança da terapia de 52 semanas de tralokinumab em dermatite atópica foi investigada nas duas ECZTRA 1 (n=802) e ECZTRA 2 (n=794) multinacionais fase III RCT [7]. Em ambos os estudos, o tralokinumab 300 mg cada quinzena (q2w) foi significativamente superior ao placebo em termos de melhorias nos parâmetros primários IGA 0/1 e EASI-75 às 16 semanas. Além disso, vários pontos finais secundários tais como prurido, DLQI, Dermatite Atópica de Pontuação (SCORAD), e distúrbios do sono relacionados com o eczema manifestaram melhorias significativas com tralokinumab [7].
Outro estudo fase III controlado aleatoriamente – ECZTRA 3 – avaliou a eficácia e segurança do tralokinumab 300 mg q2w em combinação com um corticosteróide tópico (TCS) em 380 doentes com dermatite atópica moderada a grave [8]. A terapia on-demand com cortisona aplicada localmente foi o creme de furoato de mometasona 0,1% (esteroide classe III), aplicado uma vez por dia às lesões activas. Na semana 16 do ensaio ECZTRA 3, significativamente mais pessoas no braço tralokinumab atingiram EASI-75 e IGA 0/1 (56,0% e 38,9%, respectivamente) do que no braço placebo, onde os valores correspondentes foram 35,7% e 26,2% (p<0,001 e p=0,015, respectivamente) (Fig. 1) [8]. O braço tralokinumab também se revelou superior em termos de EASI-90 (32,9 vs. 21,4%; p=0,022) e EASI-50 (79,4 vs. 57,9%; p<0,001). As análises também mostraram que nas semanas 15-16, os pacientes tratados com tralokinumab utilizaram cerca de 50% menos esteróides tópicos do que o grupo placebo (p=0,002). Aqueles que atingiram o ponto final primário na semana 16 foram novamente aleatorizados 1:1 para continuar o tratamento tralokinumab q2w ou para reduzir a dosagem para q4w. Cerca de 90% dos doentes conseguiram manter a resposta na semana 16 a semana 32 com ambos os regimes de dosagem [9].
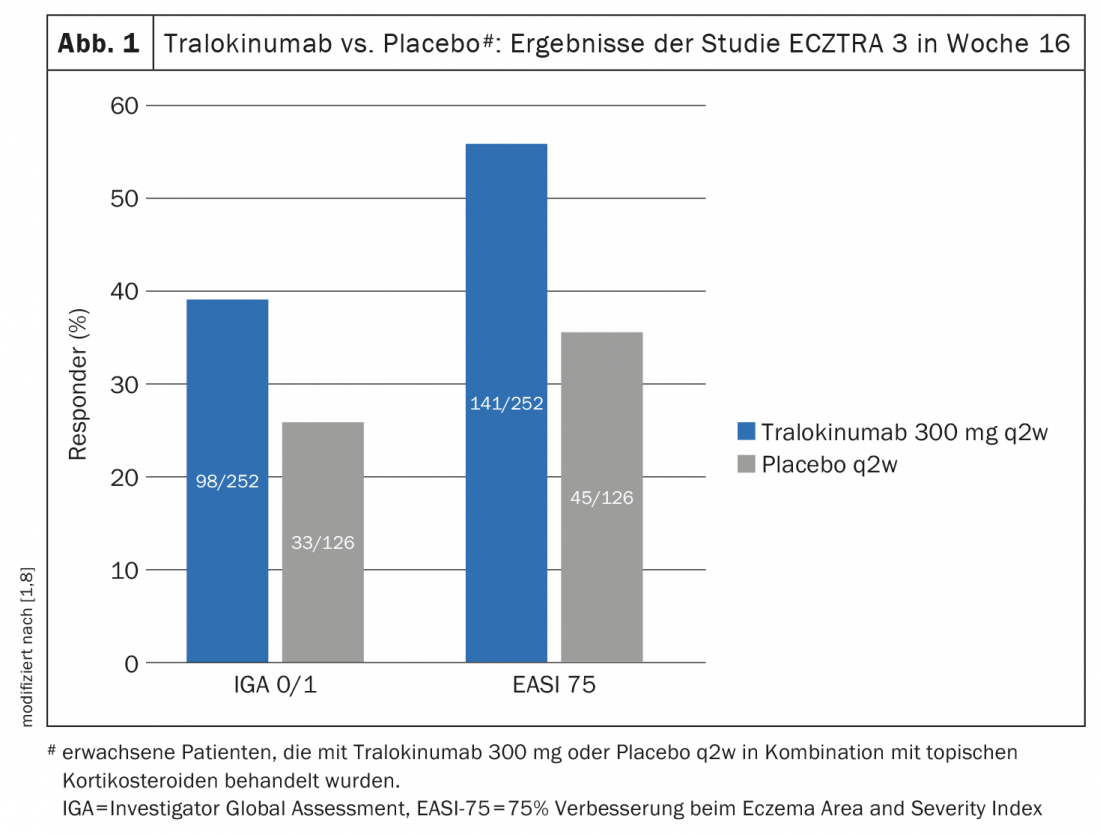
Em particular, o estudo ECZTRA 3 compara bem com a prática quotidiana na dermatite atópica: Se as SCT por si só não forem eficazes, a terapia sistémica é iniciada. Para evitar uma recaída, ambos os tratamentos são idealmente continuados em paralelo [1].
Lebrikizumab: Estudo de dose-fasede II concluído
Estudos da Fase IIb de lebrikizumabe em adultos mostraram uma eficácia dose-dependente sem aumento significativo da incidência relativa de conjuntivite [11]. Um total de 280 pacientes (idade média de 39,3 anos, 59,3% mulheres) foram aleatoriamente atribuídos a um dos seguintes ramos de estudo: 125 mg a cada 4 semanas (n=73), 250 mg a cada 4 semanas (n=80) ou 250 mg a cada 2 semanas (n=75) ou placebo. Na semana 16, o tratamento com lebrikizumab mostrou uma melhoria estatisticamente significativa na percentagem média de alterações no EASI menos quadrados em comparação com placebo. As diferenças em relação ao placebo manifestaram-se já na 4ª semana e continuaram a acentuar-se até à 16ª semana. Além disso, um número significativamente maior de doentes alcançou uma resposta IGA 0/1, bem como EASI50, EASI75 e EASI90 na semana 16 na dose de 250 mg lebrikizumab em comparação com placebo.

Globalmente, os resultados dos ensaios clínicos até à data sugerem que o lebrikizumabe é outra opção de tratamento eficaz e bem tolerada para a dermatite atópica moderada a grave. A eficácia e segurança desta terapia biológica para a manutenção e como tratamento a longo prazo tem sido testada em ensaios de fase III desde 2019 [12,13]. A US Food and Drug Administration (FDA) concedeu recentemente o estatuto de “fast-track” a este anticorpo monoclonal [10].
Literatura:
- Wollenberg A, Weidinger S, Worm M, Bieber T: J Dtsch Dermatol Ges 2021; 19(10): 1435-1442.
- Bieber T: Alergia 2019; 75: 54-62.
- Tubau C, Puig L: Perito Rev Clin Immunol 2021; 17: 15-25.
- Tsoi LC, et al: J Invest Dermatol 2019; 139: 1480-1489.
- Szegedi K, et al: J Eur Acad Dermatol Venereol 2015; 29: 2136-2144.
- Marbach-Breitrück E, et al: Skin Pharmacol Physiol 2019; 32: 192-200.
- Wollenberg A, et al: Br J Dermatol 2021; 184: 437-449.
- Silverberg JI, et al: Br J Dermatol 2021; 184: 450-463.
- Wohlrab J, et al: Dermatologista 2021; 72(4): 321-327.
- Tuttle KL, Forman J, Beck LA: Int J Womens Dermatol 2021; 7(5Parte A): 606-614.
- Guttman-Yassky E, et al: JAMA dermatology 2020; 156(4): 411-420.
- ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04146363, (último acesso 24.01.2022)
- ClinicalTrials.gov, https://clinicaltrials.gov/ct2/show/NCT04178967, (último acesso 24.01.2022)
- Wei W, et al: J Dermatol 2018; 45: 150-157.
- Langan SM, Irvine AD, Weidinger S: Lancet 2020; 396: 345-360.
- Wollenberg A, et al: J Eur Acad Derm Venereol 2020; 34: 2717-2744.
- Adtralza®, aprovação da EMA em Junho de 2021, https://ec.europa.eu/health/documents/community-register/html/h1554.htm, (último acesso 24.01.2022)
- Cork MJ, Danby SG, Ogg GS: J Dermatolog Treat 2020; 31(8): 801-809, www.researchgate.net/publication/336708334_Atopic_dermatitis_epidemiology_and_unmet_need_in_the_United_Kingdom
PRÁTICA DA DERMATOLOGIA 2022; 32(1): 26-28