Um tumor primário colorrectal assintomático com metástases hepáticas síncronas não ressecáveis deve ser ressecado inicialmente ou apenas se houver uma boa resposta após a quimioterapia? Esta questão foi novamente discutida na 23ª Semana Europeia Unida de Gastroenterologia. Um estudo retrospectivo sugere uma equivalência entre as duas abordagens. Outro estudo centrou-se no seguimento após a cirurgia curativa de tumores AJCC fase II-III. No Simpósio sobre Cancro Gastrointestinal de 2016, em São Francisco, houve notícias empolgantes sobre o cancro rectal localmente avançado.
O cancro colorrectal é o terceiro cancro mais comum a nível mundial e ocupa o quarto lugar entre as causas de morte [1]. O sítio primário da metástase é o fígado, sendo a metástase hepática detectada em sincronia com o diagnóstico do tumor primário em cerca de 20% dos doentes. Noutros 25%, as metástases hepáticas desenvolvem-se após um intervalo de tratamento para o carcinoma colorrectal (metástases metacrónicas).
A grande maioria dos doentes com cancro colorrectal de fase IV tem metástases hepáticas não previsíveis no momento do diagnóstico. A ressecabilidade é agora definida principalmente pela possibilidade de ressecção R0 das metástases e pelo volume de tecido hepático saudável que permanece no pós-operatório (pelo menos 30% do volume hepático) [2]. Em doentes com cancro colorrectal metastático e metástases hepáticas não recicláveis, o valor da ressecção paliativa inicial do tumor primário seguida de quimioterapia de primeira linha versus quimioterapia imediata seguida de ressecção para uma boa resposta não é claro [3–6]. Esta questão é também o tema de estudos clínicos.
Novos dados da UEGW
Uma análise retrospectiva sobre o tema foi apresentada na Semana Europeia Unida de Gastroenterologia (UEGW) em Barcelona [7]. Foram incluídos 148 pacientes com cancro colorrectal e metástases hepáticas síncronas não previsíveis. Os pacientes foram observados durante uma média de 45,5 meses. 57% dos pacientes foram tratados com quimioterapia inicial, seguida, no máximo, de ressecção tumoral primária e quimioterapia pós-operatória suplementar para redução de metástases hepáticas (grupo 1). Os outros 43% foram submetidos a excisão cirúrgica do tumor primário, seguida, no máximo, de quimioterapia de primeira linha para redução das metástases hepáticas (grupo 2). As características de base dos dois grupos de estudo eram comparáveis. O principal desfecho foi a sobrevivência global após uma mediana de 48 meses.
Grupo 1: 34 dos 85 pacientes deste grupo acabaram por ser submetidos a uma ressecção colorrectal. Destes, 33 receberam quimioterapia de segunda linha. Em dez casos, a cirurgia de emergência teve de ser realizada durante a primeira quimioterapia: duas perfurações e quatro obstruções exigiram ressecção com estoma, dois pacientes receberam um estoma sem ressecção e dois um stent metálico auto-expansível. A sobrevivência global foi de 15,3%. As metástases hepáticas foram ressecadas após uma boa resposta à quimioterapia de conversão em 20% dos pacientes e tratadas ablativamente com radiofrequência percutânea em 16%.
Grupo 2: 42 dos 63 pacientes deste grupo receberam quimioterapia após a cirurgia (mediana após 1,43 meses). A sobrevivência global foi de 19%. A ressecção das metástases hepáticas foi possível em 30,2% dos casos, a ablação percutânea por radiofrequência foi realizada em 19% dos casos.
Ambos os tratamentos são igualmente eficazes?
Os dois grupos não diferiram significativamente em termos de taxas de sobrevivência (15,3% vs. 19%; p=0,633). Contudo, ao comparar pessoas que receberam ressecção colorrectal com as que não foram operadas na população total, foram encontradas diferenças significativas (p=0,025). No segundo grupo, a taxa de ressecções por metástase hepática foi mais elevada, mas não significativamente (20% vs. 30,2%; p=0,056). Os regimes de quimioterapia eram comparáveis, mas no primeiro grupo os anticorpos monoclonais anti-VEGF e -EGFR foram utilizados com maior frequência em geral (53,8% vs. 22,5%; p=0,014) e o tratamento foi interrompido com maior frequência devido à progressão da doença. Na análise multivariada, a idade (>65 anos) e a ausência de cirurgia de metástase hepática foram factores prognósticos negativos relevantes (Tab. 1) . Considerando apenas os pacientes operados e tratados com quimioterapia em ambos os grupos, foi demonstrada uma melhor sobrevivência com quimioterapia pós-operatória, uma percentagem de gânglios linfáticos profundos e idade inferior a 65 anos.
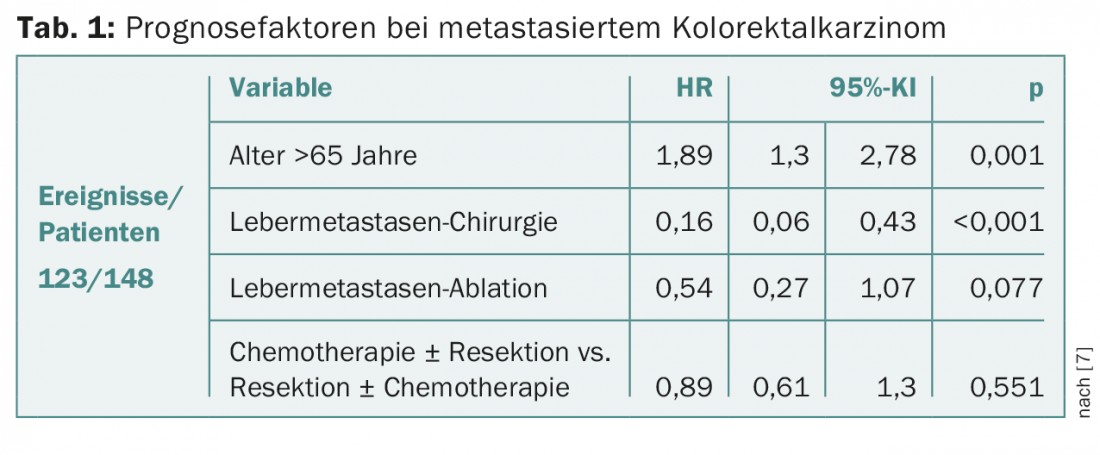
Os autores concluem que, tendo em conta as limitações de uma análise retrospectiva, ambas as vias de tratamento são igualmente eficazes. De facto, no carcinoma colorrectal sincronizado, é geralmente o controlo das metástases ou do curso da doença que é decisivo para o prognóstico e não o estado de ressecção do tumor primário.
Pós-operatório após cirurgia curativa
O objectivo do acompanhamento pós-operatório do carcinoma colorrectal é diagnosticar uma recidiva (assintomática) numa fase precoce, a fim de provocar uma nova ressecção curativa e, ergo, uma extensão do tempo de sobrevivência. Um estudo português, também apresentado no congresso [8], testou os efeitos do acompanhamento estruturado intensivo durante cinco anos em 404 pacientes com cancro colorrectal AJCC fase II-III após cirurgia curativa (separador. 2).

O programa do Instituto Português de Oncologia de Lisboa Francisco Gentil (IPOLFG) consistiu numa história periódica e num exame físico, na recolha dos marcadores tumorais CEA e CA 19-9, numa TAC tórax/abdomen/pelvis e numa colonoscopia (Tab. 3) . O ponto final primário foi a taxa de ressecções recorrentes com intenção curativa.

Em média, o acompanhamento durou 37 meses. O programa de seguimento mostrou boa precisão diagnóstica para a detecção de recidivas (AUC 0,885). A taxa de recorrência foi de 12,9%, com a maioria dos casos detectados nos primeiros três anos (88,4%). As metástases foram significativamente mais frequentes do que as recidivas locorregionais (86,5% vs. 13,5%). Um aumento dos marcadores tumorais foi responsável pela detecção em 46% dos casos, TAC em 40%, colonoscopia em 8% e sintomas em 6%. 21 pacientes foram submetidos a ressecção curativa. Aqui, a sobrevivência de 2 anos foi de 95,2%, enquanto que foi de 59,9% para recidivas não previsíveis (p=0,016). Idade superior a 70 anos (RR 5,43; 95% CI 1,33-22,17; p=0,018) e localização do tumor no cólon (RR 0,237; 95% CI 0,064-0,873; p=0,030) foram significativamente associados à ausência de espectabilidade de recorrência.
Segundo os autores, este programa intensivo de acompanhamento pós-operatório mostra assim um claro benefício: dos 52 pacientes (12,9%) com recidiva detectada, quase metade, ou seja 21 pacientes (40,3%), puderam ser submetidos novamente a ressecção curativa.
ASCO-GI: Novo regime para o cancro rectal localmente avançado
Em comparação com cinco semanas de quimioterapia/radioterapia, que é o tratamento pré-operatório padrão para o cancro rectal localmente avançado em muitos países, um curso de radioterapia mais curto (cinco dias) seguido de três ciclos de dois dias de quimioterapia de consolidação durante um período de sete semanas produziu resultados igualmente bons com melhor tolerabilidade (e custos mais baixos). O ensaio correspondente da fase III foi apresentado no Simpósio dos Cânceres Gastrointestinais de 2016 em São Francisco [9]. O estudo incluiu 515 pacientes com cancro rectal localmente avançado (fase cT3 ou cT4 sem metástases distantes). Um grupo recebeu 5-FU, Leucovorin® e oxaliplatina juntamente com radioterapia (50,4 Gy), o outro FOLFOX-4 uma semana após os cinco dias de radioterapia (5× 5 Gy). É de notar que a adição de oxaliplatina não satisfaz actualmente a norma comum.
Um número igual de pacientes dos dois braços poderia ser submetido a uma cirurgia radical. Após três anos, a sobrevivência sem doenças não diferiu significativamente. A sobrevivência global mostrou uma tendência a favor do regime mais curto (73% vs. 64,5%; p=0,055). Além disso, houve significativamente menos efeitos secundários agudos (74% vs. 83%; p=0,007).
Os autores também vêem grande potencial de radioterapia mais curta, especialmente para pacientes com metástases no fígado ou pulmões, uma vez que permite que a quimioterapia seja iniciada muito mais cedo para o controlo de metástases.
Fonte: 23rd United European Gastroenterology Week, 24-28 October 2015, Barcelona; Gastrointestinal Cancers Symposium, 21-23 January 2016, San Francisco.
Literatura:
- Ferlay J, et al: Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015 Mar 1; 136(5): E359-386.
- Clavien PA, et al: Estratégias para uma cirurgia hepática mais segura e transplante de fígado parcial. N Engl J Med 2007 Abr 12; 356(15): 1545-1559.
- Venderbosch S, et al: Valor prognóstico da ressecção de tumor primário em doentes com cancro colorrectal em fase IV: Análise retrospectiva de dois estudos randomizados e uma revisão da literatura. Ann Surg Oncol 2011; 18(12): 3252-3260.
- Ferrand F, et al: Impact of primary tumour resection on survival of patients with colorectal cancer and synchronous metastases treated by chemotherapy: results from the multicenter, randomised trial Federation Francophone de Cancerologie Digestive 9601. Eur J Cancer 2013; 49: 90-97.
- Poultsides GA, et al: Resultado de tumor primário em pacientes com cancro colorrectal em fase síncrona IV recebendo quimioterapia combinada sem cirurgia como tratamento inicial. J Clin Oncol 2009; 27: 3379-3384.
- McCahill LE, et al: Primary mFOLFOX6 Plus Bevacizumab Without Resection of the Primary Tumor for Patienting With Surgically Unresectable Metastatic Colon Cancer and an Intact Asymptomatic Colon Cancer: Definitive Analysis of NSABP Trial C-10. J Clin Oncol 2012; 30(26): 3223-3228.
- Arolfo S, et al: Câncer Colorectal com Metástases Hepáticas Sincronizadas e Inerectáveis. Qual é o melhor tratamento? UEGW 2015; P1677.
- Rodrigues RV, et al: Acompanhamento Intensivo após Cirurgia Curativa do Cancro Colorrectal. UEGW 2015; P1671.
- Bujko K, et al: Neoadjuvant chemoradiation for fixed cT3 or cT4 rectal cancer: Resultados de um estudo polaco II multicêntrico fase III. Simpósio dos Cânceres Gastrointestinais de 2016; Resumo 489.
InFo ONCOLOGy & HaEMATOLOGy 2016; 4(1): 48-50