As embolias cardiogénicas são principalmente trombos embolizados a partir do ouvido atrial esquerdo em fibrilação atrial. A profilaxia primária e secundária de eventos cerebrais isquémicos baseia-se na sua causalidade, se esta puder ser determinada, e inclui anticoagulação oral ou medidas correctivas tais como o encerramento de um forame oval persistente, defeito do septo atrial ou exclusão do apêndice atrial esquerdo para evitar as complicações crescentes a longo prazo da anticoagulação oral ou um elevado risco de embolia na ausência de anticoagulação.
O AVC (enfarte cerebral ou apoplexia), que é cerca de 85% isquémico, é a segunda causa de morte mais comum após a doença coronária, tem uma incidência anual de cerca de 250 por 100.000 pessoas na Europa Ocidental e é a causa mais comum de incapacidade permanente, muitas vezes com graves consequências psicossociais e económicas. A mortalidade permanece elevada a 25% (50% em doentes com menos de 65 anos) apesar dos avanços médicos no tratamento agudo nas últimas duas décadas. [1–3]. Mais de 80% dos êmbolos clinicamente aparentes afectam a circulação cerebral, 80% dos quais estão na circulação anterior (carótida) e 20% na circulação posterior.
O coração como local de formação de trombos e assim fonte de êmbolos foi mencionado pela primeira vez num relatório de caso de Gowers em 1875 [4]. Técnicas de imagem como a ecocardiografia transoesofágica (TÖE), a tomografia computorizada com reconstrução angiográfica, a sonografia Doppler e a ressonância magnética podem ser utilizadas para documentar ou, pelo menos, suspeitar altamente de algumas das fontes de embolia no contexto clínico actual.
Uma proporção de todos os AVC isquémicos (20 – 33%) que é subestimada devido à detecção directa frequentemente impossível é chamada cardiogénica-embólica. Entre estes, a fibrilação atrial (VF) desempenha o papel mais significativo (Fig. 1).
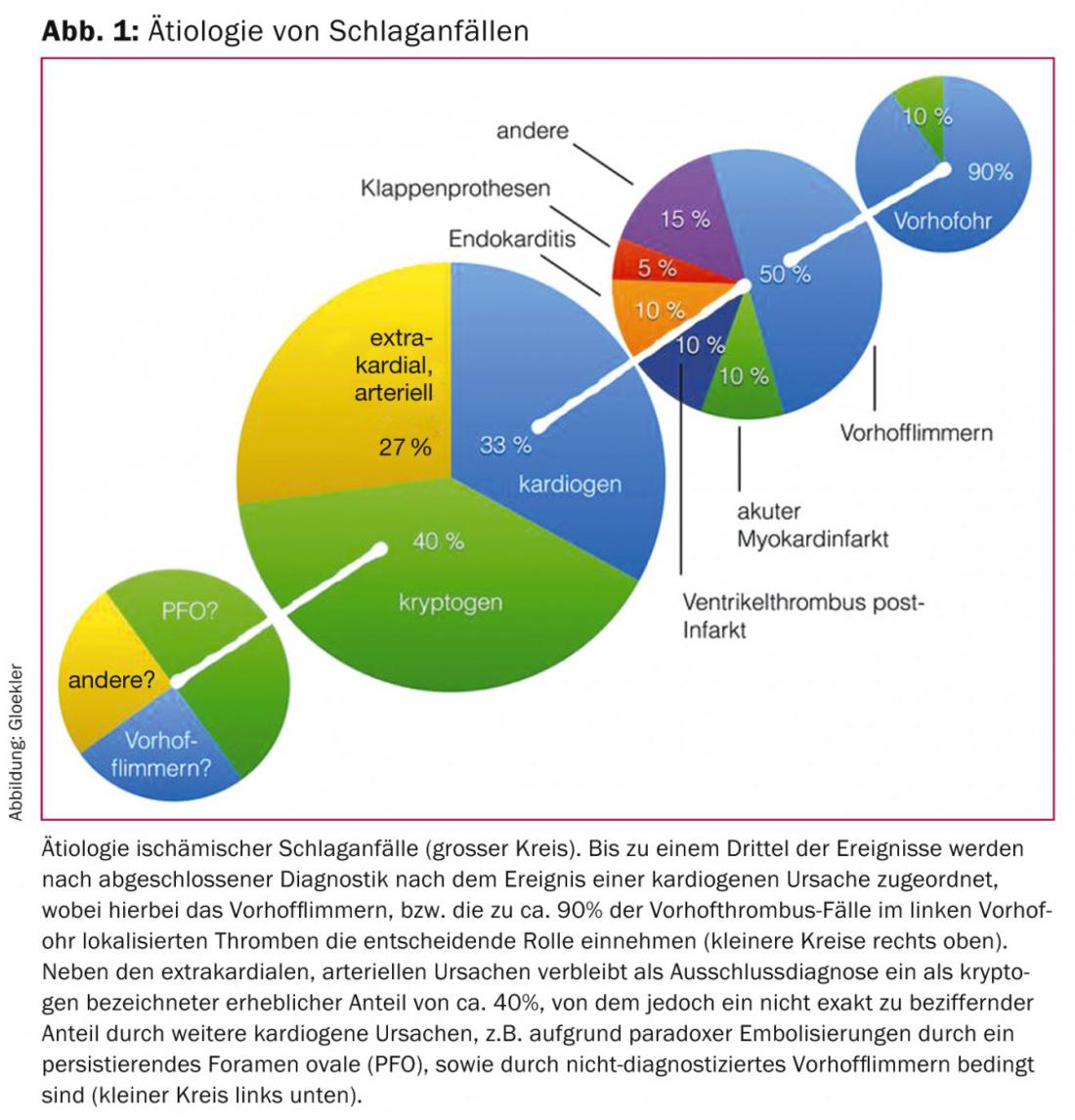
Em FV, a formação de trombos ocorre em mais de 90% dos casos no tubo atrial esquerdo, um resíduo cego de uma veia pulmonar primordial.
Em cerca de 40% de todos os AVC, não são encontradas causas cardíacas ou extracardíacas objectiváveis no curto espaço de tempo do trabalho de diagnóstico após um evento. Tais traços são, portanto, frequentemente chamados criptogénicos (inexplicáveis) – mas esta categoria é sobrestimada. Os AVC criptogénicos não são, em princípio, possíveis e reflectem as nossas fraquezas diagnósticas. Por exemplo, a presença de um forame oval persistente (PFO) ou defeito do septo atrial (ASD) raramente é esclarecida e não é reconhecida como uma causa convencional de AVC, mesmo num caso positivo. Mesmo a FV não detectada raramente é descartada com a máxima consistência. Assim, o número de acidentes vasculares cerebrais (trans)cardíacos é mais elevado do que geralmente se supõe. Se os enfartes cerebrais estiverem presentes em diferentes áreas actuais, isto sugere uma fonte remota de embolia e a FV, a PFO e as veias pulmonares não avaliáveis vêm à tona como fontes de embolia.
Espera-se que a terapia correctiva preventiva possa ser melhorada e que seja utilizada com maior frequência.
Fibrilação atrial, causa mais comum de embolia cardiogénica
Cerca de 20% de todos os AVC isquémicos são atribuídos ao embolismo cardiogénico devido à FV. A FV é a arritmia mais comum com um aumento contínuo da prevalência e incidência (melhor detecção e aumento da idade média da população) nas últimas décadas. A sua prevalência é superior a 7% nas mulheres e mais de 10% nos homens com mais de 80 anos de idade [5,6] (Fig. 1).
Em dois estudos recentemente publicados que monitorizaram o ritmo cardíaco de pacientes após AVC criptogénico em comparação com um ECG Holter padrão, utilizando um gravador implantável ou um gravador de eventos de 30 dias (estudo CRYSTAL AF [7] e estudo EMBRACE [8]), a fibrilação atrial paroxística foi documentada significativamente mais frequentemente em pacientes com o método de registo prolongado (12,4 vs. 2,0% durante um ano no CYSTAL AF, e 16,1 vs. 3,2% durante três meses no EMBRACE). 16,1 contra 3,2% durante três meses em EMBRACE). Como resultado, um número significativamente maior de pacientes nos grupos com monitorização melhorada receberam protecção contra acidentes vasculares cerebrais recorrentes através do início da anticoagulação oral (OAC). A FV é subdiagnosticada e, portanto, subtratada no contexto da descoberta da fonte para o AVC isquémico.
Tratamento padrão com anticoagulação permanente
Ambos os clássicos OAK permanentes com antagonistas de vitamina K (VKA) ou agentes mais recentes do tipo antagonista não-vitamínico K anticoagulação oral (NOAK) reduzem a incidência de AVC isquémico e morte em dois terços e um quarto, respectivamente, e são eficientes na profilaxia de eventos isquémicos [9–13]. No caso do OAK clássico, contudo, existe uma clara subutilização antecipada devido a sangramento ou risco acrescido de sangramento (por exemplo, em caso de risco de queda) [14–16]. Por exemplo, até 44% dos pacientes com fibrilação atrial não recebem qualquer CCO como protecção contra eventos embólicos [17]. Num grande estudo sueco do registo nacional de AVC com mais de 21.077 pacientes após AVC isquémico em fibrilação atrial, as taxas de interrupção de tratamento para OAK foram documentadas em cinco terciais durante os primeiros dois anos após uma apoplexia: Após dois anos, em vez dos 89% iniciais dos doentes, apenas 45% dos doentes foram protegidos da recidiva da apoplexia pelo OAK (Fig. 2) [18].
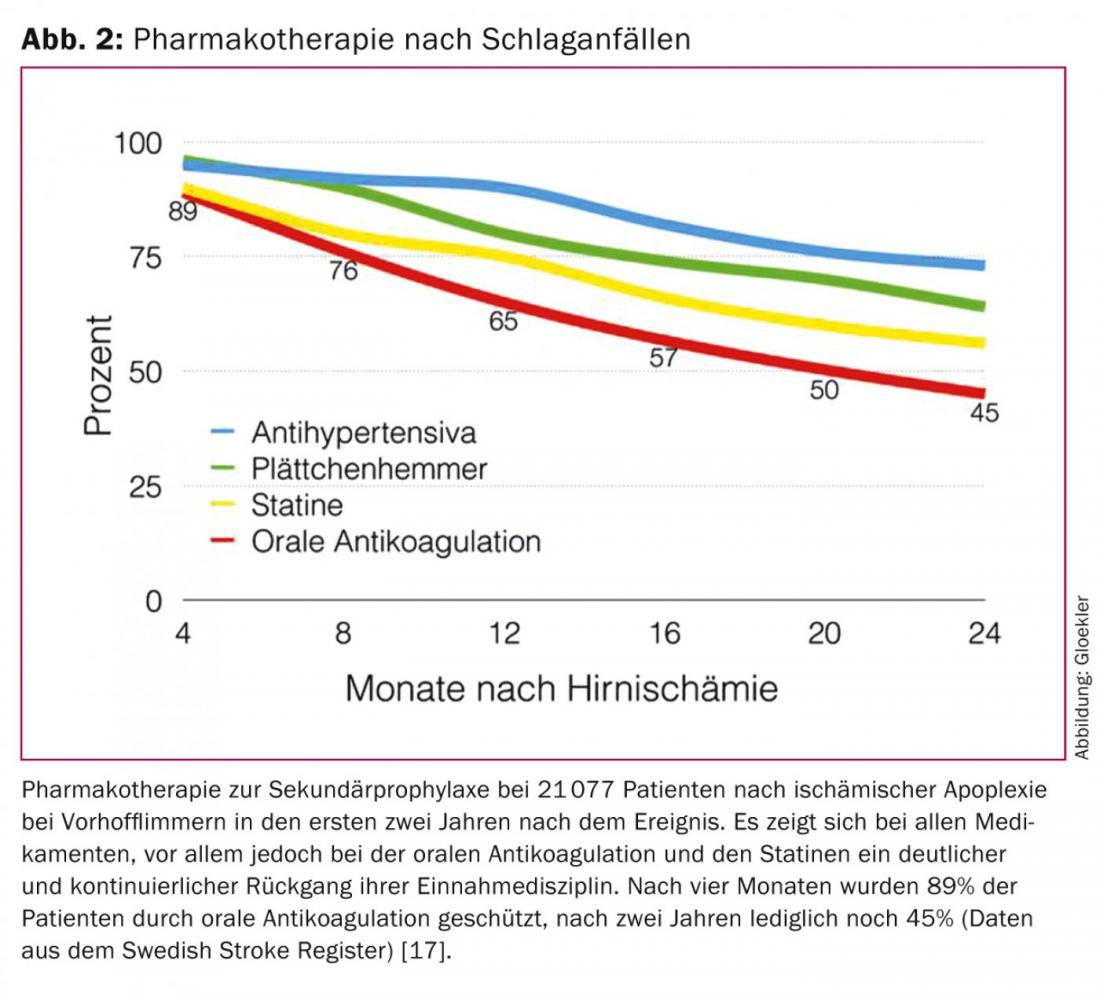
O problema da elevada taxa de descontinuidades terapêuticas para o OAK é também conhecido de outros estudos e da prática clínica diária. Outra limitação é que em 30-46% dos doentes que continuam com HAI, o valor INR (International Normalised Ratio) está fora do intervalo terapêutico, com protecção embólica inadequada (INR <2) ou um risco acrescido de hemorragia (INR >3) [13,19]. Se uma CCO puder ser administrada numa base permanente, a protecção embólica deve ser paga com taxas anuais de sangramento relevante até 15%, que tendem a aumentar ao longo dos anos [10–12].
Nos grandes ensaios de registo dos três NOAK aprovados na Suíça: RE-LY (“Dabigatran Randomised Evaluation of Long-Term Anticoagulation Therapy”) [10]ROCKET AF (“Rivaroxaban Uma vez por dia, oral, inibição directa do Factor Xa em comparação com o antagonismo da vitamina K para prevenção de AVC e Ensaio de Embolia em Fibrilação Atrial”) e ARISTOTLE (“Apixaban para Redução de AVC e Outros Eventos TromboemboLíquicos em Fibrilação Atrial”), bem como o edoxaban, que ainda não está aprovado na Suíça: ENGAGE AF-TIMI 48 (“Edoxaban versus Warfarin in Patients with Atrial Fibrillation”) tem demonstrado consistentemente que o NOAK é equivalente ou superior ao clássico OAK no que diz respeito à profilaxia da apoplexia. O risco de hemorragia intracraniana grave e especialmente fatal é significativamente reduzido com o NOAK em comparação com o OAK clássico, mas a taxa de hemorragia gastrointestinal é ligeiramente aumentada [10–13]. Para a utilização dos NOAKs, consulte um artigo de revisão recentemente publicado [20].
Apesar das vantagens dos NOAK sobre os NOAK clássicos, foi documentada uma taxa de descontinuação de 17-27% nos estudos individuais mesmo com NOAK, bem como uma taxa de hemorragia anual de 3,1 (RE-LY) a 14,4% (ROCKET AF), dependendo da classe de risco das diferentes populações do estudo. Outra desvantagem, porém, sobrevalorizada, é a falta de meios fiáveis para uma rápida reversão da anticoagulação em caso de hemorragia com risco de vida.
Assim, mesmo com os NOAK, é da natureza das coisas que uma anticoagulação adequada implica sempre uma certa taxa de hemorragia relevante.
Fechamento do tubo atrial esquerdo como uma profilaxia alternativa de AVC
Devido ao facto bem documentado de estudos patológicos, cirúrgicos e de imagem que mais de 90% de todos os trombos em FV têm origem no saco cego do apêndice atrial esquerdo (LVO), bem como aos riscos de OAC sistémico e NOAC ad infinitum, a exclusão do LVO da corrente sanguínea por oclusão cirúrgica ou baseada em cateter é uma opção [21,22]. O método cirúrgico foi publicado pela primeira vez pela Madden em 1949 [23], mas não obteve aceitação geral devido a resultados de exclusão incompletos e à falta de estudos comparativos.
A eficácia e segurança do conceito de uma intervenção única em vez de uma anticoagulação permanente para atingir o objectivo comum de uma profilaxia eficaz do AVC com poucos efeitos secundários poderia ser demonstrada pela primeira vez de forma aleatória no ensaio PROTECT AF. [24] e é apoiado pelo recentemente publicado ensaio PREVAIL, que também foi aleatorizado. [25] sustentado: Um encerramento VHO único com o sistema WATCHMAN é pelo menos competitivo com o OAK permanente com warfarin. A partir de dados actualmente não publicados com o período de observação prolongado do ensaio PROTECT AF, é lógico assumir uma superioridade do encerramento VHO baseado em cateteres sobre a anticoagulação contínua, uma vez que o benefício líquido do encerramento VHO em comparação com a anticoagulação contínua aumenta com o aumento da duração após a intervenção. Curiosamente, este benefício líquido foi mais pronunciado em doentes de alto risco [26]. Para o Amplatzer Cardiac Plug, que em comparação com a configuração tipo tampa do sistema WATCHMAN tem um corpo que oclui o lúmen da VHO e um disco que sela o óstio da VHO, é feito de nitinol e é implantado de acordo com o princípio dummy, existem dados semelhantes de estudos mais pequenos e não aleatórios (Figs 3 e 4) [27–30].
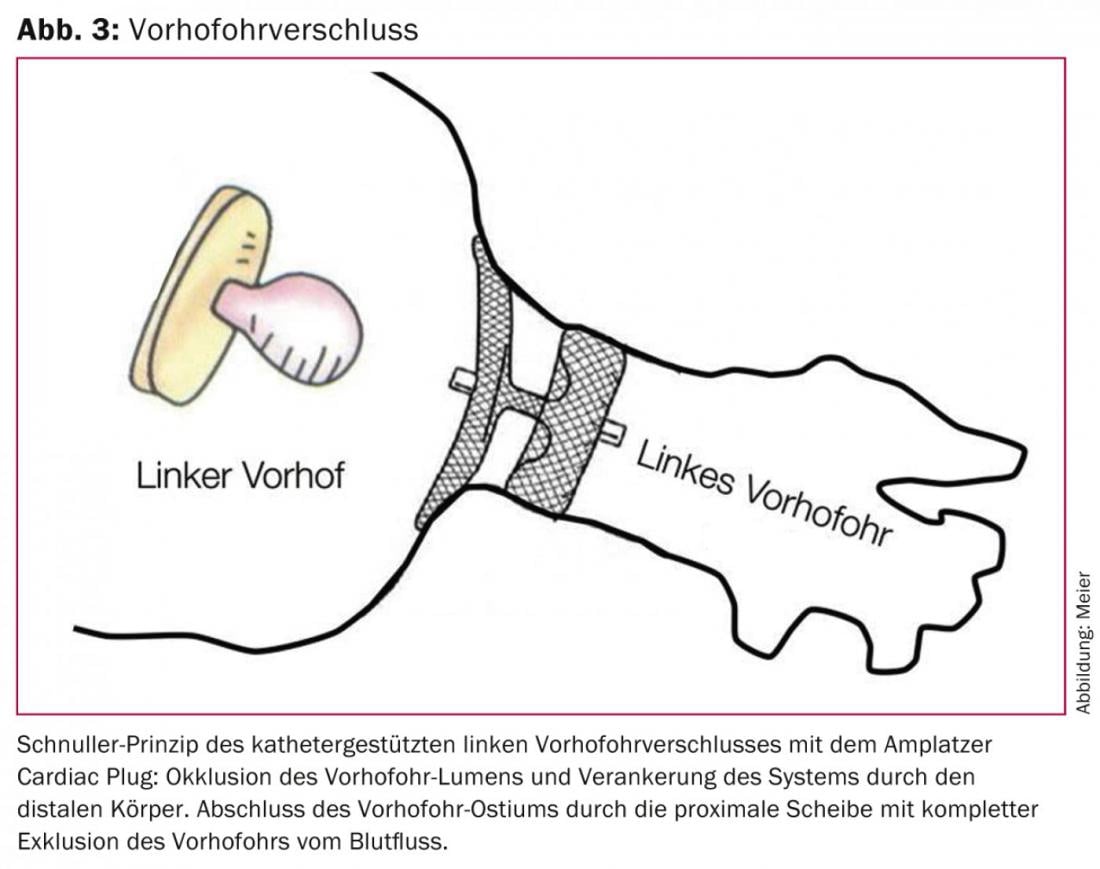
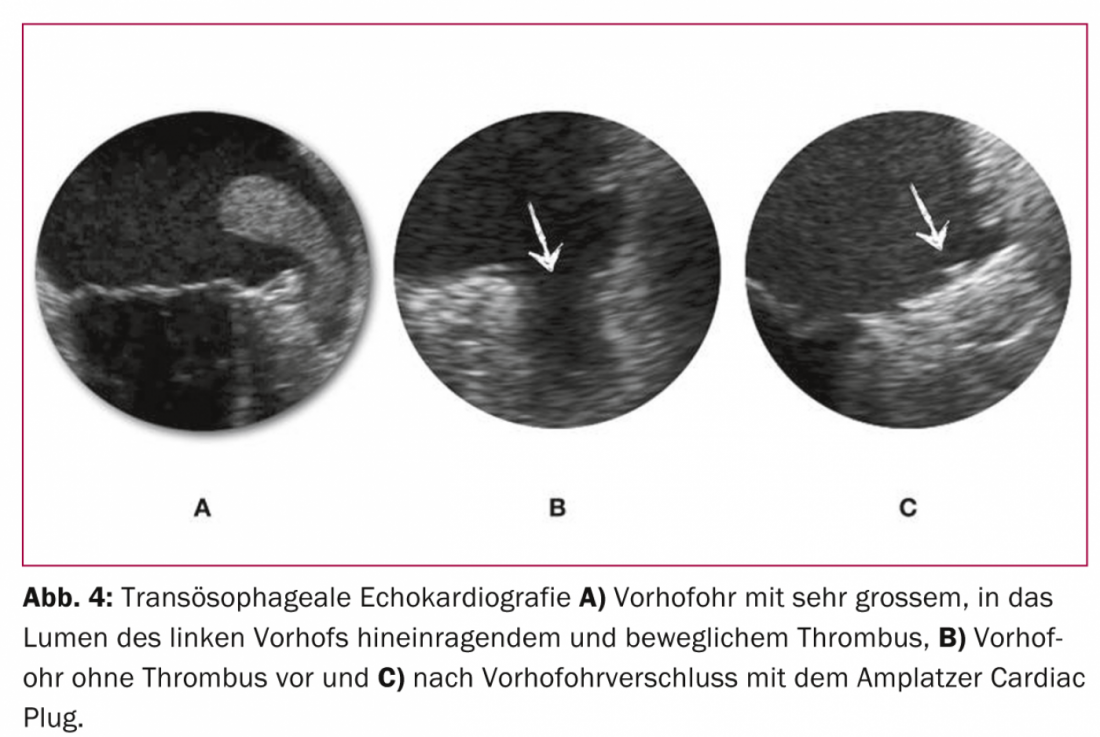
Como qualquer intervenção, o encerramento da VHO tem uma certa taxa de complicações. Com mais de 400 pacientes tratados actualmente no nosso centro com o sistema Amplatzer e sem anestesia geral ou do dedo do pé, o parâmetro de segurança combinado de complicações relevantes (morte, acidente vascular cerebral, tamponamento pericárdico ou necessidade de revisão cirúrgica) é de 8,5%. Isto é comparável a uma taxa anual de hemorragia importante de aproximadamente 4% com rivaroxaban no ensaio ROCKET AF [11], que estudou pacientes com risco comparável de eventos cerebrovasculares e hemorragias. Em princípio, portanto, as taxas previstas das complicações periprocedurais pontuais do encerramento da VHO devem ser ponderadas em relação às das complicações cumulativas do (N)OAK. Assim, com uma esperança de vida residual aproximada de três anos ou mais, pode ser assumido um benefício clínico e prognóstico líquido do encerramento da VHO sobre a anticoagulação permanente. Isto é confirmado por dados ainda não publicados do ensaio PROTECT AF, com provas, pela primeira vez, de uma redução significativa da mortalidade por todas as causas a favor do encerramento da VHO.
Com base nestes dados, o encerramento VHO baseado em cateter é uma alternativa equivalente à anticoagulação permanente a médio prazo e superior a longo prazo. Os estudos comparativos com a NOAK terão de esperar. Devido à eficácia comprovada da oclusão VHO e às limitações dos NOAK, pode assumir-se que a oclusão VHO é fundamentalmente competitiva ou mesmo superior devido às diferenças conceptuais na profilaxia dos derrames cerebrais.
Embora a ablação por radiofrequência baseada em cateteres seja uma terapia válida para controlar os sintomas, não é curativa e raramente salva a profilaxia de AVC por (N)OAK ou oclusão VHO baseada em cateteres a longo prazo. É, portanto, uma valiosa adição à profilaxia do AVC em vez de uma alternativa [31].
Embolia paradoxal devido a forame oval persistente ou defeito do septo atrial
Uma ligação entre os traços criptogénicos e a PFO foi descrita já em 1877 por Julius Conheim e mais tarde por numerosos outros [32]. A procura de um PFO é um procedimento diagnóstico padrão após um evento cerebrovascular em todos os pacientes, especialmente em pacientes mais jovens que ainda não têm aterosclerose [33]. Em comparação com o muito mais raro ASD, que são verdadeiros defeitos estruturais no septo, o PFO é uma fenda ou túnel residual devido à fusão incompleta das duas partes do septo interatrial no período pós-natal. Após a publicação dos três ensaios aleatorizados CLOSURE I (“Avaliação do Sistema de Fechamento Septal STARFlex em Pacientes com um AVC e/ou Ataque Isquémico Transitório devido a Embolia Paradoxal Presumida através de
a Patent Foramen Ovale”) [34]PC (“Clinical Trial Comparing Percutaneous Closure of patient Foramen Ovale Using the Amplatzer PFO Occluder with Medical Treatment in Patients with Cryptogenic Embolism”). [35] e RESPECT (“Randomized Evaluation of Recurrent Stroke Comparing PFO Closure to Established Current Standard of Care Treatment”). [36]A situação permanece controversa tendo em conta as limitações inerentes a cada estudo, tais como o tipo de sistema de encerramento, o número de pacientes e a duração do período de observação. Estes estudos não conseguiram demonstrar uma superioridade significativa do encerramento do PFO em relação à terapia medicamentosa [34–38]. Contudo, pelo menos em subgrupos com grandes shunts, aneurismas septais ou a coincidência de estruturas como uma valvula eustachii ou redes de Chiari, pode-se assumir a superioridade do encerramento da PFO sobre a terapia medicamentosa. Em termos de segurança de procedimentos, o sistema Amplatzer é superior ao sistema Starflex testado no estudo CLOSURE I [39]. Devido ao pequeno número de eventos nos três ensaios aleatorizados, falta-lhes o poder estatístico assumido quando foram concebidos: por exemplo, no ensaio CLOSURE I, de 909 doentes, 5,5 versus 6,8% (p=0,37) atingiram o desfecho combinado de AVC, ataque isquémico transitório (AIT) e embolia sistémica durante um período de seguimento de dois anos, e 2,9 versus 3,1% (p=0,79) atingiram o desfecho de AVC apenas [34]. No estudo PC, outro estudo prospectivo e randomizado com 414 pacientes, que, tal como o estudo RESPECT, realizou o fecho PFO com os sistemas amplificadores (Fig. 5) em comparação com a terapia medicamentosa durante um período de seguimento de dois a quatro anos, 3,4 (n=7) contra 5,2% (n=11) atingiram o ponto final combinado de morte, AVC, TIA ou embolia sistémica (p=0,34) [35]. No estudo RESPECT, 980 pacientes foram aleatorizados e acompanhados durante 2,5 anos: Nove pacientes do grupo de oclusão contra 16 pacientes do grupo de fármacos sofreram um evento cerebrovascular durante este período (p=0,08) [36]. Haverá mais recolha de dados nestes dois estudos e é provável que, com um período de acompanhamento prolongado, a tendência anterior a favor do encerramento do PFO com o sistema Amplatzer se altere para uma diferença significativa.
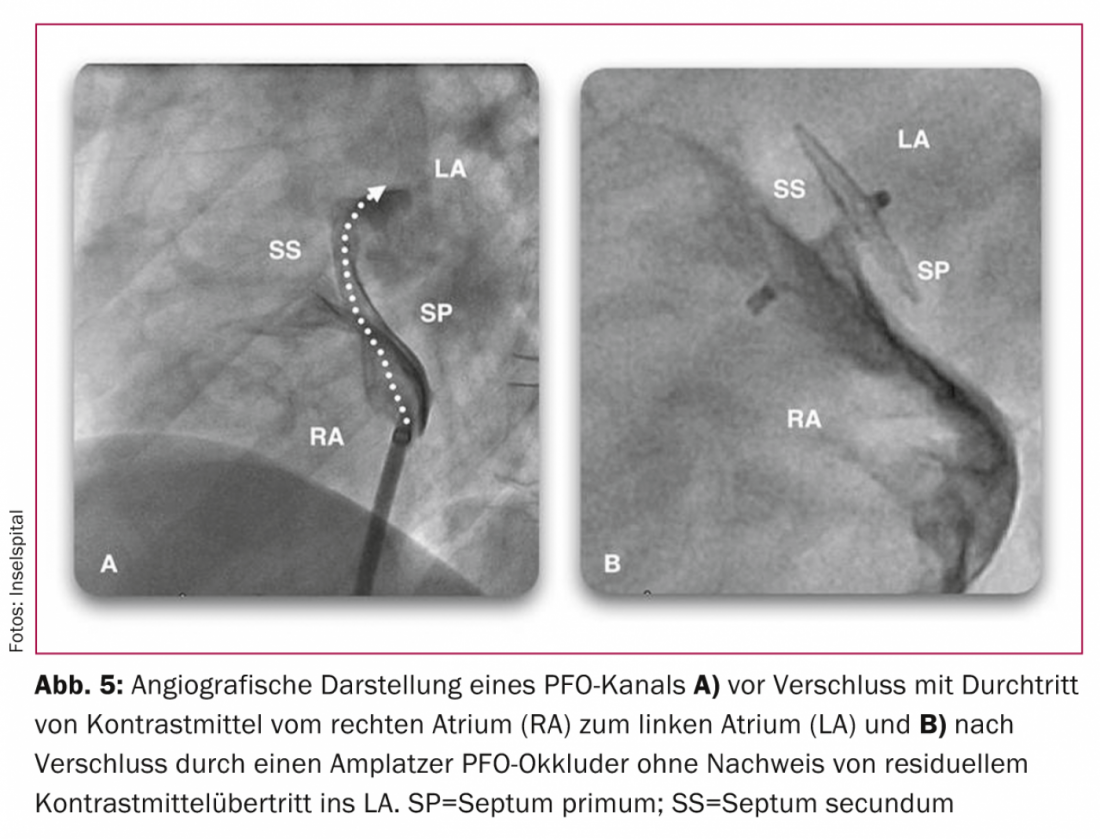
Consistente com os resultados esperados da próxima recolha de dados dos ensaios PC e RESPECT, num estudo de observação a longo prazo comparando os dois grupos utilizando a correspondência de propensão com um período médio de observação de nove anos, demonstrou-se que o encerramento do PFO era superior à terapia medicamentosa em 308 pacientes no que diz respeito à obtenção do ponto final combinado (11 contra 21%, p=0,033). Mesmo um benefício significativo de sobrevivência do encerramento PFO foi demonstrado quando se compararam anos de observação com ou sem encerramento PFO [40]. Uma meta-análise mostrou uma redução de risco de 84% para eventos neurológicos recorrentes (um evento contra cinco por 100 doentes-anos) e uma diferença significativa a favor do encerramento do PFO em doentes idosos e com aneurismas do septo atrial ou trombofilia [41].
Devido ao número relativamente pequeno de casos com duração de seguimento ainda insuficiente, ao baixo número de eventos neurológicos e à qualidade variável dos sistemas de encerramento, os três grandes estudos acima mencionados ainda não mostram individualmente uma clara superioridade significativa do encerramento da PFO em relação à terapia puramente medicamentosa, mas mostram uma tendência sólida nesta direcção. Por conseguinte, pode assumir-se que, a médio prazo, as provas do tempo de observação prolongado dos estudos anteriores, metanálises ou estudos novos e mais conclusivos provarão a superioridade do encerramento da PFO na profilaxia secundária de eventos cerebrovasculares isquémicos. O encerramento do PFO tecnicamente fácil de realizar com uma excelente taxa de sucesso de quase 100% e praticamente sem complicações deveria, tendo em conta os efeitos potencialmente catastróficos de qualquer evento cerebrovascular, com base na visão global dos dados actuais, estar disponível para cada paciente para uma profilaxia secundária no sentido de uma vacinação mecânica, especialmente os de idade mais jovem com aneurismas septal ou shunts maiores. Além de alguns efeitos secundários úteis como a redução da enxaqueca, apneia do sono ou mesmo enfartes do miocárdio devido a oclusões coronárias paradoxal-embólicas, uma anticoagulação associada a uma vida inteira e cumulativamente de alto risco pode assim ser evitada. Para evitar um AVC ao longo de 20 anos, apenas nove fechos PFO precisam de ser realizados.
Outras fontes cardiogénicas de embolia
Além da fibrilação atrial e PFO, trombos cardíacos em infartos agudos do miocárdio ou como consequência tardia de infartos transmurais do miocárdio, embolias na estenose mitral, síndrome do seio doente, mixomas atriais, bem como depósitos trombóticos em próteses mecânicas ou biológicas da válvula ou embolias sépticas em endocardite são causas raras de apoplexia (Fig. 1).
Dependendo da gravidade dos resultados, a primeira fase do tratamento é o início da anticoagulação oral, seguida de exames de imagem. Em segundo lugar, a remoção cirúrgica deve ser considerada na ausência de resolução de trombos, coágulos flutuantes, tumores ou endocardite florida.
Todo o leito venoso da veia pulmonar é uma fonte potencial não visível de insultos cerebrais embólicos. Deve tornar-se cada vez mais o foco dos estudos clínicos a este respeito.
PD Dr. med. Steffen Gloekler
Potenciais conflitos de interesse: Bernhard Meier recebeu apoio de investigação institucional e honorários de orador da St. Jude Medical.
Literatura:
- Go AS, et al. (Comité de Estatísticas da Associação Americana do Coração e Subcomité de Estatísticas do Acidente Vascular Cerebral): Estatísticas de doenças cardíacas e acidentes vasculares cerebrais – actualização de 2014: um relatório da Associação Americana do Coração. Circulação 2014; 129: e28-e292.
- Lozano R, et al: Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380: 2095-2128.
- Feigin VL, et al. (Global Burden of Diseases, Injuries, and Risk Factors Study 2010 [GBD 2010] e o GBD Stroke Experts Group): Carga global e regional de AVC durante 1990-2010: resultados do Estudo Global da Carga de Doenças 2010. Lanceta 2014; 383: 245-254.
- Gowers W: Sobre um caso de embolia simultânea da retina central e artérias cerebrais médias. Lanceta 1875; 2: 794.
- Miyasaka Y, et al: Mortality trends in patients diagnosticed with first atrial fibrillation: a 21-year community-based study. J Am Coll Cardiol 2007; 49: 986-992.
- Go S: Prevalência de fibrilação atrial diagnosticada em adultos: implicações nacionais para a gestão do ritmo e prevenção de AVC: o Estudo AnTicoagulation and Risk Factors In Atrial Fibrillation (ATRIA). J Am Med Assoc 2001; 285: 2370-2375.
- Gladstone DJ, et al. (EMBRACE Investigadores e Coordenadores): Fibrilação atrial em doentes com enfarte criptogénico. N Engl J Med 2014; 370: 2467-2477.
- Sanna T, et al. (CRYSTAL AF Investigators): AVC criptogénico e fibrilação atrial subjacente. N Engl J Med 2014; 370: 2478-2486.
- Hart RG, Pearce LA, Aguilar MI: Meta-análise: terapia antitrombótica para prevenir acidentes vasculares cerebrais em pacientes que têm fibrilação atrial não-valvar. Ann Intern Med 2007; 146: 857-867.
- Connolly SJ, et al. (RE-LY Steering Committee and Investigators): Dabigatran versus warfarin em doentes com fibrilhação atrial. N Engl J Med 2009; 361: 1139-1151.
- Patel MR, et al. (ROCKET AF Investigators): Rivaroxaban versus warfarin em fibrilação atrial não-valvar. N Engl J Med 2011; 365: 883-891.
- Granger CB, et al. (Comités e Investigadores ARISTOTLE): Apixaban versus warfarin em doentes com fibrilhação atrial. N Engl J Med 2011; 365: 981-992.
- Giugliano RP, et al. (ENGAGE AF-TIMI 48 Investigadores): Edoxaban versus warfarin em doentes com fibrilhação atrial. N Engl J Med 2013; 369: 2093-2104.
- Casciano JP, et al: Os custos da subutilização e não aderência da varfarina em pacientes com fibrilação atrial: uma perspectiva de seguradora comercial. J Manag Care Pharm 2013; 19: 302-316.
- Gladstone DJ, et al: Traços potencialmente evitáveis em doentes de alto risco com fibrilação atrial que não são adequadamente anticoagulados. Stroke 2009; 40: 235-240.
- Wrigley BJ, Lip GY: Pode o dispositivo WATCHMAN PROTEGER verdadeiramente de um AVC na fibrilação atrial? Lancet Neurol 2009; 8: 877-878.
- Waldo AL, et al. (Comité Director da NABOR): Os pacientes hospitalizados com fibrilação atrial e alto risco de AVC não estão a ser providos de anticoagulação adequada. J Am Coll Cardiol 2005; 46: 1729-1736.
- Glader EL, et al: O uso persistente de drogas preventivas secundárias declina rapidamente durante os primeiros 2 anos após o AVC. Stroke 2010; 41: 397-401.
- Onalan O, et al: Prevenção de derrames não-farmacológicos na fibrilação atrial. Perito Rev Cardiovasc Ther 2005; 3: 619-633.
- Steffel J: Novos anticoagulantes orais – 10 perguntas de uso diário. Cardiovasc 2014; 13: 12-16.
- Blackshear JL, Odell JA: obliteração de apêndice para reduzir AVC em pacientes cirúrgicos cardíacos com fibrilação atrial. Ann Thorac Surg 1996; 61: 755-759.
- Di Biase L, et al: A morfologia do apêndice atrial esquerdo está correlacionada com o risco de acidente vascular cerebral em pacientes com fibrilação atrial? Resultados de um estudo multicêntrico. J Am Coll Cardiol 2012; 60: 531-538.
- Madden JL: Ressecção do apêndice auricular esquerdo; uma profilaxia para embolias arteriais recorrentes. J Am Med Assoc 1949; 140: 769-772.
- Holmes DR, et al. (PROTECT AF Investigators): Fechamento percutâneo do apêndice atrial esquerdo versus terapia com warfarina para prevenção de AVC em doentes com fibrilação atrial: um ensaio aleatório de não-inferioridade. Lancet 2009; 374: 534-542.
- Holmes DR, et al: Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy. J Am Coll Cardiol 2014; 64: 1-12.
- Gangireddy SR, et al: Fecho percutâneo do apêndice atrial esquerdo para prevenção de AVC em doentes com fibrilação atrial: uma avaliação do benefício clínico líquido. Eur Heart J 2012; 33: 2700-2708.
- Park JW, et al: Fechamento do apêndice atrial esquerdo com Amplatzer Cardiac Plug em fibrilação atrial: experiência europeia inicial. Cateter Cardiovasc Interv 2011; 77: 700-706.
- Nietlispach F, et al: Amplatzer left atrial appendage oclusion: Centro único de 10 anos de experiência. Cateter Cardiovasc Interv 2013; 82: 283-289.
- Nietlispach F, et al: Encerramento percutâneo do apêndice atrial esquerdo. Europ Geriat Med 2012; 3: 308-311.
- Nietlispach F, et al: Fecho ad hoc percutâneo do apêndice atrial esquerdo. J Invasive Cardiol 2013; 25: 683-686.
- Calkins H, et al: 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace 2012; 14: 528-606.
- Lechat P, et al: Prevalência de forame oval patenteado em doentes com AVC. N Engl J Med 1988; 318: 1148-1152.
- Meier B, et al: Prevenção de derrames secundários: forame oval patenteado, placa aórtica, e estenose carotídea. Eur Heart J 2012; 33: 705-713, 713a, 713b.
- Furlan AJ, et al. (FECHAR I Investigadores): Encerramento ou terapia médica para AVC criptogénico com forame oval patenteado. N Engl J Med 2012; 366: 991-999.
- Meier B, et al. (PC Trial Investigators): Fechamento percutâneo do forame oval da patente em embolia criptogénica. N Engl J Med 2013; 368: 1083-1091.
- Carroll JD, et al. (RESPECTIVA Investigadores): Encerramento do forame oval patenteado versus terapia médica após enfarte criptogénico. N Engl J Med 2013; 368: 1092-1100.
- Spencer FA, et al: Revisão sistemática do fecho percutâneo versus terapia médica em doentes com AVC criptogénico e forame oval patenteado. BMJ Aberto 2014; 4: e004282.
- Meier B: Foramen ovale de patente, é mais perigoso fechá-lo do que deixá-lo aberto? Cardiovasc Med 2012; 15: 183-185.
- Messé SR, Kent DM: Ainda sem encerramento sobre a questão do encerramento da PFO. N Engl J Med 2013; 368: 1152-1153.
- Wahl A, et al: Comparação a longo prazo da propensão de fechamento percutâneo de foramen oval com tratamento médico após embolia paradoxal. Circulação 2012; 125: 803-812.
- Agarwal S, et al: Meta-análise de fecho de transcatéter versus terapia médica para forame oval patenteado na prevenção de eventos neurológicos recorrentes após presumível embolia paradoxal. JACC Cardiovasc Interv 2012; 5: 777-789.
CARDIOVASC 2014; 13(4): 3-8