Para retardar a progressão da doença renal crónica, existem medidas específicas e não específicas da doença. Os diagnósticos básicos para a insuficiência renal crónica incluem um estado de urina e uma sonografia dos rins. Se a doença renal não corresponder claramente a uma nefropatia hipertensiva ou diabética, um esclarecimento especializado é geralmente útil para tentar um diagnóstico exacto e, se necessário, para permitir uma terapia específica. A melhor medida não específica de inibição da progressão comprovada é o tratamento de doentes proteinúricos com inibidores da ECA ou BAR. Outras medidas incluem controlo adequado da tensão arterial, tratamento da acidose, se necessário, e limitação da ingestão de sal. Os doentes com doença renal crónica são sensíveis a “segundos acertos”. Os AINE, laxantes contendo fosfatos e meios de contraste de raios X contendo iodo devem, portanto, ser evitados.
A incidência e prevalência da doença renal crónica (CKD) tem aumentado de forma constante nas últimas décadas. Eetiologicamente, o CKD pode ser causado por uma grande variedade de doenças renais. Os mais comuns – e também largamente responsáveis pela crescente prevalência do CKD – são a nefropatia diabética e hipertensiva. Para além do risco de desenvolvimento de doença renal em fase terminal, o CKD leva a um aumento significativo da morbilidade e mortalidade cardiovascular [1]. A doença renal crónica representa, portanto, um fardo relevante para o sistema de cuidados de saúde. A maioria dos pacientes de CKD são tratados principalmente por médicos de clínica geral. Por conseguinte, é importante que os pacientes que necessitam de terapia específica sejam identificados a tempo e que medidas não específicas de redução da progressão sejam conhecidas e implementadas.
Tratamento específico de doenças
Como mencionado, uma variedade de doenças renais etiologicamente diferentes pode levar ao CKD. Existem terapias específicas (por exemplo, imunossupressão) para algumas delas. A fim de permitir uma terapia causal, o diagnóstico da doença subjacente deve, por conseguinte, visar um diagnóstico da doença subjacente. Uma boa triagem na prática do médico de família é crucial para assegurar que os pacientes com doenças renais tratáveis específicas sejam vistos nefrologicamente. Aplicam-se as seguintes regras de ouro:
- O diagnóstico básico de cada paciente com função renal relevantemente afectada, que não pode ser explicado prerenalmente e é rapidamente reversível, inclui uma urinálise e uma sonografia dos rins. A sonografia ajuda a excluir uma causa pós-trenal, pode ser diagnosticada em nefropatias císticas e por vezes permite tirar conclusões sobre a cronicidade ou reversibilidade potencial da nefropatia com base no tamanho do rim.
- Os doentes com nefropatia hipertensiva são geralmente mais velhos, mostram uma deterioração progressiva da função renal bastante lenta, normalmente não têm proteinúria relevante (no máximo uma “microalbuminúria”), um sedimento urinário discreto e normalmente um longo historial de hipertensão com outros danos de órgãos terminais hipertensivos. Típico para estes pacientes é também uma capacidade autoregulatória dos rins reduzida com flutuações pronunciadas de creatinina sérica dependendo da hidratação e da pressão sanguínea. Em pacientes mais velhos, muitas vezes não há necessidade de um exame especializado.
- A nefropatia diabética caracteriza-se tipicamente por albuminúria lentamente progressiva seguida de um declínio mais rápido na taxa de filtração glomerular (TFG) em comparação com a nefropatia hipertensiva. Até lá, outras complicações microvasculares (retinopatia) são normalmente encontradas. Se o curso for atípico, vale a pena procurar causas alternativas.
- Nos doentes que não se enquadram numa das categorias acima referidas, especialmente aqueles com proteinúria relevante, sedimento urinário anormal ou diminuição rápida da taxa de filtração glomerular, a clarificação por biopsia renal deve ser considerada e o encaminhamento nefrológico é normalmente indicado. Isto pode ser devido a uma causa tratável específica (por exemplo, vasculite ANCA, nefropatia membranosa, nefropatia IgA, etc.).
Factores de progressão não específicos e o seu tratamento
Uma vez ocorridos os danos renais relevantes, vários mecanismos mal adaptados contribuem para uma maior deterioração da função renal, independentemente da doença subjacente (Fig. 1).
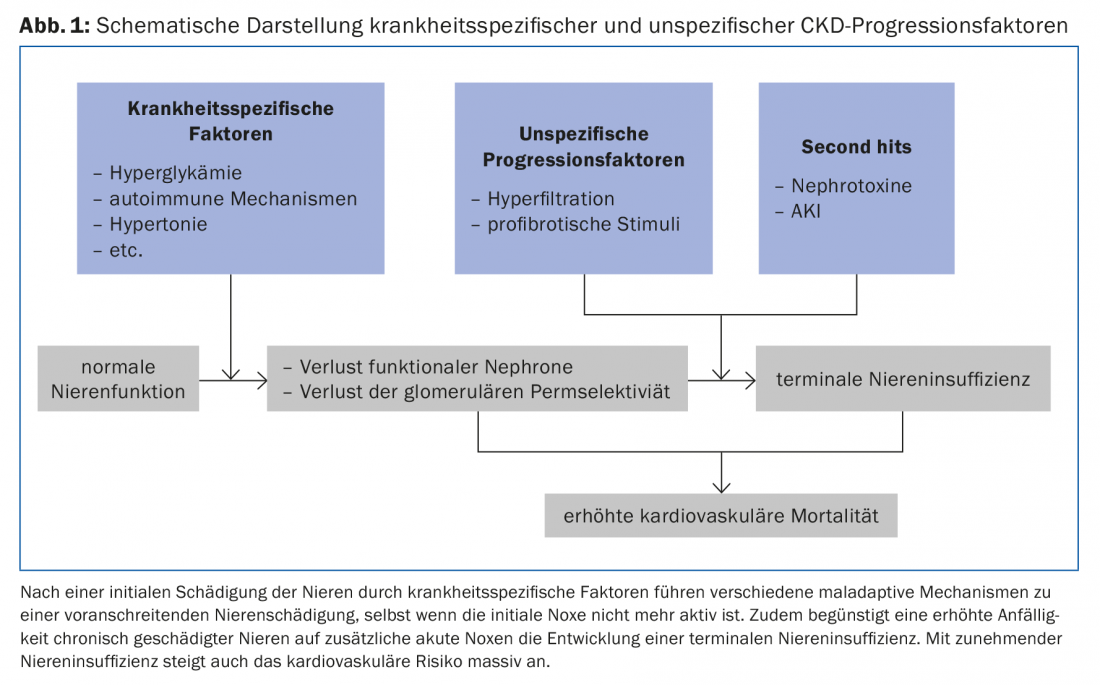
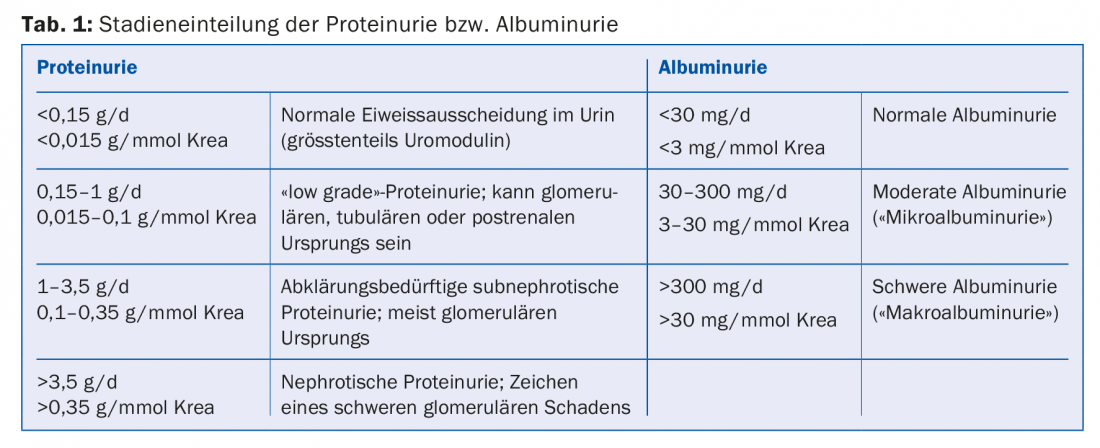
Proteinúria/albuminúria: Proteinúria ou albuminúria é geralmente o resultado da permeabilidade glomerular reduzida (caixa, tab. 1). A sua extensão está correlacionada com a progressão da insuficiência renal [2]. As intervenções que reduzem a proteinúria ou albuminúria também levam a um abrandamento da progressão do CKD. Os inibidores da ECA e os bloqueadores dos receptores de angiotensina (ARB) reduzem a pressão intra-glomerular, a hiperfiltração glomerular e a albuminúria. A sua eficácia na redução da progressão em doentes com CKD com proteinúria está bem estabelecida tanto para diabéticos [3] como para não diabéticos [4]. A dose deve ser aumentada até que a proteinúria tenha sido reduzida ao intervalo alvo (que varia de acordo com a doença renal subjacente) ou até que a dose seja limitada por efeitos secundários inaceitáveis (por exemplo, hipotensão/tontura ortostática) ou até que a dose máxima permitida de fármacos tenha sido atingida. A anteriormente defendida terapia combinada de inibidores da ECA e das ORA foi largamente abandonada.

Hipertensão arterial: A hipertensão arterial pode levar a uma nefropatia hipertensiva, mas também pode promover a progressão de outras doenças renais, pelo que deve ser tratada adequadamente. Para a nefroprotecção, os valores-alvo habituais de <140/90 mmHg parecem ser suficientes em doentes sem albuminúria patologicamente aumentada, e os inibidores da ECA ou ARB não são claramente superiores a outros medicamentos. Em doentes com albuminúria grave e provavelmente também em doentes com albuminúria moderada, é razoável apontar para valores de <130/80 mmHg. Neste caso, um inibidor da ECA ou um ARB deve ser dosado primeiro, e só depois devem ser adicionados outros anti-hipertensivos, se necessário [5]. Na maioria dos doentes com função renal significativamente afectada, o controlo adequado da pressão arterial só pode ser alcançado com a adição de um diurético de laço. Deve mencionar-se que os valores-alvo mencionados se aplicam no que diz respeito à nefroprotecção e o recente estudo SPRINT mostrou um possível benefício de valores-alvo mais baixos na mortalidade por todas as causas [6].
Acidose metabólica e sua correcção: Com o aumento da insuficiência renal, a capacidade de excreção ácida dos rins diminui e desenvolve-se uma acidose metabólica ao longo do tempo, que tem efeitos negativos no metabolismo ósseo e na musculatura, entre outras coisas. Para além destes efeitos extrarrenais, contudo, a exposição aos ácidos também parece danificar os próprios rins [7]. Sabe-se através de estudos observacionais que o bicarbonato sérico está inversamente correlacionado com a progressão em doentes com CKD. No caso de acidose renal, a terapia pode ter como objectivo reduzir a ingestão de ácido através dos alimentos (especialmente proteínas animais) ou neutralizar a ingestão de ácido através de terapia oral com bicarbonato de sódio. Alguns pequenos ensaios aleatorizados mostraram um efeito impressionante de redução da progressão para esta intervenção simples e rentável [6], mas os resultados de ensaios maiores ainda estão pendentes. As desvantagens da terapia com bicarbonato são a elevada “carga de comprimidos” (3-6 cápsulas à 500 mg NaBic são normalmente necessárias para um efeito suficiente) e a ingestão de sódio a ela associada.
Intervenções nutricionais e de estilo de vida: Embora uma influência positiva da actividade física e visando um peso corporal “saudável” (IMC 20-25) na progressão da insuficiência renal não tenha sido formalmente comprovada em estudos controlados, estas intervenções são capazes de influenciar favoravelmente vários factores de risco cardiovascular, bem como a proteinúria.
Uma dieta pobre em proteínas tem sido promovida há muito tempo como medida para reduzir a hiperfiltração glomerular. No entanto, os dados sobre a eficácia da restrição proteica no CKD não são inteiramente claros, e os estudos existentes são anteriores à utilização generalizada dos inibidores da ECA e das ORA. Além disso, uma restrição proteica severa pode levar à desnutrição, o que é muito desfavorável em termos de prognóstico se a diálise for necessária numa fase posterior. Por conseguinte, a restrição proteica severa já não é recomendada actualmente, mas a ingestão excessiva de proteínas (por exemplo, sob a forma de suplementos proteicos para treino de peso) deve ser evitada em doentes com CKD.
O elevado consumo de sal tem sido associado em estudos epidemiológicos com um aumento da pressão arterial, um aumento da proteinúria e uma diminuição mais rápida da taxa de filtração glomerular em doentes renais [8]. Além disso, o elevado consumo de sal reduz grandemente os efeitos antiproteinúricos e prognósticos positivos dos inibidores da ECA e das ORA [9]. A restrição da ingestão de sal a 5-6 g NaCl/dia é recomendada para a maioria dos doentes com insuficiência renal crónica. Se uma restrição adicional é útil ou possivelmente mesmo desfavorável em certos pacientes continua a não ser claro neste momento.
O tabagismo tem sido associado em vários estudos populacionais não só a eventos cardiovasculares mas também a albuminúria e insuficiência renal [10]. Foram também realizados apenas alguns estudos de intervenção sobre a influência da cessação da nicotina no curso do CKD, mas todos estes foram positivos.
Abordagens terapêuticas com efeito incerto ou sem efeito comprovado: Numerosos estudos epidemiológicos mostram uma ligação entre hiperuricemia e insuficiência renal, bem como risco cardiovascular, embora a causalidade ainda não tenha sido completamente esclarecida [11]. Pequenos estudos individuais demonstraram um efeito favorável da terapia uricostática com alopurinol no curso da insuficiência renal crónica. Contudo, uma vez que o alopurinol não está isento de riscos no que diz respeito aos efeitos secundários, especialmente no caso de função renal deficiente, são necessários estudos maiores para recomendar a utilização de alopurinol em doentes com CKD sem gota em princípio e, se necessário, para definir níveis-alvo sensíveis de ácido úrico. O Febuxostat, que não é eliminado renalmente e tem menos efeitos secundários, poderia possivelmente desempenhar aqui um papel no futuro. A hiperlipidemia foi considerada um possível factor de progressão da CKD com base em considerações fisiopatológicas e dados epidemiológicos. Contudo, uma avaliação do estudo SHARP (o maior estudo de redução de lípidos em doentes com CKD) não conseguiu demonstrar um efeito positivo da sinvastatina e ezetimibe na progressão da CKD [12]. Assim, as estatinas não parecem ter um efeito relevante na progressão do CKD, mas são úteis para reduzir o risco cardiovascular em muitos doentes com CKD. Os análogos activos de vitamina D parecem ter um efeito positivo na proteinúria, mas ainda não foi demonstrado um efeito na progressão da insuficiência renal [13].
“Second hits and their prevention: Pre-damaged kidneys are much more sensitive to acute noxae than healthy ones. Isto significa que os doentes com insuficiência renal crónica têm um risco maciçamente aumentado de sofrer lesão renal aguda (LRA) [5], que é frequentemente recuperada de forma incompleta [14].
Os medicamentos anti-inflamatórios não esteróides (AINEs) estão entre os medicamentos mais prescritos em todo o mundo. Em pacientes com insuficiência cardíaca grave ou função renal prejudicada, a inibição da síntese intrarrenal da prostaglandina pode levar a uma redução crítica da perfusão glomerular e desencadear a LRA [15]. Os AINE estão, portanto, contra-indicados em doentes com função renal gravemente afectada e só devem ser utilizados com contenção e a curto prazo em doentes com função renal ligeiramente reduzida [5].
Os meios de contraste de raios X contendo iodo podem levar a danos renais agudos em caso de alteração da função renal pré-existente, desidratação e insuficiência cardíaca descompensada. As medidas mais importantes para a profilaxia da nefropatia de contraste em doentes com CKD são: (a) questionar criticamente a indicação e a consequência terapêutica de um exame, (b) Considerar métodos de exame alternativos dependendo do problema (por exemplo, ultra-som, cintilografia), (c) se um exame com meio de contraste de raios X for inevitável: pré-hidrato, minimizar a quantidade de meio de contraste aplicado e escolher um meio de contraste isoosmolar de raios X [5,16].
Os laxantes contendo fosfatos são ocasionalmente utilizados na preparação da colonoscopia como alternativa aos laxantes contendo polietilenoglicol. No processo, uma quantidade considerável de fosfato é absorvida através do intestino. Com função renal normal, esta carga de fosfato pode ser excretada relativamente depressa através dos rins. No entanto, com o comprometimento da função renal, são atingidos níveis extremamente elevados de fosfato no sangue e a consecutiva concentração muito elevada de fosfato na urina primária pode levar a uma nefropatia aguda do cristal de fosfato de cálcio [17]. Os laxantes que contêm fosfato estão, portanto, contra-indicados com um GFR <60 ml/min/1,73m2 ; outros factores de risco para a nefropatia aguda do cristal de fosfato incluem o esgotamento do volume, diuréticos, inibidores da ECA e a idade [17].
Literatura:
- Matsushita K, et al: Associação de taxa de filtração glomerular estimada e albuminúria com todas as causas e mortalidade cardiovascular em coortes populacionais em geral: uma meta-análise colaborativa. Lancet 2010; 375: 2073-2081.
- Gansevoort RT, et al.: Chronic Kidney Disease Prognosis Consortium. A menor taxa de filtração glomerular estimada e a maior albuminúria estão associadas a resultados renais adversos. Uma meta-análise colaborativa de coortes de população geral e de alto risco. Kidney Int. 2011;80(1): 93-104.
- Kistler AD: Albuminúria em diabéticos: gestão prática. Prática (Berna 1994). 2013;102(20): 1229-35.
- Jafar TH, et al.: Angiotensin-converting enzyme inhibitors and progression of nondiabetic renal disease. Uma meta-análise de dados ao nível do paciente. Ann Intern Med. 2001; 135(2): 73-87.
- KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int Suppl 2013;3(1). (www.kdigo.org/home/guidelines)
- SPRINT Research Group, Wright JT Jr, et al: A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015 Nov 26;373(22): 2103-16
- Kovesdy CP: Acidose metabólica e doença renal: a terapia com bicarbonato retarda a progressão do CKD? Transplante de Nephrol Dial Dial. 2012;27(8): 3056-62.
- Meier P, et al: Sal e insuficiência renal. Swiss Med Forum 2014;14(04): 50-53
- Lambers Heerspink HJ, et al: A moderação do sódio dietético potencia os efeitos protectores renais e cardiovasculares dos bloqueadores dos receptores de angiotensina. Rim Int. 2012;82(3): 330-7.
- Orth SR, et al: Smoking: um factor de risco para a progressão de doenças renais crónicas e para a morbilidade e mortalidade cardiovascular em doentes renais – ausência de provas ou provas de ausência? Clin J Am Soc Nephrol. 2008;3(1): 226-36.
- Jalal DI, et al: O ácido úrico como alvo de terapia em CKD. Am J Kidney Dis. 2013;61(1): 134-46.
- Haynes R, et al. para o Grupo Colaborativo SHARP: Efeitos da Redução do Colesterol LDL na Progressão da Doença Renal. J Am Soc Nephrol. 2014;25(8): 1825-33.
- de Borst MH, et al: Active vitamin D treatment for reduction of residual proteinuria: a systematic review. J Am Soc Nephrol. 2013;24(11): 1863-71.
- Chawla LS, et. al.: Lesão renal aguda e doença renal crónica como síndromes interligadas. N Engl J Med. 2014;371(1): 58-66.
- Harirforoosh S, et al: Efeitos adversos renais de medicamentos anti-inflamatórios não esteróides. Opinião de peritos Drug Saf. 2009;8(6): 669-81.
- KDIGO 2012 Clinical Practice Guideline for Acute Kidney Injury. Kidney Int Suppl 2012;2(1). (www.kdigo.org/home/guidelines)
- Markowitz GS, et. al: Rumo à incidência de nefropatia aguda pelo fosfato. J Am Soc Nephrol. 2007;18(12): 3020-2.
PRÁTICA DO GP 2016; 11(12): 35-38