O cancro do ovário é normalmente apenas diagnosticado numa fase avançada e tem um prognóstico desfavorável. A cirurgia citoreductiva máxima possível é terapêutica e prognostica em primeiro lugar, seguida de quimioterapia contendo platina. Nas fases III-IV sem reoperação planeada, a adição de bevacizumab à primeira quimioterapia e como terapia de manutenção tem sido aprovada há vários meses. O mesmo se aplica à terapia das recaídas sensíveis à platina. A última indicação aprovada é bevacizumab para cancro dos ovários resistente à platina após um máximo de duas terapias prévias com monochemoterapia. As mulheres com cancro dos ovários induzido geneticamente são tratadas da mesma forma que as pacientes com tumores esporádicos, mas agora têm a opção de terapia de manutenção com olaparibe na situação de recaída.
O carcinoma do ovário é o segundo carcinoma mais comum no campo ginecológico e é a causa mais frequente de morte entre estes cancros. Na Suíça, afecta cerca de 600 mulheres por ano (3% de todos os cancros). A idade média no diagnóstico é de 63 anos, 14% das mulheres são mais novas do que 50 anos. 90% dos carcinomas ovarianos são tumores de origem epitelial, os outros são tumores das células germinativas, do estroma ou sarcomatosos ou neoplasias de pequenas células. A OMS divide os carcinomas epiteliais em seis classes histológicas. Os carcinomas serosos ocorrem mais frequentemente (cerca de 80%), e podem ser pouco ou muito agressivos.
Diagnóstico e factores de risco
Os sintomas que frequentemente precedem o diagnóstico não são específicos: dor abdominal, tensão abdominal, problemas de micção e, ao longo do tempo, um aumento da circunferência abdominal ou irregularidades menstruais. Os factores de risco são o número de ovulações (quanto mais ovulações, maior o risco), endometriose, ovários policísticos e um gene BRCA 1 ou 2. Em contraste, nascimentos, amamentação, contracepção oral, ligação das trompas e histerectomia reduzem o risco.
O diagnóstico ocorre geralmente numa fase avançada (FIGO III e IV), o que significa que apenas cerca de 15% dos carcinomas ovarianos estão limitados a apenas um ovário. Os factores relevantes para o prognóstico são a fase, a histologia e uma operação tão completa quanto possível. Infelizmente, o prognóstico do cancro dos ovários como grupo permanece pobre: apenas cerca de 40% dos doentes com estádio FIGO III (metástase fora da pélvis mas intra-abdominal) e apenas cerca de 19% com estádio FIGO IV (metástase distante) sobrevivem cinco anos, sendo estes dados provenientes de antes das opções de tratamento modernas (bevacizumab +/- terapia de manutenção, olaparib, HIPEC).
Clarificação e terapia cirúrgica
Sem o estadiamento cirúrgico ou cirurgia, a extensão exacta da doença não pode ser determinada de forma fiável. As mulheres normalmente consultam primeiro o seu ginecologista, que utiliza a ecografia vaginal para fazer um diagnóstico (Fig. 1) .
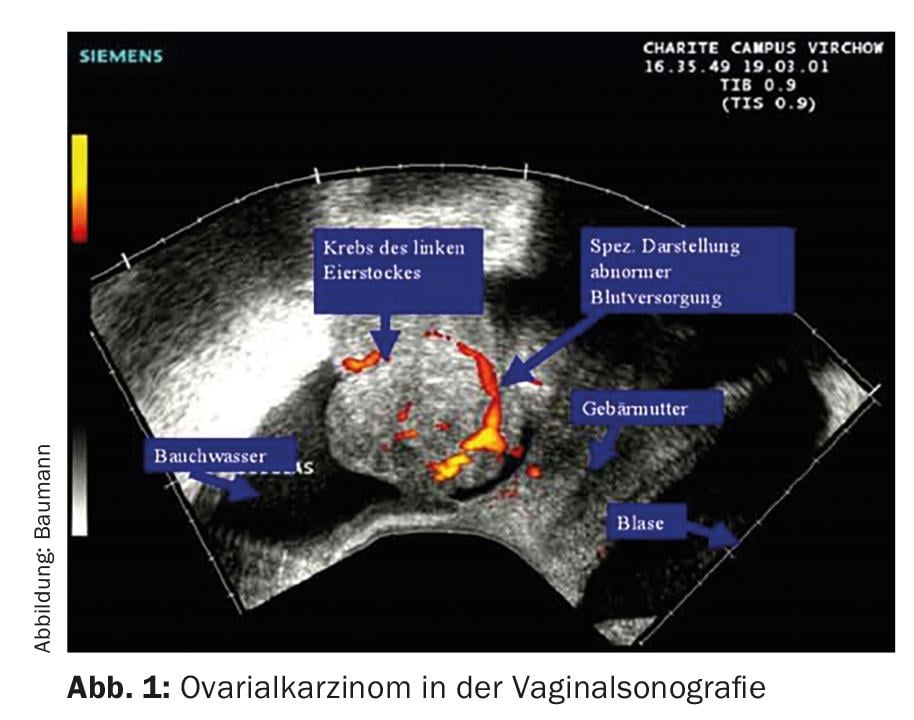
Se houver suspeita de um carcinoma, seguir-se-á uma tomografia computorizada ou um PET-CT (fig. 2) . A determinação do marcador tumoral Ca 125 também pode ser útil.
A operação inclui uma histerectomia, adexectomia bilateral, linfadenectomia retroperitoneal e, dependendo da extensão do tumor, também uma omentectomia infracológica e infragástrica, bem como biópsias peritoneais múltiplas e direccionadas. A experiência do cirurgião (número de procedimentos realizados anualmente) é importante uma vez que o prognóstico é influenciado pelo resultado cirúrgico alcançado (debulking óptimo). Sempre que possível, todos os tumores macroscopicamente visíveis devem ser removidos, ou seja, a operação requer ginecologistas qualificados e possivelmente também cirurgiões viscerais que possam realizar os procedimentos abdominais por vezes maiores, tais como a remoção parcial do intestino, peritonectomias, etc. A terapia do carcinoma ovariano avançado já deve ser discutida pré-operatoriamente de forma interdisciplinar e as possíveis intervenções ou tratamentos também devem ser discutidas. As suas consequências/morbilidades devem ser discutidas previamente com os pacientes. A encenação pós-operatória está de acordo com FIGO ou TNM [1].
Terapia das fases iniciais (FIGO I-IIA)
Nada mudou no tratamento das fases iniciais nos últimos anos. Os pacientes nestas fases (cerca de 20%) têm um melhor prognóstico (sobrevivência de 5 anos 60-90%). Factores como a classificação, ruptura capsular, envolvimento unilateral ou bilateral e a idade do paciente, se houver, são importantes para decidir se deve ser dada terapia adjuvante. Não é recomendada quimioterapia para pacientes com estágio FIGO IA, G1. Na fase IB, os factores adicionais e o estadiamento cirúrgico óptimo são importantes; também aqui, a quimioterapia pode ser frequentemente omitida.
Todos os outros pacientes em fase inicial (todas as fases FIGO II e/ou todas as graduações histológicas superiores a 1) beneficiam de quimioterapia adjuvante contendo platina. Não quero entrar na discussão sobre se o carboplatina por si só é suficiente (seis ciclos) ou se a combinação de carboplatina e paclitaxel é preferível (três ciclos podem ser suficientes, mas seis são normalmente administrados) [2,3].
Terapia de fases avançadas (FIGO IIB-IV)
Nas fases avançadas, uma cirurgia que seja o mais completa possível é particularmente importante. Os pacientes em que não é visível nenhum tumor macroscópico têm o melhor prognóstico. Se o tumor tiver de permanecer, as mulheres com restos de tumor de tamanho inferior a 1 cm têm mais hipóteses do que as mulheres com restos de tumor de tamanho superior a 1 cm. Em pacientes com uma operação principalmente subóptima (por exemplo, sem equipa interdisciplinar – embora necessária), o chamado debulking intervalado pode ser útil. Neste contexto, são dados três ciclos de quimioterapia padrão com carboplatina e paclitaxel em primeiro lugar, seguido de uma segunda cirurgia e mais três ciclos de quimioterapia se houver uma resposta.
Todos os pacientes com fases avançadas foram tratados com seis ciclos de quimioterapia combinada contendo platina (principalmente com paclitaxel) até agora. Adicionar mais medicamentos citostáticos ou executar mais de seis ciclos não mostrou qualquer benefício.
Em 2009, um grupo japonês publicou um artigo com “dose-dense paclitaxel/carboplatina”, que mostrou uma sobrevida global melhor de 72% após três anos, em comparação com 65% no grupo de doentes com terapia padrão [4]. “Dose-dense” significa que o paclitaxel é administrado semanalmente sem pausa, enquanto a carboplatina continua a ser administrada de três em três semanas. Os efeitos secundários (principalmente hematológicos) ocorreram um pouco mais frequentemente no grupo de doentes tratados desta forma. No entanto, existem também esquemas para a aplicação semanal de ambas as substâncias [5].
Terapia com bevacizumab
Uma opção terapêutica mais recente é a adição de bevacizumab à quimioterapia. Bevacizumab inibe todas as isoformas do receptor VEGF-A. Existem agora quatro grandes ensaios que demonstram a eficácia da inibição da angiogénese no cancro dos ovários (GOG 0218 e ICON7 em primeira linha, OCEANS e AURELIA para os recorrentes). Comum a todos os estudos é uma melhoria de 3,5-4 meses na sobrevivência sem progressão (PFS) e na taxa de resposta, mas não na sobrevivência global. Os estudos diferem não só na indicação e concepção, mas também na dosagem de bevacizumab e na duração da terapia. Nestes estudos, a inibição da angiogénese não é apenas utilizada em paralelo com a quimioterapia, mas especialmente como terapia de manutenção. Bevacizumab é a primeira terapia de manutenção a mostrar um benefício.
Bevacizumab é aprovado na Suíça para pacientes com cancro ovariano avançado (FIGO III-IV) em combinação com carboplatina/paclitaxel como terapia inicial se não estiver planeada uma segunda operação ou tratamento. está planeado o descascamento intervalado. Os pacientes recebem bevacizumab 7,5 mg/kgKG a cada três semanas em paralelo com seis ciclos de quimioterapia; depois disso, bevacizumab é administrado como terapia de manutenção a cada três semanas até à progressão ou morte. por um período máximo de 15 meses. O espectro de efeitos secundários do bevacizumab é conhecido de outras terapias tumorais: hipertensão arterial, proteinúria, raramente tromboembolismo e, sobretudo, uma taxa de perfuração intestinal algo aumentada – para além do aumento significativo dos custos da terapia.
Quimioterapia intraperitoneal
Já nos anos 70, foram feitas tentativas para aumentar as hipóteses de sobrevivência de pacientes pré-operados de forma óptima com doses locais elevadas de quimioterapia (intraperitoneal). Este processo muito complexo e demorado tem vindo a ser continuamente melhorado ao longo dos anos. A quimioterapia intraperitoneal é sempre administrada em paralelo com a quimioterapia intravenosa. As substâncias na parte da terapia intravenosa foram parcialmente trocadas e a quimioterapia intraperitoneal com cisplatina e paclitaxel é realizada aquecida (quimioterapia intraperitoneal hipertérmica, HIPEC). Como anteriormente, a toxicidade e as complicações são consideráveis, de modo que esta terapia não é um padrão apesar da vantagem de sobrevivência demonstrada em estudos individuais, mas é cada vez mais utilizada em centros maiores [6]. Foi recentemente publicada uma revisão da utilização e dos benefícios da quimioterapia intraperitoneal em seis grandes centros nos EUA [7]. Ao longo do tempo (2007-2012), o HIPEC tem sido cada vez mais utilizado, mas de acordo com os autores, este procedimento ainda é utilizado em menos de 50% dos doentes elegíveis. A sobrevivência global após três anos foi de 81% no braço HIPEC e 71% no braço padrão.
Terapias recorrentes
Uma vez que a maioria dos doentes com cancro dos ovários avançado sofre uma recaída, coloca-se a questão da terapia de recidiva mais adequada. Para pacientes com um longo intervalo sem terapia, em bom estado geral e com uma recorrência que pode ser removida macroscopicamente no toto, uma segunda operação é uma opção, embora a situação do estudo aqui não seja muito boa. Em casos excepcionais, o HIPEC é também avaliado nesta situação.
A decisão principal é se o carcinoma é sensível à platina (recaída apenas após seis, de preferência doze meses) ou -resistente. Para carcinomas sensíveis, o carboplatina doublet (melhor tolerada, igualmente eficaz como a cisplatina) e o paclitaxel ou, em alternativa, a doxorubicina carboplatina/pegylated liposomal ou a carboplatina/gemcitabina podem ser novamente utilizados. A terapia combinada é também aqui mais eficaz do que a monoterapia [4]. Para a doença refractária da platina (recaída antes de seis meses), devem ser utilizados medicamentos não resistentes à crostas: Gemcitabina, etoposida oral, vinorelbina ou mesmo docetaxel e oxaliplatina. Existem também dados sobre o trabectedin juntamente com Caelyx® [8].
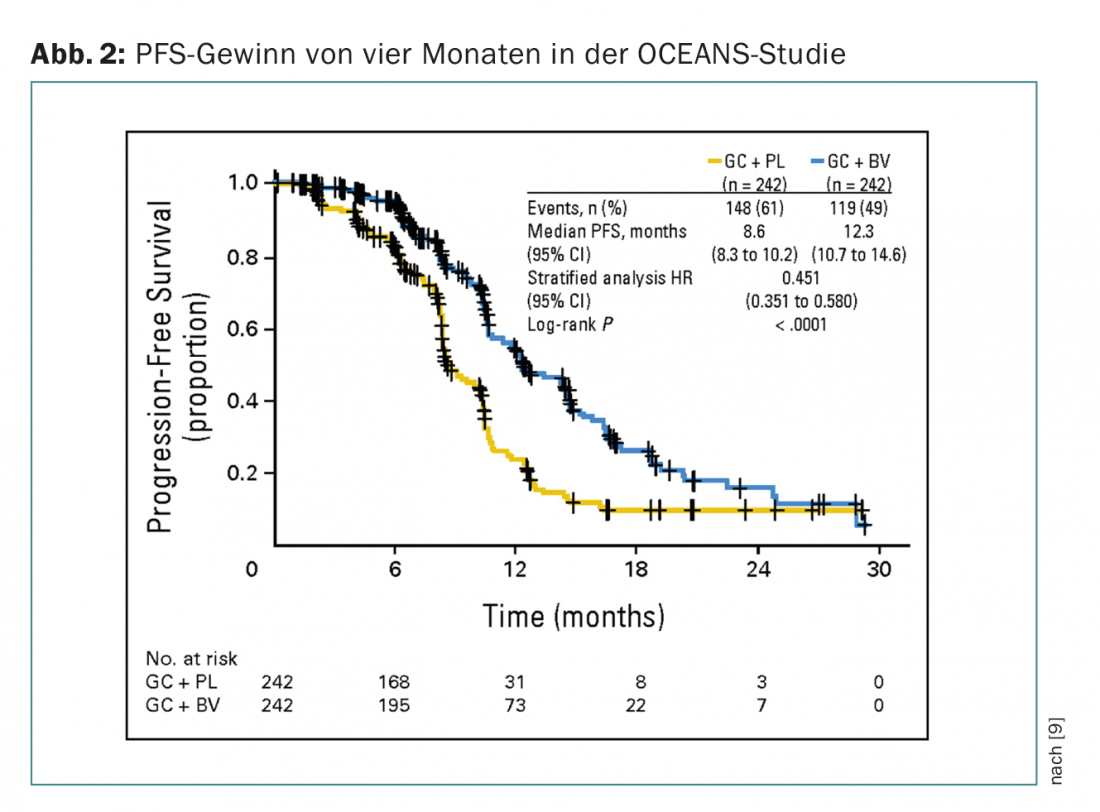
Em situações de recaída, a adição de bevacizumab (também como terapia de manutenção) também demonstrou um benefício PFS em medida semelhante. Os doentes com cancro dos ovários sensível à platina foram incluídos no estudo OCEANS (fase III, PFS ganho quatro meses) (Fig. 2) [9]. A quimioterapia em ambos os braços consistia em carboplatina/gemcitabina. Bevacizumab foi utilizado no braço experimental a 15 mg/kgKG de três em três semanas até à progressão. Os pacientes não podiam ser pré-tratados (excepto o adjuvante) e não era permitida a terapia prévia anti-VEGF. Na Suíça, bevacizumab é também aprovada nesta situação, mas deve ser obtida uma aprovação de custos (que se aplica a todas as indicações bevacizumab).
A indicação mais recente para bevacizumab no cancro dos ovários é o carcinoma resistente à platina (AURELIA) com não mais do que duas terapias prévias sem inibidores de angiogénese prévias. O tratamento é dado em conjunto com topotecan, paclitaxel ou Caelyx®. A dosagem é de 10 mg/kgKG a cada 14 dias até à progressão da doença. O ganho PFS aqui é também de 3,5 meses, o que pode ser considerado significativo nesta situação, em que os pacientes sobrevivem de outra forma menos de 12 meses. A AURELIA mostrou adicionalmente uma melhoria na qualidade de vida. No entanto, há algumas advertências a mencionar com este estudo, especialmente o desenho do rótulo aberto com possibilidade de cruzamento.
Que a inibição da angiogénese desempenha um papel no cancro dos ovários (também na génese das ascite) já é conhecida há algum tempo. Agora podemos também utilizar este princípio terapêutico. No entanto, o momento mais ideal ainda não é claro (possivelmente várias vezes?), e os custos também não podem ser ignorados na situação actual [10].
Terapia para portadores de genes BRCA 1 e 2
Aproximadamente 10-15% dos cancros ovarianos são familiares, sendo os dois genes BRCA os mais importantes. O risco de cancro dos ovários ao longo da vida para um portador BRCA 1 é de 25-55%, para um portador BRCA 2 é de 10-25%. Após a conclusão do planeamento familiar, a adnexectomia profiláctica bilateral deve ser discutida com estes pacientes (para além de outras opções preventivas).
A terapia destes carcinomas ovarianos ainda não diferiu da dos carcinomas esporádicos, nem o prognóstico é pior [11]. Uma terapia de manutenção com olaparib deve ser aqui mencionada como uma inovação.
Em até 50% dos carcinomas serosos de alta qualidade, existe um defeito na recombinação homóloga (na linha germinal como nos portadores de BRCA ouomaticamente nas células tumorais), uma importante via para corrigir os danos do ADN. As enzimas PARP (polimerases) são responsáveis pela reparação de quebras de DNA de cadeia única. Nas células saudáveis, estas são recombinadas de forma homóloga. No entanto, isto não é possível sem um gene BRCA funcional. Os inibidores PARP levam à instabilidade celular e à morte celular (“letalidade sintética”). As células tumorais são particularmente susceptíveis a este mecanismo.
Um ensaio da fase II mostrou que a terapia de manutenção com o inibidor oral PARP olaparib proporciona um benefício PFS em mulheres com alto grau de serosidade, pré-tratadas (pelo menos duas terapias, sensíveis à platina, respondendo à última terapia) cancro do ovário [12]. O ganho PFS foi principalmente demonstrado em doentes com doença BRCA-positiva (linha germinal ou tumor) e foi ainda de sete meses neste grupo (HR 0,35). Um benefício de SO ainda não foi demonstrado. Olaparib ainda não está oficialmente aprovado na Suíça, mas os pacientes com BRCA positivos podem ser inscritos num programa especial através da empresa. Os efeitos secundários são aceitáveis (principalmente fadiga, gastrointestinais, hematológicos) e raramente de grau 3 e 4.
No congresso ASCO deste ano, foram também apresentados os primeiros dados clínicos sobre inibidores de pontos de controlo imunitários com anticorpos anti-PD-1 e anti-PDL-1. Estas “imunoterapias” – para simplificar – libertam os travões do próprio sistema imunitário do corpo contra as células tumorais, e já estão a ser utilizadas com bom sucesso para o melanoma e o carcinoma brônquico. Os inibidores do ponto de controlo imunitário também parecem ter um efeito no cancro dos ovários, particularmente em tumores induzidos por mutações BRCA.
Espera-se que o prognóstico dos doentes com cancro dos ovários avançado melhore em breve com as mais recentes opções terapêuticas.
Literatura:
- Cancer Staging Handbook, AJCC Staging Manual7ª edição 2010.
- Sandercock J, et al: Tratamento de primeira linha para o cancro ovariano avançado: paclitaxel, platina e as provas. British Journal of Cancer 2002; 87: 815-824.
- The International Collaborative Ovarian Neoplasm Group: Paclitaxel plus carboplatina versus quimioterapia padrão com carboplatina de agente único ou ciclofosfamida, doxorubicina, e cisplatina em mulheres com cancro dos ovários: o ensaio aleatório ICON3. Lancet 2002; 360: 505-515.
- Katsumata N, et al: Dose de paclitaxel denso uma vez por semana em combinação com carboplatina a cada 3 semanas para cancro ovariano avançado: a fase 3, rótulo aberto, ensaio aleatório controlado. Lancet 2009; 374: 1331-1338.
- Sehouli J, et al: Paclitaxel e carboplatina semanais para doentes com cancro ovariano avançado: resultados de um estudo multicêntrico de fase II do NOGGO. Cancer Chemother Pharmacol 2008; 61: 243-250.
- Armstrong DK, et al: Cisplatina intraperitoneal e paclitaxel no cancro dos ovários. N Engl J Med 2006; 354: 34-43.
- Wright AA, et al: Utilização e eficácia da quimioterapia intraperitoneal para o tratamento do cancro do ovário. J Clin Oncol 2015; 33: 2841-2847.
- Poveda A, et al: Trabectedin mais doxorubicina peguilada lipossomal em cancro dos ovários recidivado: resultados na subpopulação parcialmente sensível à platina (intervalo sem platina de 6-12 meses) do ensaio aleatório OVA-301 fase III. Ann Oncol 2011; 22(1): 39-48. doi.1093/annonc/mdq352.
- Aghajanian C, et al: OCEANS: um ensaio aleatório, duplo-cego e controlado por placebo fase III de quimioterapia com ou sem bevacizumab em doentes com cancro epitelial recorrente sensível à platina, peritoneal primário, ou da trompa de Falópio. J Clin Oncol 2012; 30(17): 2039-2045.
- Liu JF, et al: Papel emergente para bevacizumab em combinação com quimioterapia para doentes com cancro dos ovários resistente à platina. J Clin Oncol 2014; 32: 1287-1289.
- Rubin SC, et al: Características clínicas e patológicas do cancro dos ovários em mulheres com mutações da linha germinal do BRCA1. N Engl J Med 1996; 335: 1413-1416.
- Ledermann J, et al: Terapia de manutenção de Olaparib em cancro dos ovários com recidiva sensível à platina. N Engl J Med 2012; 366: 1382-1392.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(2): 25-28











