Um primeiro conjugado anticorpo contra o mieloma múltiplo em doentes adultos altamente pré-tratados que sofreram progressão da doença durante a sua última terapia foi aprovado na Suíça desde Junho de 2022 e está sujeito a cobertura de seguro obrigatório desde Novembro de 2022 (1, 2). O tratamento ambulatório com monoterapia mostrou uma resposta profunda e durável e um perfil de segurança controlável no ensaio central (3, 4).
O mieloma múltiplo (MM), que pertence aos linfomas das células B, constitui cerca de 10% de todas as malignidades hematológicas (5). As opções de tratamento existentes permitiram um aumento da sobrevivência global (OS) dos pacientes MM nos últimos anos, mas o aparecimento de clones resistentes ainda leva frequentemente ao insucesso do tratamento. Com cada tratamento subsequente, a profundidade e duração da resposta reduz-se; uma proporção de doentes torna-se refractária aos inibidores do proteasoma (PIs), imunomoduladores (IMIDs) e anticorpos monoclonais. Estes pacientes têm opções de tratamento limitadas e, com um OS médio de 5,6 meses, um mau prognóstico (6). Isto reflecte a necessidade urgente de novas opções terapêuticas com mecanismos de acção inovadores (6). No ensaio DREAMM-2, o conjugado belantamab mafodotina (BLENREP) anticorpos anti-corpo de combate à droga, com o objectivo do BCMA, mostrou uma resposta boa e duradoura em pacientes altamente pré-tratados e com múltiplos refractários, especialmente medidos pela extensão do pré-tratamento (3, 4, 7).
Resposta profunda e sustentada com BLENREP no estudo DREAMM-2
No ensaio multicêntrico, aberto, fase II DREAMM-2 de dois braços, 97 pacientes cuja doença foi progressiva após ≥3 linhas de terapia receberam 2,5 mg/kg de BLENREP a cada 3 semanas como monoterapia até à progressão da doença ou toxicidade inaceitável (3, 4). A taxa de resposta global (ORR), que foi avaliada por um comité independente, foi o principal parâmetro e foi de 32% (31/97; 97,5% CI: 21,7%-43,6%) após um seguimento mediano de 13 meses(Fig. 1) (4). A maioria (18/31; 58%) destes respondentes beneficiou de uma remissão parcial muito boa (VGPR*: n=11) ou de uma resposta ainda mais profunda (CR*, sCR*; n=7). Os parâmetros secundários incluíram a duração média da resposta (mDOR; 11 meses [95% CI: 4,2-NE]) e a mediana esperada do SO (13,7 meses [95% CI, 9,9 meses – não atingido]) na população total de hemorróidas. A resposta e sobrevivência dos doentes com citogenética associada ao risco ou insuficiência renal era comparável aos resultados da população em geral (4).
Monitorização das alterações da córnea
As reacções adversas mais comuns com 2,5 mg/kg de BLENREP foram queratopatia (72%, gravidade ≥3 em 46%) e trombocitopenia (38%, gravidade ≥3 em 22%). Os efeitos secundários da córnea levaram ao atraso do tratamento em 47% dos pacientes, mas à interrupção permanente do tratamento em apenas 3%. Após 13 meses, as alterações da acuidade visual tinham resolvido em 82% dos pacientes; não foi observada perda permanente da visão (4). Para monitorizar os efeitos secundários, é realizado um exame oftalmológico antes de iniciar o tratamento com BLENREP e antes dos três primeiros ciclos subsequentes. Os pacientes devem também evitar lentes de contacto e usar regularmente substitutos de lágrima sem conservantes. Assim que ocorrerem efeitos secundários moderados da córnea, ajustar a dosagem de BLENREP ou retardar o tratamento (1). Embora neste estudo tenham sido frequentemente utilizadas modificações de dose (atrasos ou reduções) para a gestão de efeitos secundários, estas tiveram um impacto mínimo na resposta sob BLENREP (4).
Conclusão
BLENREP foi aprovado na Suíça desde Junho de 2022 e tem sido reembolsado pelas companhias de seguros de saúde desde Novembro de 2022 se o limite for cumprido (1, 2). BLENREP é aprovado como monoterapia para o tratamento de MM em pacientes adultos fortemente pré-tratados com pelo menos quatro terapias prévias que mostraram progressão da doença durante a última terapia e cuja doença é refratária a pelo menos um inibidor proteasómico, um imunomodulador e um anticorpo monoclonal anti-CD38 (1). Os pacientes com um elevado grau de pré-tratamento, em particular, podem agora beneficiar da nova opção de tratamento eficaz e tolerável.
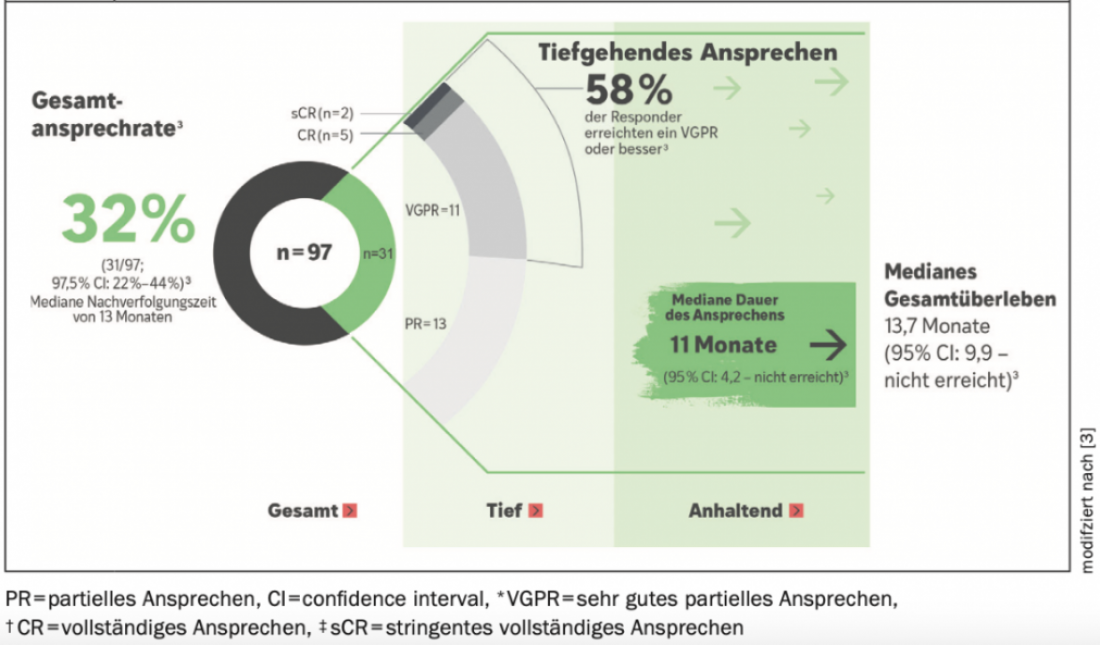
Figura 1: Taxas de resposta, duração da resposta e sobrevivência global no ensaio DREAMM-2 de 2,5 mg/kg BLENREP após 13 meses de seguimento. Adaptado de (4).
————-
°BCMA = antigénio de maturação das células B, proteína de superfície encontrada exclusivamente em células do mieloma múltiplo e plasmócitos
*VGPR = muito boa resposta parcial; CR = resposta completa; sCR = resposta completa rigorosa
Mais informações
Publireportage responsável e financiado pela GlaxoSmithKline AG, Talstr. 3, CH-3053 Münchenbuchsee. Contacto: +41 31 862 21 11
As marcas comerciais são propriedade dos seus respectivos proprietários. ©2022 Grupo de empresas GSK ou o seu licenciador.
Breve informação técnica BLENREP®
PM-CH-BLM-ADVR-220029-11/2022
Literatura