O diagnóstico de derrame pleural é muito complexo, uma vez que uma variedade de condições médicas pode causar derrame pleural. A distinção mais importante é entre efusões transudantes e exudantes e as suas causas. Os parâmetros químicos de laboratório e os exames citológicos ajudam aqui. Dependendo da causa, pode ser iniciada mais terapia. Estão disponíveis numerosos métodos para tal, desde a simples punção de descompressão até à drenagem pleural e toracoscopia.
Como a pele serosa sobre os pulmões, a pleura é uma parte importante na mecânica respiratória de todo o sistema. Uma fina camada de líquido é necessária para assegurar que as folhas pleurais deslizem facilmente umas sobre as outras e, assim, os pulmões dentro do tórax. Isto permite uma rápida transmissão de força dos músculos respiratórios e uma excursão torácica para os pulmões. O próprio pulmão é acoplado à parede torácica por este fluido. As células mesoteliais da pleura têm um papel passivo na lubrificação do sistema respiratório, por um lado, e um papel activo na formação de macromoléculas, citocinas inflamatórias, factores de crescimento e peptídeos quimiotácticos, por outro. Uma função importante é o transporte activo de proteínas, fluido linfático e células através da serosa, bem como a absorção de fluido acoplado a electrólitos.
Alteração da permeabilidade pleural devido a processos patológicos
No caso de inflamação da pleura e/ou estruturas pulmonares adjacentes, ocorre perda de proteínas no espaço pleural devido a alterações nas células mesoteliais e na estrutura da superfície pleural. As forças motrizes para o aumento da acumulação de fluidos são o aumento da pressão hidrostática, a diminuição da pressão oncótica e a alteração da remoção do fluido linfático. A permeabilidade pleural muda através do contacto com bactérias, lipopolissacáridos, trombina [1]. Este contacto aumenta a secreção de VEGF nas células mesoteliais, que é um potente mediador do aumento da permeabilidade [2].
Clínica e apresentação
Os sintomas típicos de efusão pleural são dores no peito, tosse e dispneia. A dor pleurítica tem origem na pleura parietal porque nem a pleura visceral nem os pulmões têm receptores de dor. Tipicamente, é um início rápido, dor intensa com radiação no ombro e na parte superior do abdómen. À medida que a efusão pleural aumenta, a dor diminui normalmente. A tosse nas doenças pleurais é um sintoma não específico, bastante seco e persistente e associado à falta de ar. A dispneia resulta inicialmente de febre e dor e com efusões de rápido aumento devido à compressão dos pulmões. Tipicamente, a dispneia é dependente da posição [3].
Diagnóstico por imagem
Os derrames pleurais e as doenças pleurais podem ser detectados e clarificados com todos os procedimentos radiológicos. As radiografias de tórax posterior-anterior podem mostrar efusões de mais de 200 ml, embora muitas vezes possam faltar efusões maiores nas radiografias de tórax. A TC já pode detectar significativamente menos efusão e pode ter sucesso no diagnóstico de uma variedade de patologia concomitante do pulmão e da pleura. Doenças subjacentes tais como pneumonia, embolia pulmonar, malignidades torácicas, doenças pulmonares intersticiais, doenças pleurais, bem como patologias cardíacas e adjacentes da parte superior do abdómen podem ser adequadamente diagnosticadas. Uma diferenciação de sobreposições benignas e estruturas malignas é bem sucedida com uma sensibilidade de 90% [4].
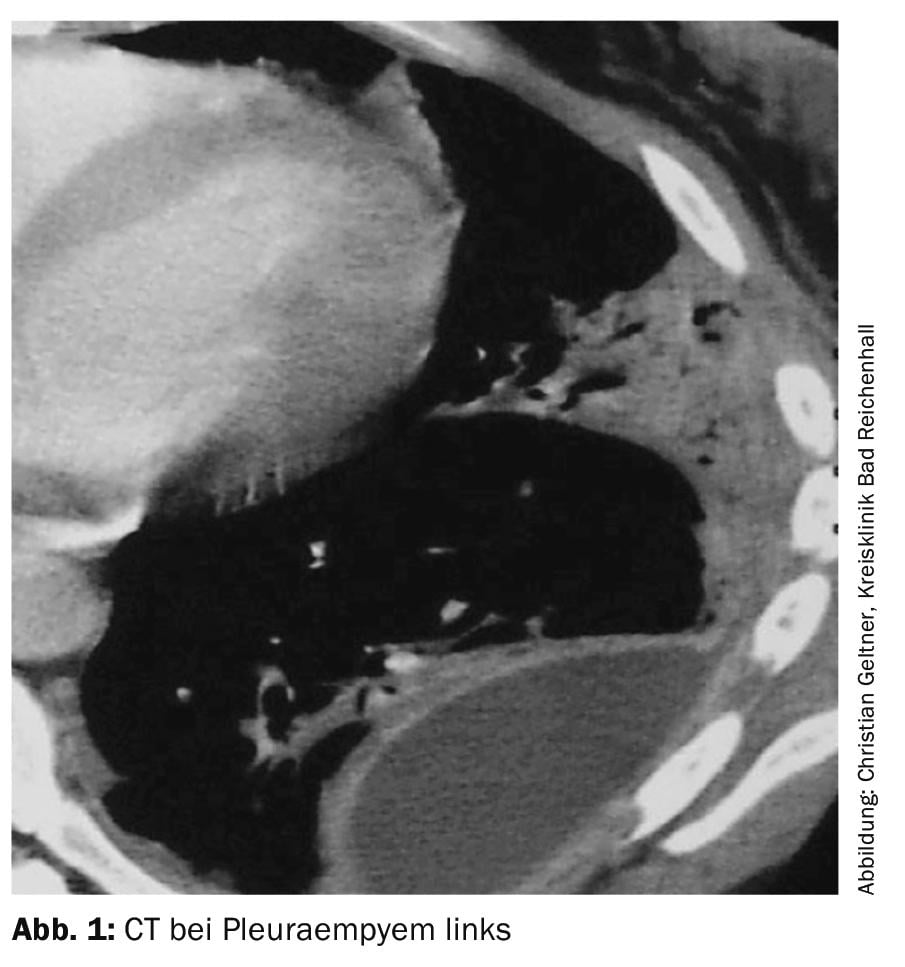
Uma tomografia computorizada deve ser realizada com melhoria do contraste e uma pequena quantidade de fluido residual (Fig. 1) . Os derrames de grandes volumes devem ser drenados primeiro [4].
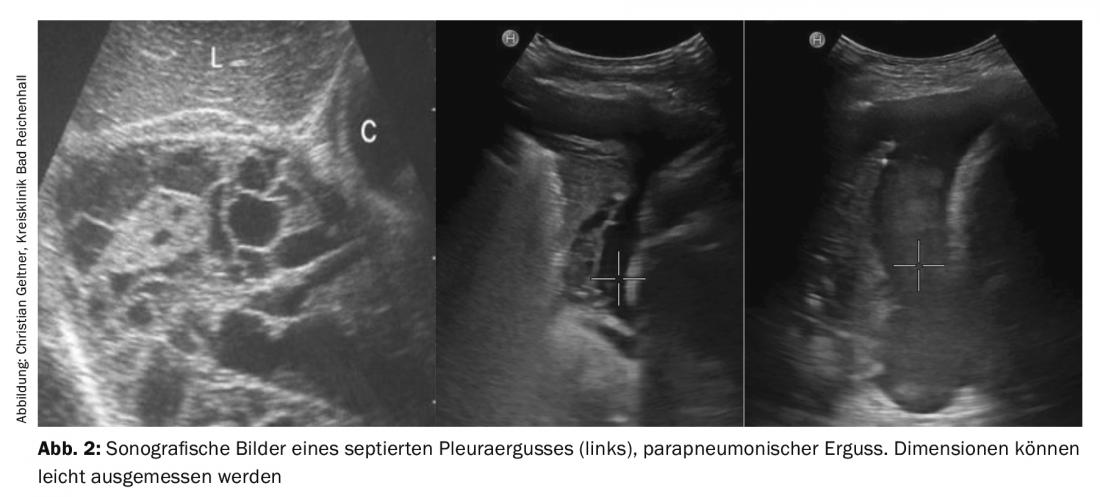
A ecografia torácica e pleural é um método seguro e inofensivo para diagnosticar e quantificar efusões e para mostrar doenças concomitantes (Fig. 2) . Pode também diferenciar entre efusões parapneumónicas simples e complicadas, sobrecrescimento maligno e infiltrações dos pulmões. A ressonância magnética não deve ser realizada rotineiramente. A única melhoria diagnóstica está na encenação do mesotelioma pleural comprovado [5].
Diagnósticos invasivos
Uma punção pleural (toracocentese) é necessária para o diagnóstico diferencial em todas as efusões pleurais, após excluir as causas mais importantes de transudado [6]. Os derrames transudantes não devem ser perfurados se a causa for clara. Neste caso, a causa deve primeiro ser tratada com medicação. Um exame de ultra-som antes da punção é intencional, uma vez que o local da punção e a quantidade de punção podem ser estimados. A punção pleural é um método de diagnóstico invasivo muito seguro. Pneumotórax ocorre em cerca de 3-10%. Um exame químico do líquido pleural pode normalmente explicar a causa. A citologia leva a um diagnóstico definitivo em 60% dos casos de tuberculose e apenas em 25% dos casos de malignidade. A citologia negativa não exclui a efusão pleural maligna.
Existem várias técnicas de biopsia pleural para a obtenção de amostras histológicas da pleura. Foram desenvolvidas várias agulhas para biopsia da pleura pariental, que permitem a remoção de tecido para exame histológico. Os riscos aqui são grandes hemorragias, pneumotórax e lesões no diafragma e na superfície pulmonar. O rendimento diagnóstico é de aproximadamente 80% para a tuberculose, 43% para a carcinomatose pleural e 25% para o mesotelioma pleural maligno [7,8].
A toracoscopia médica como um simples procedimento minimamente invasivo experimentou um renascimento com o desenvolvimento de pequenos sistemas ópticos e endoscópios semi-flexíveis. Aqui, é possível uma biópsia opticamente controlada da pleura e pulmão com uma sensibilidade e especificidade diagnóstica de até 98%.
Além de obter biópsias e ressecções em cunha maiores dos pulmões, a toracoscopia cirúrgica videoassistida (VATS) é também um procedimento terapêutico com todas as possibilidades de procedimentos cirúrgicos torácicos tais como abrasão pleural, pleurectomia, decorticação e lóbulos e pneumectomias.
Distinção entre o exsudado e o transudado
Em efusões macroscopicamente claras, deve ser feita uma distinção entre transudados puros e exudados. A análise química do punção e os critérios de acordo com a Luz (medição do conteúdo de proteínas e LDH no líquido pleural e no soro) têm a maior sensibilidade.
Um critério clinicamente importante é se as efusões ocorrem de um ou de ambos os lados; isto ajuda no diagnóstico diferencial. Os transudados são tipicamente bilaterais, embora também possam ocorrer unilateralmente em cerca de 20% dos casos. As efusões inflamatórias ocorrem geralmente no lado da patologia com a excepção principal de doenças sistémicas (como nas colagenoses ou nos carcinomas metastáticos).
A efusão pleural transudativa
Os derrames transudantes são causados por alterações de pressão na pleura. Um aumento da entrada de fluidos na pleura, por um lado, e uma diminuição da saída de fluidos, por outro, ocorre com um aumento da pressão venosa na circulação sistémica (insuficiência cardíaca direita), na circulação pulmonar (insuficiência cardíaca esquerda), na circulação portal (cirrose hepática) ou com uma diminuição da pressão pleural na atelectasia pulmonar ou embolia pulmonar. A quantidade de fluido depende das condições de pressão alteradas e da filtração através da pleura. As causas mais importantes são insuficiência cardíaca e doença renal com perda de proteínas.
O exsudado na pleura
A base para qualquer exsudado é uma reacção inflamatória pleural. A inflamação da pleura pode resultar ou de infecções ou do envolvimento da pleura numa variedade de doenças sistémicas. A pleurisia infecciosa é comum em casos de envolvimento pleural no contexto de pneumonia. Isto pode variar de simples pleurisia concomitante a simples e complicadas efusões parapneumónicas a empiema pleural. O grau e tipo de reacção inflamatória pode ser reconhecido pelo número e tipo de células inflamatórias no líquido pleural.
Efusões parapneumónicas
As efusões parapneumónicas ocorrem em 20-40% dos doentes hospitalizados por pneumonia. O risco de cursos prolongados e mortalidade é significativamente maior com a ocorrência de uma efusão parapneumónica na pneumonia. A ocorrência de empiema pleural sem pneumonia prévia é rara, mas deve ser considerada em ligação com intervenções cirúrgicas, iatrogenicamente após punções ou em doentes com imunossupressão grave. Com suficiente e oportuna terapia antibiótica sistémica, a maioria das efusões infecciosas cicatrizam. Basicamente, há uma transição suave de efusão parapneumónica para efusão complicada para empiema pleural (tab. 1).
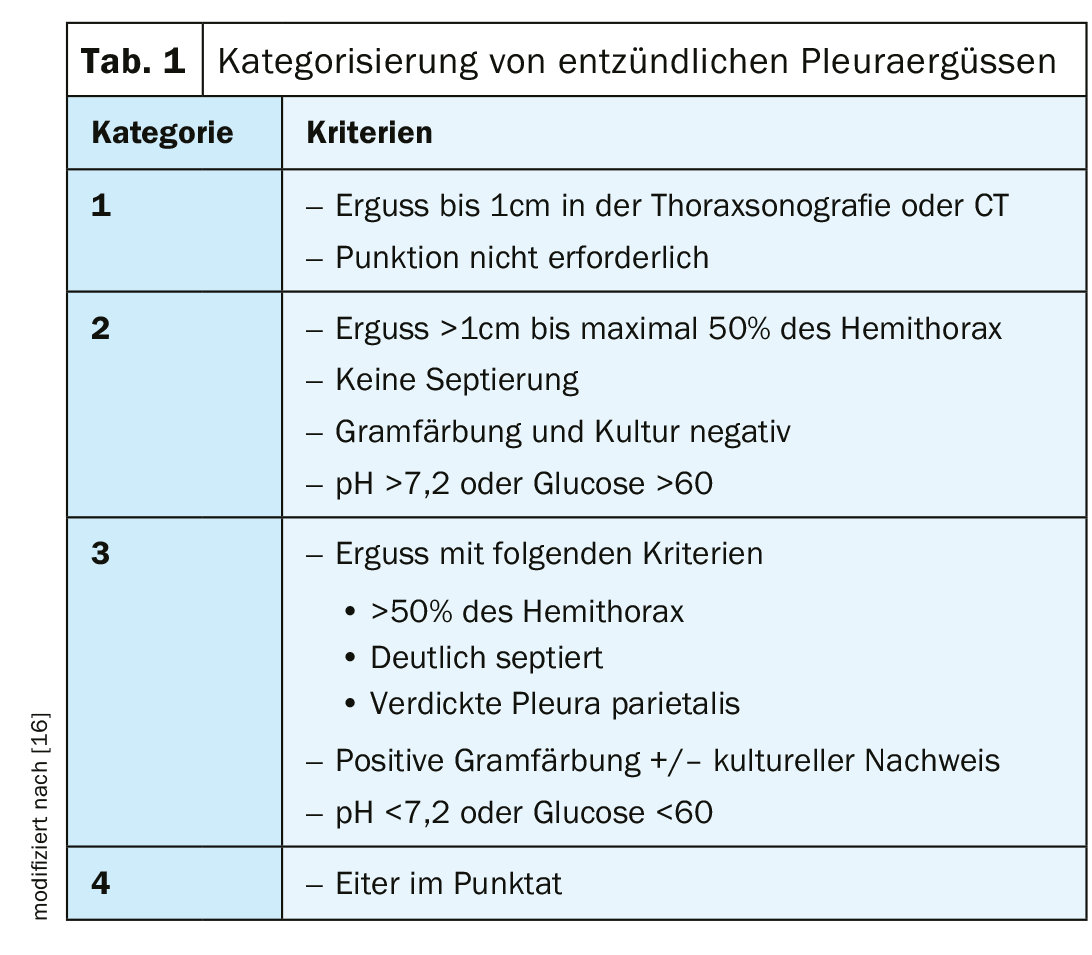
A primeira fase de um derrame inflamatório é o derrame parapneumónico exsudado de fluxo livre; este é estéril e mostra parâmetros químicos normais de laboratório (leucócitos, LDH, pH, glucose). A terapia antibiótica é suficiente. Com uma terapia inadequada, uma simples efusão pode complicar-se numa fase fibropurulenta. A imigração de bactérias e células inflamatórias leva a processos inflamatórios com maior actividade de formação de fibrina, resultando em fios de fibrina, septos e maior crescimento bacteriano. Isto mostra a crescente separação e organização do derrame na imagem. Os seguintes parâmetros laboratoriais são patogénicos: pH <7,2, glucose <60, LDH >1000. O aparecimento de pus macroscopicamente visível é chamado empiema. Isto resulta na obstrução mecânica do pulmão, formação de septos purulentos, reforma de vasos e organização do derrame por fibroblastos e leucócitos.
Após a química de diferenciação entre transudados e exudados, o trabalho citológico da efusão é o seguinte de importância diagnóstica crucial. Os granulócitos neutrófilos são encontrados em infecções bacterianas precoces até ao empiema pleural. Os derrames linfocíticos são típicos em tuberculoses, sarcoidoses, linfomas e colagenoses, bem como em todas as malignidades, enquanto encontramos derrames eosinofílicos em embolias pulmonares, asbestoses, aspergilose, mesoteliomas e carcaças pleurais. Efusões “antigas” mostram um aumento da população de linfócitos no punctrodo [4]. Quanto mais células inflamatórias houver na pleura, maior a probabilidade de haver aderências, formação de fibrina, formação de membranas e aderências. No caso de efusões parapneumónicas, pode desenvolver-se subsequentemente um empiema pleural. Aqui, a cultura bacteriológica é geralmente negativa, uma vez que os anaeróbios estão frequentemente envolvidos, que são difíceis de cultivar.
A graduação para efusões parapneumónicas é a seguinte:
- Efusão parapneumónica descomplicada: exsudado, predominantemente neutrofílico
- Efusão parapneumónica complicada: aumento da invasão bacteriana: diminuição do pH, diminuição da glicose, aumento do LDH. Ocorrem depósitos de fibrina e formação de membranas.
- Empyema = pus no punctate. A intervenção cirúrgica é normalmente necessária aqui.
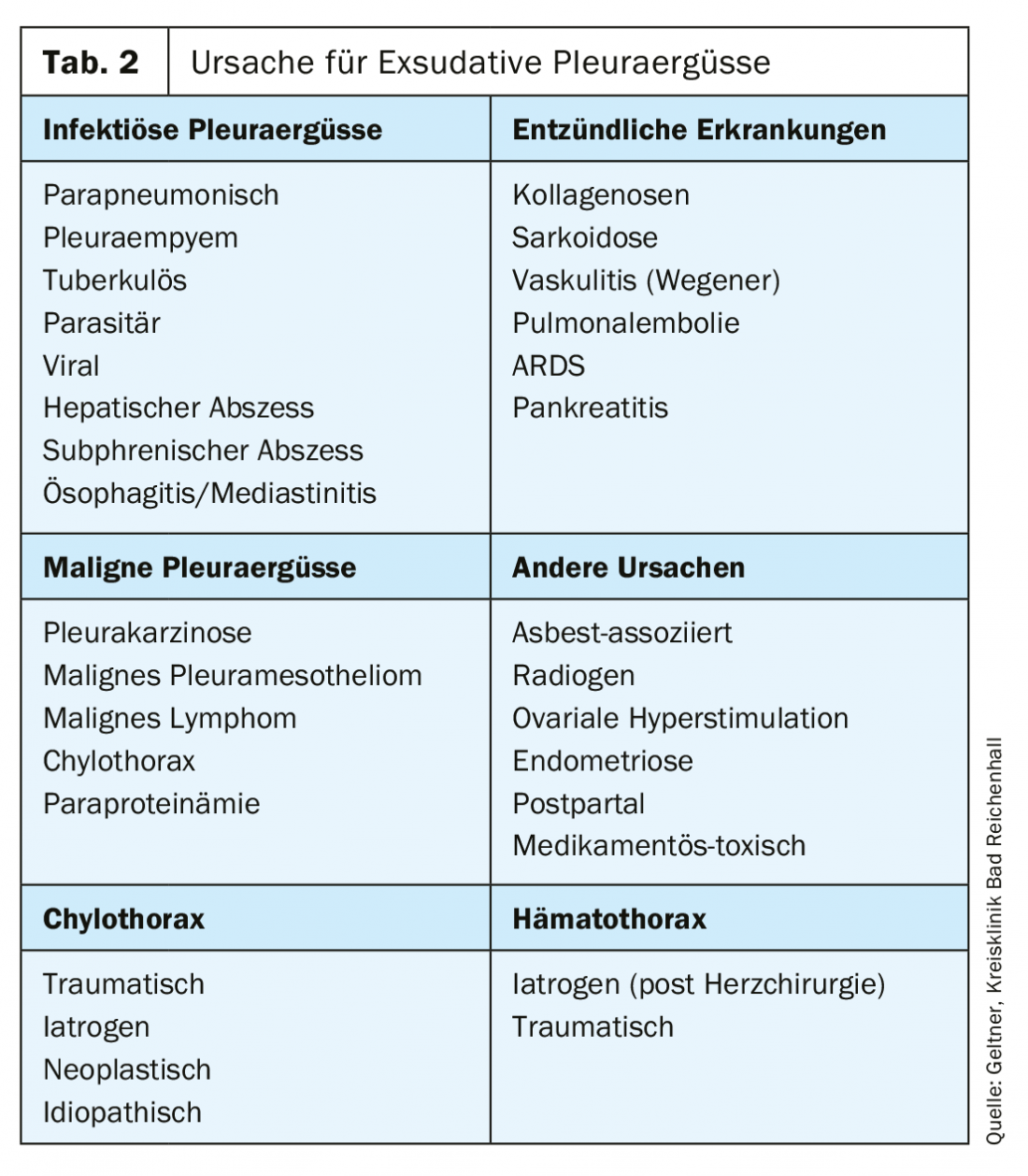
As causas comuns de exsudados são efusões malignas, que ocorrem mais frequentemente nos carcinomas brônquicos, mamários ou ovarianos (tab. 2).
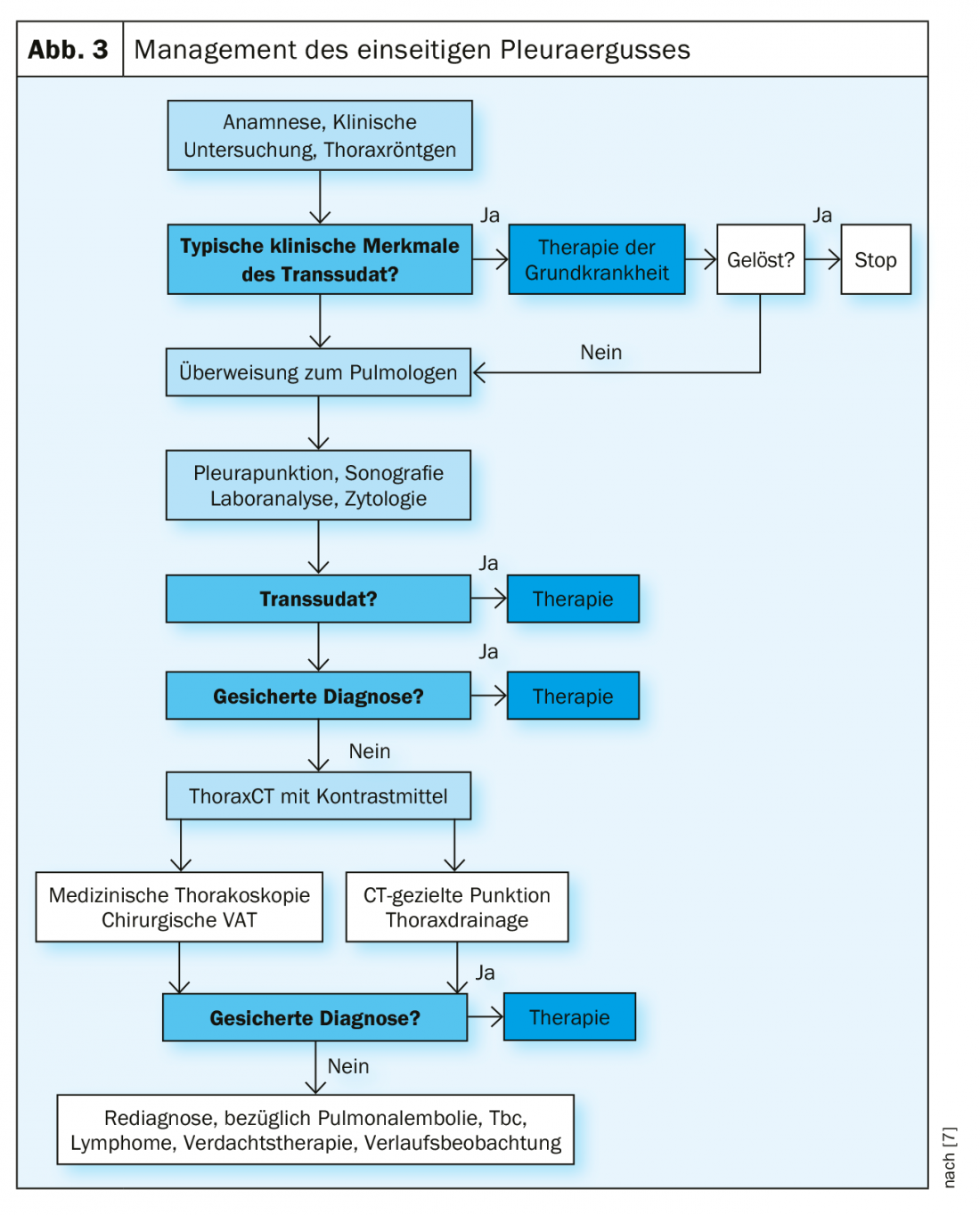
Gestão de efusão pleural
O primeiro passo na gestão de um derrame é o trabalho de diagnóstico do derrame. A British Medical Society desenvolveu um algoritmo prático nas suas directrizes (Fig. 3).
Gestão de derrames malignos
As efusões malignas e a carcinomatose pleural são uma complicação frequente de malignidades torácicas e extratorácicas [9]. São muito frequentemente sintomáticos e requerem uma terapia paliativa (Fig. 4) . A terapia curativa já não é normalmente possível nesta fase [10].
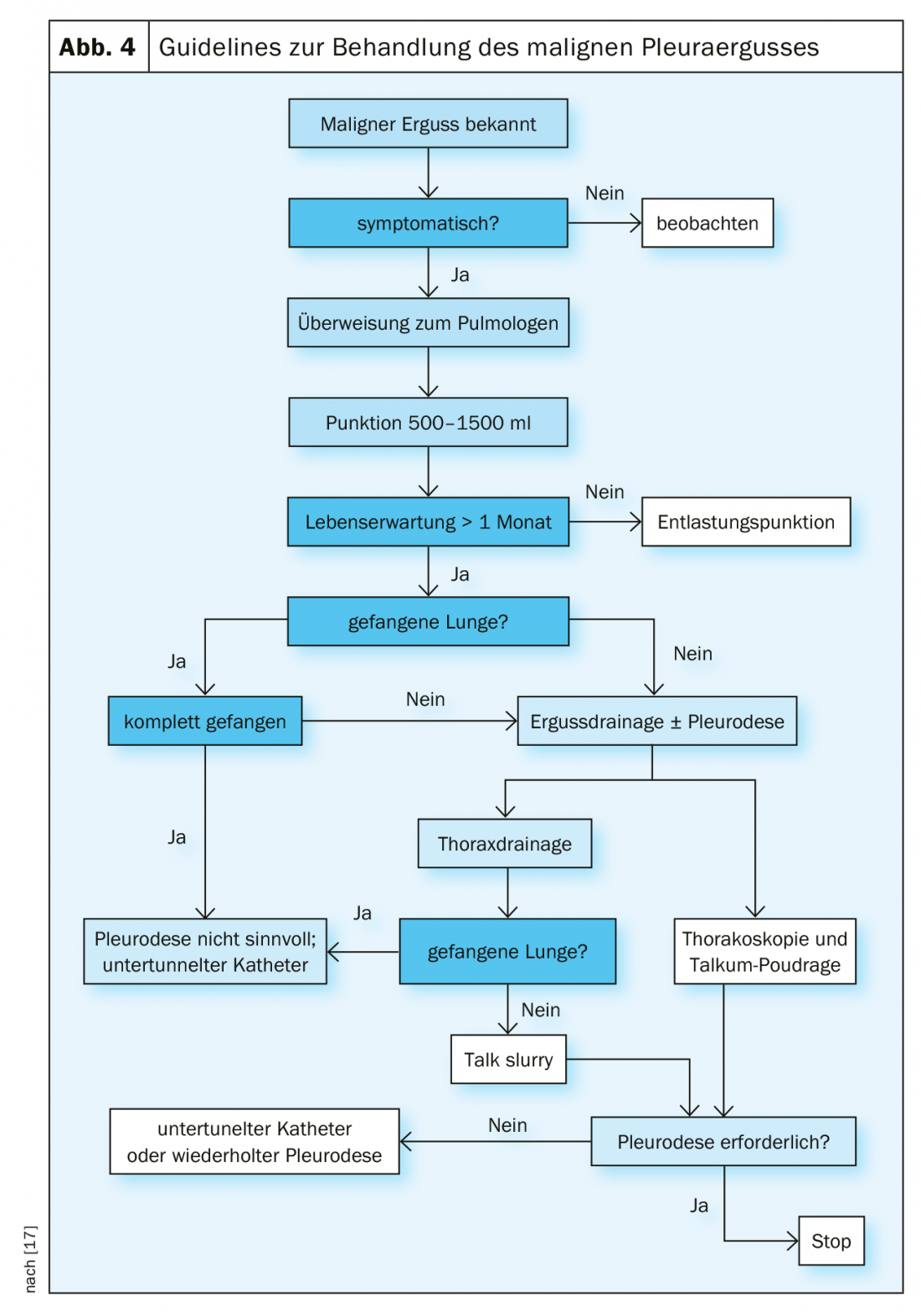
Punção de descarga: Este procedimento é o método de primeira escolha em doentes sintomáticos. Os furos repetidos não devem ser realizados em doentes com uma esperança de vida superior a um mês, devido ao risco de uma expectativa pleural e da formação de um pulmão “preso”. Neste caso, recomenda-se a realização de uma pleurodese. Há um risco de edema de reexpansão dos pulmões se mais de 1,5 litros forem descarregados. Neste caso, é preferível uma drenagem lenta ou a inserção de um dreno torácico. A punção de alívio tem uma alta taxa de recorrência de derrames e um baixo risco de pneumotórax ou empiema [11].
Drenagem torácica: Para pacientes com uma condição geral aceitável e uma esperança de vida superior a 1 mês, deve ser realizada uma drenagem torácica com subsequente pleurodese. Os agentes esclerosantes produzem uma inflamação estéril da pleura e aumentam a actividade fibrinolítica. A administração de esteróides reduz o efeito da pleurodese. O Talco é a substância mais eficaz e, portanto, recomendada para a pleurodese. Os anti-inflamatórios não esteróides (NSAID) são geralmente possíveis após a pleurodese. A gestão da dor é a mesma que a dos opiáceos (mas não melhor). Não há nenhum efeito negativo comprovado na taxa de pleurodese, pelo que os AINE após a pleurodese são bastante úteis e também recomendados (TIME-1-RCT) [12]. O diâmetro dos drenos torácicos recomendados diminuiu ainda mais. Devido a menos dor, os drenos finos (12F) foram recomendados pelas directrizes de 2010. No entanto, estes sistemas de drenagem, que são frequentemente utilizados para derrames pleurais, não mostram qualquer vantagem em termos de sensação de dor e têm resultados mais fracos em termos de sucesso da pleurodese de talco.
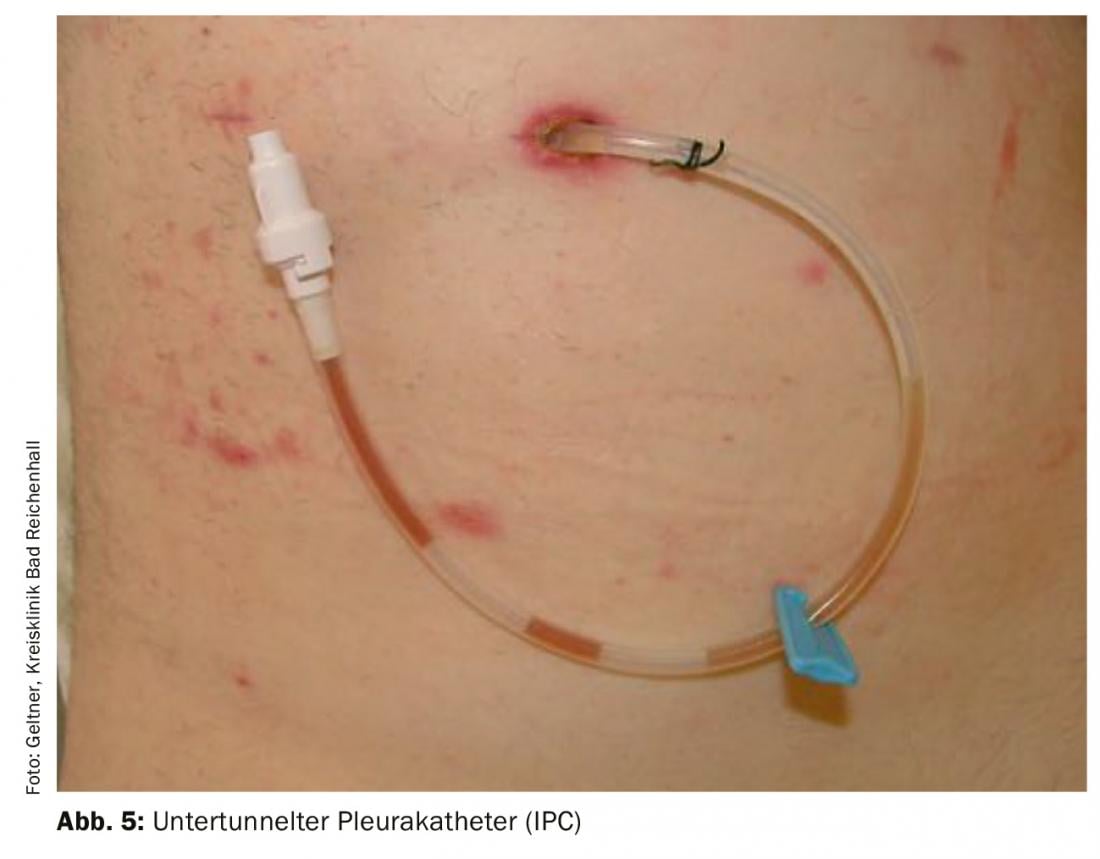
Cateteres pleurais implantáveis permanentes (IPC) [13] (Fig. 5): Os IPCs são fáceis de implantar e muito seguros em termos de taxas de infecção e complicações. Os pacientes serão capazes de auto-gerir as punções de alívio utilizando sistemas simples de alívio de vácuo. Se necessário, a pleurodese também pode ser realizada através destes cateteres. A implantação é geralmente feita em regime ambulatório. A combinação de IPCs sobre os quais o talco é então aplicado aumentou em duas vezes a taxa de pleurodese aguda. A pleurodese completa é alcançada em 45% após 5 semanas. Do ponto de vista actual, a aplicação do talco deve ser realizada após a criação de um IPC. A remoção é assim possível mais cedo em numerosos casos [14].
Toracoscopia médica minimamente invasiva: Este procedimento é o método de escolha para realizar a pleurodese [15]. Sob anestesia local com sedoanalgesia, a toracoscopia pode ser realizada na maioria dos pacientes. Não é necessária anestesia com intubação de duplo lúmen. Mesmo em doenças muito avançadas e funções pulmonares ou cardíacas deficientes, é possível obter pleurodese suficiente através de poudrage de talco A taxa de sucesso situa-se entre 80-90%.
Literatura:
- Krogel C: Imunobiologia da inflamação pleural: potencial implicação para a patogénese, diagnóstico e terapia. ERJ 1997; 10: 2411-2418
- Hott JW: Papel do VEGF no desenvolvimento de efusões pleurais malignas. AJRCCM 1999; A212: 159.
- Yernault JC: História, sintomas e exame clínico em doenças pleurais. Monografia Eur Resp 2002; 22: 60-75.
- Traill ZC, Davies RJO, Gleeson FV: Tomografia computadorizada torácica em doentes com suspeita de derrames pleurais malignos. Clin Radiol 2001; 56: 193-196.
- Giesel FL: Ressonância magnética dinâmica de contraste melhorado de mesotelioma pleural maligno: um estudo de viabilidade de avaliação não invasiva, acompanhamento terapêutico, e possível preditor de melhor resultado. Peito 2006; 129; 1570-1576.
- Hooper C, et al: Investigação de uma efusão pleural unilateral em adultos: British Thoracic Society pleural disease guideline 2010. BMJ Thorax 2010; 65(Suppl 2): ii4-7.
- Loddenkemper R: Avaliação prospectiva dos métodos de biopsia no diagnóstico de derrame pleural maligno. Comparação intra-paciente entre citologia do líquido pleural, biopsia com agulha cega e toracoscopia. ARRD 1983; 127: 114.
- Astoul P: Pleurodese para efusões pleurais malignas recorrentes: a busca do Santo Graal. Eur J Cardiothorac Surg 2011; 40(2): 277-279.
- Geltner C, Errhalt P: efusão pleural maligna: patogénese, diagnóstico, e gestão. MEMO 2016, online 19.11.2016. DOI 10.1007/s12254-015-0246-0.
- Feller-Kopman DJ, Gestão de derrames pleurais malignos. Uma Directriz Oficial de Prática Clínica ATS/STS/STR. Am J Respir Crit Care Care Med 2018; 198(7): 839-849.
- Sorensen PG, Svendsen TL, Enk B: Tratamento de derrame pleural maligno com drenagem, com e sem instilação de talco. Eur J Respir Dis 1984; 65: 131-135.
- Rahman NM: Effect of Opioids vs NSAIDs and Larger vs Smaller Chest Tube Size on Pain Control and Pleurodesis Efficacy Among Patients With Malignant Pleural Effusion: The TIME1 Randomized Clinical Trial. JAMA 2015; 314(24): 2641-2653.
- Musani AI: Opções de tratamento para derrame pleural maligno. Curr Opinião Pulm Med 2009; 15: 380-387.
- Bhatnagar R: Administração de Talco Ambulatorial por Cateter Pleural Indwelling para Efusão Maligna. NEJM 2018; 378(14): 1313-1322.
- Tschopp JM, et al: Pleurodese por talco poudrage sob toracoscopia médica simples: uma opinião internacional. Tórax 2009; 64(3): 273-274.
- RW leve: efusões parapneumónicas e empiema. Proc Am Thorac Soc 2006; 3(1): 75-80.
- Mac Duff A, Arnold A, Harvey J: Gestão de pneumotórax espontâneo: British Thoracic Society pleural disease guideline 2010, Thorax 2010; 65: ii18-ii31.
PRÁTICA DO GP 2019; 14(9): 16-20