Cerca de 200.000 pacientes na Suíça vivem com um diagnóstico de insuficiência cardíaca. Até 10% deles desenvolvem sintomas progressivos. Em que momento se fala de insuficiência cardíaca grave e o que se pode fazer então?
Em 2018, a Associação de Insuficiência Cardíaca da Sociedade Europeia de Cardiologia publicou um documento de posição sobre insuficiência cardíaca grave [1]. Este texto é, em grande parte, um resumo das recomendações aí publicadas.
Na Suíça, 150.000-200.000 pacientes são diagnosticados com insuficiência cardíaca [2]. Apesar dos avanços na terapia da insuficiência cardíaca nos últimos anos e de novos medicamentos como o sacubitril/valsartan, aproximadamente 5-10% dos pacientes com insuficiência cardíaca desenvolverão sintomas progressivos e sofrerão de insuficiência cardíaca progressiva e grave [3–5]. O número de pacientes com insuficiência cardíaca grave continuará a aumentar com uma melhor sobrevivência e uma incidência crescente de insuficiência cardíaca. É fundamental que os prestadores de cuidados primários e os cardiologistas de escritório reconheçam e diagnostiquem a insuficiência cardíaca grave e encaminhem os pacientes para um centro de insuficiência cardíaca terciária na altura certa. Só desta forma é possível planear e implementar com sucesso, numa fase inicial, outras opções terapêuticas, incluindo a listagem para transplante cardíaco ou a utilização de sistemas de apoio circulatório mecânico (MCS).
Definição de insuficiência cardíaca grave e determinação do prognóstico
Existem várias definições de insuficiência cardíaca grave na literatura [5–8]. Devido à sua exaustividade e aplicabilidade clínica, consideramos a definição recentemente publicada da Associação da Insuficiência Cardíaca (HFA)-ESC muito útil para a prática clínica diária. Todos os critérios seguintes devem ser cumpridos apesar da terapia ideal para a insuficiência cardíaca
- Sintomas graves e persistentes de insuficiência cardíaca (classe III ou IV da NYHA)
- Disfunção cardíaca grave definida por uma redução da FEVE <30%, insuficiência ventricular direita isolada ou anomalias graves da válvula ou anomalias congénitas inoperáveis ou persistentemente elevadas (aumentando, em alternativa) valores BNP/NT-proBNP e disfunção diastólica grave ou anomalias estruturais do VE de acordo com a definição ESC de FEFH e FEF-HFmr.
- Episódios de congestão pulmonar ou congestão sistémica que requerem uma alta dose de terapia intravenosa com diuréticos (ou combinações de diuréticos), ou episódios de baixo débito que requerem inotrópicos ou drogas vasoativas, ou arritmias malignas resultando em pelo menos uma apresentação ou hospitalização não planeada nos últimos 12 meses.
- Limitação severa do desempenho físico, objectivada de forma óptima por um teste de caminhada de 6 minutos abaixo dos 300 metros ou espiroergometria com absorção máxima de O2(pVO2 <12-14 mL/kg/min) com etiologia cardíaca suspeita.
Além disso, a insuficiência cardíaca avançada caracteriza-se por disfunção orgânica sistémica (insuficiência renal, caquexia cardíaca, insuficiência hepática) e/ou hipertensão pulmonar. Neste sentido, uma síndrome cardio-renal ou uma perda de peso de 6% do peso corporal no prazo de 6 meses (definição de caquexia cardíaca) devem ser considerados indicadores de insuficiência cardíaca grave. A hipertensão pulmonar devida a causas cardíacas deve ser documentada precocemente e deve ser interpretada como uma indicação de insuficiência cardíaca avançada. Se isto for detectado demasiado tarde, existe o risco de que a sua extensão seja uma contra-indicação para o transplante cardíaco. A deterioração associada da função cardíaca direita pode também impossibilitar uma terapia adicional com um dispositivo de assistência ventricular esquerda.
As doenças concomitantes estão muito frequentemente associadas à insuficiência cardíaca. Na definição de insuficiência cardíaca grave, os critérios 1 e 4 também devem ser considerados preenchidos se houver disfunção cardíaca de acordo com o critério 2, mas uma grande parte da limitação é explicada por uma comorbidade (por exemplo, doença pulmonar). Comorbilidades como diabetes, doenças pulmonares (DPOC, apneia do sono), insuficiência renal, anemia, deficiência de ferro ou doenças reumáticas crónicas têm uma influência considerável no prognóstico da insuficiência cardíaca e devem ser tratadas da melhor forma possível [9]. As comorbidades devem, portanto, ser definitivamente incluídas na avaliação e prognóstico globais, uma vez que podem, por um lado, reflectir a gravidade da insuficiência cardíaca e, por outro lado, também ser postas em causa como possíveis contra-indicações para terapias de substituição cardíaca (transplante cardíaco, dispositivos de assistência cardíaca). A disfunção dos órgãos terminais, em particular, tem um impacto negativo no prognóstico global. Outras investigações para prever uma possível reversibilidade da disfunção orgânica final após transplante ou suporte cardíaco mecânico (por exemplo, na insuficiência renal) são úteis, mas muitas vezes permanecem inconclusivas.
A estratificação regular do risco é essencial em caso de insuficiência cardíaca grave, a fim de não perder o tempo ideal para o encaminhamento para o centro de insuficiência cardíaca e para iniciar mais esclarecimentos, tratamento e acompanhamento. A previsão do prognóstico e da estratificação do risco associado não pode ser feita com base num único parâmetro, mas requer a inclusão de diferentes variáveis sensíveis ao prognóstico. Várias dessas pontuações multivariadas foram clinicamente validadas e são amplamente utilizadas. A pontuação de sobrevivência à insuficiência cardíaca (HFSS) e o modelo de insuficiência cardíaca de Seattle (SHFM) estão entre as pontuações mais frequentemente utilizadas na prática clínica [10,11]. Outras pontuações incluem a pontuação (MECKI) (dados do teste de Exercício Metabólico combinados com os índices Cardiac e Kidney) e a pontuação MAGGIC Meta-Analysis Global Group in Chronic Herat Failure [12–15].
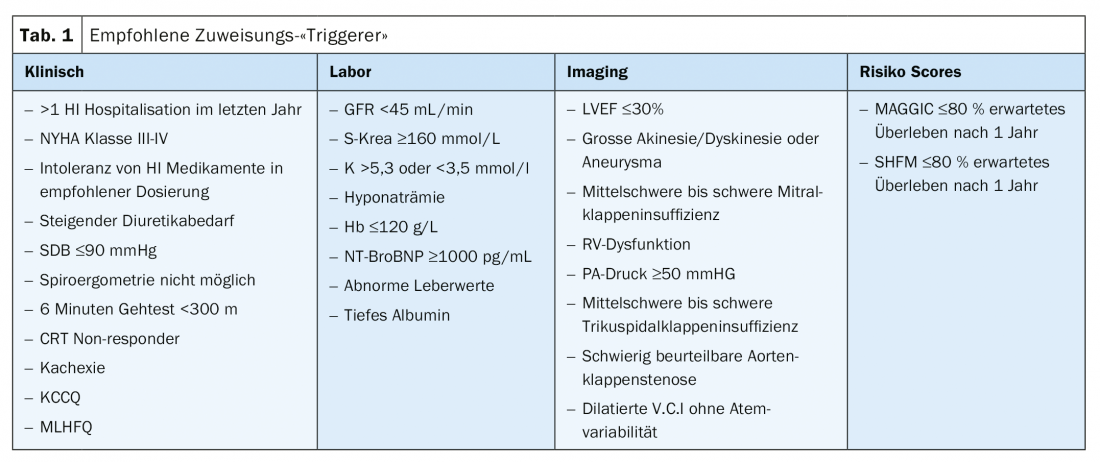
Embora a obtenção de uma determinada pontuação (por exemplo, HFSS) esteja associada a uma recomendação para a avaliação da terapia de substituição do coração, não existe actualmente nenhum valor limite acima do qual o encaminhamento para um centro de insuficiência cardíaca deve ter lugar. O quadro 1 lista os desencadeadores clínicos, laboratoriais, imagiológicos e de pontuação de risco listados pelo HFA-ESC que devem levar ao encaminhamento para um centro de insuficiência cardíaca. Infelizmente, com demasiada frequência, os doentes são encaminhados demasiado tarde. Em geral, se a definição de insuficiência cardíaca grave for cumprida, deve ser contactado um centro.
Espiroergometria e teste de caminhada de 6 minutos
A espiroergometria é uma investigação fundamental para a estratificação do risco de pacientes externos com insuficiência cardíaca. Para além da informação prognóstica, são gerados dados objectivos sobre desempenho global, limitação cardio-pulmonar e reserva cardiovascular.
Um consumo máximo de oxigénio (pVO2) ≤12 ml/kg/min (≤14 ml/kg/min sem terapia com beta-bloqueador) é considerado uma indicação para listagem para transplante cardíaco ou MCS de acordo com as directrizes [16]. As mulheres que atingirem o ≤50% do consumo máximo de oxigénio também poderão ser avaliadas para transplante cardíaco se tiverem menos de 50 anos [16]. Se o equivalente de respiração para o dióxido de carbono (V E/VCO2) for superior a 35, isto é uma indicação de um mau prognóstico.
O teste de caminhada de 6 minutos é um teste de exercício sub-maximal, ao contrário da espiroergometria, que é um teste de exercício máximo. Os resultados dos estudos relativos à correlação com a sobrevivência não são consistentes [17–20]. Se a espiroergometria não for possível, o teste de 6 minutos a pé é uma alternativa válida. Uma distância a pé de <300 metros identifica pacientes com grave intolerância ao desempenho.
Estratégias de tratamento para doentes com insuficiência cardíaca grave
Existem apenas duas estratégias de tratamento a longo prazo para a insuficiência cardíaca grave se não for escolhida uma abordagem paliativa. Estes são transplantes cardíacos ou um sistema de apoio circulatório mecânico (MCS). Sistemas mecânicos de apoio circulatório de curto prazo e drogas vasoativas intravenosas estão disponíveis como soluções de transição. A terapia básica para o excesso de hidratação é a diurética.
Tratamento de excesso de água
Os diuréticos em laço são a terapia básica para a hipervolaemia. Na insuficiência cardíaca grave, existe frequentemente resistência diurética e insuficiência renal crescente. A utilização a longo prazo de diuréticos pode levar a vários mecanismos adaptativos renais, tais como hipertrofia e hiperfunção na área do nefrónio distal, bem como a um aumento da secreção de renina. Além disso, um aumento dos aniões urémicos e da proteinúria pode prejudicar a eficácia dos diuréticos [21]. Na prática clínica, um bloqueio sequencial de nefrónio, uma combinação de um diurético de laço e um diurético de tiazida (por exemplo, Metolazone), é frequentemente utilizado para quebrar a resistência diurética. No entanto, há poucas provas para esta abordagem.
Com a chamada ultrafiltração, o fluido pode ser removido do sangue através de uma membrana semipermeável através de uma máquina de diálise. Se não houver resposta aos diuréticos perorais, recomenda-se principalmente uma mudança para a administração intravenosa. Isto deve ser iniciado com uma dose mais elevada e sucessivamente aumentada até se conseguir uma diurese suficiente. Se isto não for conseguido, recomenda-se uma combinação diurética com bloqueio sequencial de nefrónio como passo seguinte, e só se estas medidas também falharem é que a ultrafiltração deve ser considerada em casos seleccionados [7,9].
Drogas vasoactivas intravenosas
Estes desempenham um papel especialmente na situação aguda em pacientes com evidência de síndrome de baixo rendimento e hipoperfusão. Além disso, há uma indicação em pacientes seleccionados como medida de ponte até à implantação de um MCS ou à realização de um transplante de coração. Embora os inotrópicos possam melhorar os parâmetros hemodinâmicos, a maioria dos estudos não mostram qualquer melhoria nos resultados. Alguns estudos apontam mesmo para um agravamento do prognóstico [22–24]. Por conseguinte, a utilização a longo prazo de inotrópicos deve ser evitada. Apenas se não forem possíveis outras opções terapêuticas, a terapia sequencial com inotrópicos pode ser utilizada como medida paliativa em casos seleccionados [25,26].
Sistemas de apoio ao ciclo mecânico: Sistemas de curto prazo
Os sistemas de apoio circulatório mecânico a curto prazo são utilizados na fase aguda do choque cardiogénico. Permitem uma janela de tempo durante a qual a função cardíaca pode recuperar através de uma descarga máxima. Além disso, também se pode esperar pelo curso de recuperação de outros sistemas orgânicos, tais como a função neurológica após uma paragem cardiovascular. No entanto, se não houver melhoria na função cardíaca, os sistemas de curto prazo podem fornecer “uma ponte” para o implante de um dispositivo de assistência ventricular (DVA) de longo prazo ou transplante cardíaco, caso essa opção seja escolhida. Existem vários sistemas de suporte de circuitos mecânicos que podem ser utilizados por um tempo limitado. A bomba de balão intra-aórtica (IABP) é implantada percutaneamente usando um cateter. Um balão é implantado na aorta descendente e insuflado durante a diástole. Isto aumenta a pressão diastólica na raiz da aorta, resultando numa melhor perfusão coronária. A deflação do balão leva a uma redução da pós-carga e, por conseguinte, reduz o consumo de oxigénio. Actualmente, o IABP é utilizado por alguns centros, especialmente para o choque cardiogénico em doenças cardíacas isquémicas, embora as provas de uma melhoria na mortalidade não tenham sido apresentadas [1,27].
Uma Impella é uma bomba intravascular axial que também pode ser implantada através de cateter. Pode transportar até 5 litros de sangue por minuto do ventrículo esquerdo para a aorta ascendente, aliviando assim o ventrículo esquerdo. A hemodinâmica é melhorada e a pressão de enchimento é reduzida; ao mesmo tempo, a pressão de perfusão coronária é aumentada.
Embora até à data não tenham sido recolhidos dados claros sobre a melhoria da mortalidade, um pequeno estudo de registo mostrou que a utilização de um protocolo normalizado com apoio hemodinâmico precoce utilizando Impella CP em choque cardiogénico pode estar associada a um melhor resultado e a uma menor mortalidade [28].
Na oxigenação extracorporal de membrana (ECMO), o sangue é oxigenado fora do corpo através de uma membrana numa máquina especial de coração-pulmão. Além do apoio respiratório completo, a unidade ECMO inclui uma bomba axial para que se possam alcançar fluxos de até 6 L/min. O ECMO veno-arterial periférico pode ser implantado por um cardiologista intervencionista usando a técnica de Seldinger e pode manter a circulação num coração em falência e suportar a oxigenação.
Os efeitos hemodinâmicos do ECMO não são fisiológicos. Por um lado, a pré-carga do coração é reduzida através da drenagem do sangue do lado venoso. Por outro lado, a ejecção de sangue oxigenado com um fluxo de 4-6 L/min na aorta leva a um aumento da pós-carga ventricular esquerda, que, dependendo da disfunção cardíaca, pode levar a um aumento do volume diastólico final do ventrículo esquerdo e da pressão de enchimento. Para prevenir o edema pulmonar nesta situação, pode ser implantado um Impella para aliviar o ventrículo esquerdo [29]. Semelhante ao Impella, ECMO pode ser usado como “ponte para transplante” em fase terminal de insuficiência cardíaca grave ou como “ponte para a decisão” em choque cardiogénico.
Gestão a longo prazo de insuficiência cardíaca grave
Quando os sintomas de insuficiência cardíaca já não podem ser controlados ou as funções dos órgãos finais estão ameaçadas, são indicadas terapias avançadas de insuficiência cardíaca. Um pré-requisito é, evidentemente, que a terapia com medicamentos e dispositivos tenha sido optimizada e esgotada de acordo com as directrizes. Além disso, os pacientes que têm indicação de revascularização devem ser revascularizados e os pacientes com cardiopatias valvulares devem receber substituição de válvulas, se indicado.
Transplante de coração
Os doentes com insuficiência cardíaca grave e refractária sem causa tratável são potencialmente candidatos a transplante cardíaco se as alternativas de tratamento convencionais tiverem sido esgotadas. O risco avaliado na estratificação do risco deve resultar numa mortalidade de pelo menos >20% durante os 12 meses seguintes [30]. Além disso, deve ser assegurado que um transplante de coração prolonga significativamente a sobrevivência do paciente e melhora substancialmente a sua qualidade de vida. Os candidatos a transplante cardíaco devem ser motivados e emocionalmente estáveis e demonstrar uma elevada adesão e adesão à terapia. Uma avaliação de possíveis comorbidades é uma parte importante do esclarecimento preliminar, a fim de avaliar o resultado de um transplante [16,31]. As contra-indicações para transplante cardíaco estão listadas no quadro 2.
A avaliação pré-transplante inclui um historial médico completo, estado físico, espiroergometria, cateterismo cardíaco da esquerda para a direita, avaliação da doença arterial periférica, avaliação da fragilidade e estado nutricional. Além disso, as funções dos órgãos (rim, fígado, pulmão) devem ser avaliadas e realiza-se o rastreio de doenças tumorais e infecções activas. As pontuações prognósticas devem ser calculadas e devem ser realizadas mais investigações dependendo da presença de co-morbidades [16]. Além disso, é realizada uma avaliação psicossocial completa [32].

O primeiro transplante de coração foi realizado em 1967 [33]. Na Suíça, foram realizados 50 transplantes de coração em 2018 [35]. A mediana de sobrevivência é de 12,5 anos [34]. As causas mais comuns de mortalidade a longo prazo são a falência de enxertos, infecções e falência de múltiplos órgãos [34]. O risco de falência aguda letal do enxerto é maior nos primeiros 30 dias após o transplante. As complicações infecciosas com resultados fatais são mais comuns nos primeiros 12 meses devido às altas doses de imunossupressores, incluindo esteróides. O risco de uma reacção de rejeição celular relevante diminui significativamente após dois anos. A longo prazo, a mortalidade no contexto de doenças tumorais, insuficiência renal e vasculopatia de transplante torna-se mais importante [34].
Apoio mecânico a longo prazo
Uma bomba cardíaca mecânica (Ventricular Assist Device, VAD) é utilizada para suportar o ventrículo esquerdo (LVAD), o ventrículo direito (RVAD) ou ambos os ventrículos (BiVAD). Estudos mostram uma melhor sobrevivência e qualidade de vida em doentes com insuficiência cardíaca grave e refractária [9]. Um DVA pode ser usado como “ponte para transplante” enquanto se aguarda um transplante. Se um paciente não for um candidato a transplante, por exemplo devido à idade, um DVA pode ser usado como terapia de destino. O aumento relevante da resistência vascular pulmonar ou insuficiência renal grave são contra-indicações para o transplante cardíaco mas não para o implante de DVA. Tanto a resistência vascular pulmonar como a insuficiência renal grave podem melhorar com a terapia VAD [36,37]. Nestes casos, a terapia VAD é utilizada como uma “ponte para a candidatura ao transplante”. O mesmo se aplica a doenças tumorais potencialmente tratadas de forma curativa, em que deve ser demonstrado um período livre de tumores de pelo menos 5 anos antes de um possível transplante cardíaco. Em casos raros (por exemplo, miocardite fulminante), a terapia VAD pode ser usada como uma “ponte para a recuperação”.
Na actual ausência de uma solução adequada para a terapia a longo prazo de suporte cardíaco biventricular ou ventricular direito, a insuficiência ventricular direita grave continua a ser uma contra-indicação para o implante de LVAD [38].
Terapia paliativa
De todos os pacientes com insuficiência cardíaca grave, apenas alguns são elegíveis para transplante cardíaco ou terapia VAD. Quando todas as estratégias de tratamento tiverem sido esgotadas, os objectivos do tratamento em fase terminal da insuficiência cardíaca grave são alterados, passando do prolongamento da vida ao controlo dos sintomas e à optimização da qualidade de vida [39]. A terapia cardiológica convencional puramente interna é frequentemente insuficiente para aliviar o sofrimento do paciente nesta situação e recomenda-se um tratamento multidisciplinar com o envolvimento de especialistas em cuidados paliativos. O estudo PAL-HF mostrou que uma abordagem interdisciplinar paliativa levou a uma melhoria da qualidade de vida e dos sintomas de ansiedade e depressão em comparação com a terapia padrão [40]. O acesso a conceitos de tratamento paliativo deve, portanto, ser de baixo limiar para todos os doentes com insuficiência cardíaca grave. Recomenda-se também a elaboração de uma vontade de vida detalhada numa fase inicial. Se não for feito, isto deve ser feito o mais tardar antes das terapias médicas intensivas. Os desejos individuais do doente relativamente às medidas de prolongamento da vida, incluindo o estado de actividade de um desfibrilador implantado, devem ser regularmente discutidos e adaptados ao curso esperado da doença e documentados em conformidade [41]. Se possível, a decisão de interromper as terapias avançadas de insuficiência cardíaca (CDI, terapia VAD, imunossupressão) deve ser deixada ao paciente. Se o doente não puder tomar esta decisão, a decisão deve ser tomada por familiares ou prestadores de cuidados ou por um comité de ética do hospital.
Em resumo, a principal prioridade é o reconhecimento da insuficiência cardíaca grave e o encaminhamento precoce para um centro de insuficiência cardíaca terciária. A estratificação de risco adequada, incluindo escores de risco estabelecidos, espiroergometria e cateterização do coração direito, deve ser realizada a intervalos regulares pelo centro de insuficiência cardíaca. As opções de tratamento para insuficiência cardíaca grave melhoraram significativamente, particularmente devido a avanços tecnológicos significativos no campo dos dispositivos de assistência ventricular a longo prazo (DVA). Hoje em dia, também podem ser oferecidos sistemas de apoio cardíaco a pacientes mais velhos com bom sucesso terapêutico. O transplante cardíaco continua a ser o tratamento padrão de ouro. Contudo, esta continua a ser uma raridade devido à falta geral de órgãos. A ligação a uma equipa de cuidados paliativos deve ser feita numa fase inicial e pode melhorar significativamente a qualidade de vida dos pacientes afectados e dos seus familiares.
Mensagens Take-Home
- Reconhecer a insuficiência cardíaca grave
- Encaminhamento precoce para um centro de insuficiência cardíaca terciária para iniciar mais investigações, tratamentos e seguimentos
- Ligação precoce a uma equipa de cuidados paliativos
Literatura:
- Crespo-Leiro MG, et al: “Advanced heart failure: a position statement of the Heart Failure Association of the European Society of Cardiology, Eur J Heart Fail, 20(11): 1505-1535, Nov. 2018, doi: 10.1002/ejhf.1236.
- Fundação Suíça para o Coração: “The Challenge of Heart Failure” [Online]. Disponível: www.swissheart.ch/de/forschung/medizinische-fortschritte/herzinsuffizienz.html
- Xanthakis V, et al: Prevalence, Neurohormonal Correlates, and Prognosis of Heart Failure Stages in the Community, JACC Heart Fail, 4(10): 808-815, Jun. 2016, doi: 10.1016/j.cardfail.2016.03.003.
- Bjork JB, Alton KK, Georgiopoulou VV, et al: Defining Advanced Heart Failure: A Systematic Review of Criteria Used in Clinical Trials, J Card Fail, 22(7): 569-577, Jul. 2016, doi: 10.1016/j.cardfail.2016.03.003.
- Fang JC, et al: Advanced (stage D) heart failure: a statement from the Heart Failure Society of America Guidelines Committee, J Card Fail 21(6): 519-534, Jun. 2015, doi: 10.1016/j.cardfail.2015.04.013.
- Metra M, et al: Advanced chronic heart failure: A position statement from the Study Group on Advanced Heart Failure of the Heart Failure Association of the European Society of Cardiology, Eur J Heart Fail 9(6-7): 684-694, 2007, doi: 10.1016/j.ejheart.2007.04.003.
- Yancy CW, et al: 2013 ACCF/AHA guideline for the management of heart failure: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines, Circulation 128(16), 1810-1852, Oct. 2013, doi: 10.1161/CIR.0b013e31829e8807.
- Hunt SA, et al: 2009 Focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration with the International Society for Heart and Lung Transplantation, J Am Coll Cardiol 53(15): e1-e90, Apr. 2009, doi: 10.1016/j.jacc.2008.11.013.
- Ponikowski P, et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Desenvolvido com a contribuição especial, Eur J Heart Fail 18(8): 891-975, Ago. 2016, doi: 10.1002/ejhf.592.
- Aaronson KD, Schwartz JS, Chen TM, et al: Development and prospective validation of a clinical index to predict survival in ambulator patients referred for cardiac transplant evaluation, Circulation, 95(12): 2660-2667, Jun. 1997, doi: 10.1161/01.cir.95.12.2660.
- Levy WC, et al: The Seattle Heart Failure Model: prediction of survival in heart failure, Circulation 113(11): 1424-1433, Mar. 2006, doi: 10.1161/CIRCULATIONAHA.105.584102.
- Agostoni P, et al: Dados do teste de exercício metabólico combinados com índices cardíacos e renais, a pontuação MECKI: uma abordagem multiparamétrica ao prognóstico de insuficiência cardíaca, Int J Cardiol 167(6): 2710-2718, set. 2013, doi: 10.1016/j.ijcard.2012.06.113.
- Agostoni P, et al: Pontuações prognósticas multiparamétricas na insuficiência cardíaca crónica com fracção de ejecção reduzida: uma comparação a longo prazo, Eur. J Heart Fail 20(4): 700-710, Abr. 2018, doi: 10.1002/ejhf.989.
- Corra U, et al: Os dados do teste de exercício metabólico combinados com a pontuação e prognóstico do Índice Cardíaco e Rim (MECKI) na insuficiência cardíaca. Um estudo de validação, Int J Cardiol 203: 1067-1072, Jan. 2016, doi: 10.1016/j.ijcard.2015.11.075.
- Pocock SJ, et al: Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies, Eur Heart J 34(19): 1404-1413, May 2013, doi: 10.1093/eurheartj/ehs337.
- Mehra MR, et al: The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update, J. Heart Lung Transplant 35(1): 1-23, Jan. 2016, doi: 10.1016/j.healun.2015.10.023.
- Alahdab MT, Mansour IN, Napan S, Stamos TD: Teste de caminhada de seis minutos prevê mortalidade a longo prazo por todas as causas e re-hospitalização da insuficiência cardíaca em doentes afro-americanos hospitalizados com insuficiência cardíaca descompensada aguda, J Card Fail 15(2): 130-135, Mar. 2009, doi: 10.1016/j.cardfail.2008.10.006.
- Guazzi M, Dickstein K, Vicenzi M, Arena R: Teste de caminhada de seis minutos e teste de exercício cardiopulmonar em doentes com insuficiência cardíaca crónica: uma análise comparativa sobre conhecimentos clínicos e prognósticos, Circ Heart Fail 2(6): 549-555, Nov. 2009, doi: 10.1161/CIRCHEARTFAILURE.109.881326.
- Hulsmann M, et al: Prediction of outcome by neurohumoral activation, the six-minute walk test and the Minnesota Living with Heart Failure Questionnaire in an outpatient cohort with congestive heart failure, Eur Heart J 23(11): 886-891, Jun. 2002, doi: 10.1053/euhj.2001.3115.
- Wolsk E, et al: repouso e exercício de hemodinâmica em relação ao teste de caminhada de seis minutos em doentes com insuficiência cardíaca e fracção de ejecção preservada, Eur J Heart Fail 20(4): 715-722, Abr. 2018, doi: 10.1002/ejhf.976.
- Costanzo MR, et al: Extracorporeal ultrafiltration for fluid overload in heart failure: current status and prospects for further research, J Am Coll Cardiol 69(19): 2428-2445, May 2017, doi: 10.1016/j.jacc.2017.03.528.
- Cuffe MS, et al: Milrinone intravenoso de curto prazo para exacerbação aguda da insuficiência cardíaca crónica: um ensaio controlado aleatório, JAMA 287(12): 1541-1547, Mar. 2002, doi: 10.1001/jama.287.12.1541.
- O’Connor CM, et al: A dobutamina intravenosa contínua está associada a um aumento do risco de morte em doentes com insuficiência cardíaca avançada: insights do Flolan International Randomized Survival Trial (FIRST), Am Heart J 138(1) Pt 1: 78-86, Jul. 1999, doi: 10.1016/s0002-8703(99)70250-4.
- Packer M, et al: Effect of levosimendan on the short-term clinical course of patients with acutely decompensated heart failure, JACC Heart Fail 1(2): 103-111, Abr. 2013, doi: 10.1016/j.jchf.2012.12.004.
- Comín-Colet J, et al: Eficácia e segurança da administração intravenosa intermitente de levosimendan em doentes com insuficiência cardíaca avançada: o ensaio aleatório multicêntrico LION-HEART, Eur J Heart Fail 20(7): 1128-1136, Jul. 2018, doi: 10.1002/ejhf.1145.
- Altenberger J, et al: Eficácia e segurança das infusões pulsadas de levosimendan em pacientes externos com insuficiência cardíaca avançada (LevoRep) estudo: um ensaio multicêntrico aleatório, Eur J Heart Fail 16(8): 898-906, Ago. 2014, doi: 10.1002/ejhf.118.
- Unverzagt S, et al: Balão intra-aórtico de contrapulsação da bomba de balão (IABP) para enfarte do miocárdio complicado por choque cardiogénico, base de dados Cochrane Syst Rev 3: CD007398-CD007398, Mar. 2015, doi: 10.1002/14651858.CD007398.pub3.
- Costanzo MR, et al: Ultrafiltração versus diuréticos intravenosos para pacientes hospitalizados por insuficiência cardíaca descompensada aguda, J Am Coll Cardiol 49(6): 675-683, Fev. 2007, doi: 10.1016/j.jacc.2006.07.073.
- Pappalardo F, et al: O implante concomitante de Impella® sobre a oxigenação da membrana extracorpórea veno-arterial pode melhorar a sobrevivência dos pacientes com choque cardiogénico, Eur J Heart Fail 19(3): 404-412, Mar. 2017, doi: 10.1002/ejhf.668.
- Ammirati E, et al: Current indications for heart transplantation and left ventricular assistance device: a practical point point, Eur J Intern Med 25(5): 422-429, Jun. 2014, doi: 10.1016/j.ejim.2014.02.006.
- Lund LH, et al: The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant, J Heart Lung Transplant 35(10): 1158-1169, Oct. 2016, doi: 10.1016/j.healun.2016.08.017.
- Lund LH, et al: The registry of the International Society for Heart and Lung Transplantation: thirty-first official adult heart transplant report-2014; focus theme: retransplantation, J Heart Lung Transplant 33(10): 996-1008, Oct. 2014, doi: 10.1016/j.healun.2014.08.003.
- Barnard CN: A operação. Um transplante cardíaco humano: um relatório provisório de uma operação bem sucedida realizada no Hospital Groote Schuur, Cape Town, S Afr Med J 41(48): 1271-1274, Dez. 1967.
- Chambers DC, et al: The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-sixth adult lung and heart-lung transplantation Report-2019; Focus theme: donor and recipient size match, J Heart Lung Transplant 38(10): 1042-1055, Oct. 2019, doi: 10.1016/j.healun.2019.08.001.
- Federal Office of Public Health, FOPH: Dados sobre a doação e transplante de órgãos na Suíça. [Online]. Disponível: www.bag.admin.ch/bag/de/home/zahlen-und-statistiken/zahlen-fakten-zu-transplantationsmedizin/zahlen-fakten-zur-spende-und-transplantation-von-organen.html#-1057919152.
- Hasin T, et al: Changes in renal function after implantation of continuous flow left ventricular assistance devices, J Am Coll Cardiol 59(1): 26-36, Jan. 2012, doi: 10.1016/j.jacc.2011.09.038.
- Mikus E, et al: Reversibilidade da hipertensão pulmonar fixa nos receptores de dispositivos de assistência ventricular esquerda, Eur J Cardiothorac Surg 40(4): 971-977, Out. 2011, doi: 10.1016/j.ejcts.2011.01.019.
- Harjola VP, et al: Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology, Eur J Heart Fail 18(3): 226-241, Mar. 2016, doi: 10.1002/ejhf.478.
- Whellan DJ, et al: End-of-life care in patients with heart failure, J Card Fail 20(2): 121-134, Fev. 2014, doi: 10.1016/j.cardfail.2013.12.003.
- Rogers JG, et al: Palliative Care in Heart Failure: The PAL-HF Randomized, Controlled Clinical Trial, J Am Coll Cardiol, vol. 70, no. 3, pp. 331-341, Jul. 2017, doi: 10.1016/j.jacc.2017.05.030.
- Bayoumi E, Sheikh F, Groninger H: Palliative care in cardiac transplantation: an evolving model, Heart Fail Rev 22(5): 605-610, Sep. 2017, doi: 10.1007/s10741-017-9613-8.
CARDIOVASC 2020; 19(1): 6-11