A sarcoidose é uma doença granulomatosa multisistémica de etiologia ainda pouco clara. O diagnóstico de sarcoidose baseia-se no quadro clínico típico e em provas histológicas de granulomas celulares não necróticos, epitélioides, após a exclusão de outros diagnósticos diferenciais. Uma vez que mais de 90% dos doentes com sarcoidose têm uma inflamação pulmonar ou pulmonar, é importante que os pulmões não sejam danificados. Se os gânglios linfáticos intratorácicos também estiverem envolvidos, o diagnóstico é frequentemente feito por meio de biópsias obtidas por broncoscopia. Se indicado, a terapia é realizada com imunossupressores ou medicamentos imunossupressores. Imunomoduladores.
A sarcoidose é uma doença granulomatosa multisistémica de etiologia ainda pouco clara [1]. Caracteriza-se por granulomas de células epitélioides não necrotizantes em vários órgãos e, portanto, tem uma clínica variável de acordo com o envolvimento dos órgãos. Não existe um teste de diagnóstico específico, pelo que o diagnóstico se baseia em resultados clínicos típicos, na detecção dos granulomas típicos e na exclusão de diagnósticos diferenciais.
A prevalência da sarcoidose é estimada em 1-40/100.000 habitantes em todo o mundo, embora as diferentes definições de casos, a apresentação clínica variável e, em última análise, a dificuldade ocasional em fazer um diagnóstico tornem difícil uma quantificação precisa [2,3]. Além disso, foi descrita uma “divisão Norte-Sul” com maior prevalência na Escandinávia [4]; o estudo ACCESS confirmou que os afro-americanos sofrem da doença com maior frequência e de forma mais grave [5].
Na Suíça, foi encontrada uma prevalência vitalícia de 121/100.000 para o diagnóstico de sarcoidose (130/100.000 homens, 112/100.000 mulheres). Foi calculada uma prevalência de 44/100.000 para a sarcoidose activa e 16/100.000 para a sarcoidose que requer hospitalização. A incidência média anual na Suíça é estimada em 7/100.000 habitantes [6].
A doença é possível em qualquer idade, embora os adultos mais jovens (<40 anos) sejam mais susceptíveis de desenvolver a doença; existe um segundo pico de doença para o sexo feminino com a idade de >50 anos [7]. Na Suíça, a idade média no diagnóstico é de 45 +/- 15 anos (41 +/- 14 anos para os homens, 48 +/- 15 anos para as mulheres) [6].
Causa e patogénese
As causas da sarcoidose não são conhecidas. Várias hipóteses são discutidas na literatura. A doença é provavelmente desencadeada pela inalação de um agente/antigéneo (patogénico, aerossol) em doentes geneticamente predispostos, apoiada pela observação de uma incidência agrupada de sarcoidose no primeiro ano após o ataque terrorista de 11 de Setembro no World Trade Center em Nova Iorque entre bombeiros expostos ao pó [8]. Na Suíça, observou-se uma prevalência crescente em regiões com indústrias de transformação de metais e com a agricultura (processamento e cultivo de batatas e cereais em prados) [6]. Devido à característica de uma doença granulomatosa, a exposição a micobactérias ou outros agentes patogénicos também foi discutida, mas nunca provada.
A observação de uma acumulação familiar bem como étnica sugere que existe um fundo genético [9]. Diferentes alelos – principalmente do complexo de histocompatibilidade principal (MHC) e do gene ACE – foram estudados, identificando genótipos mais frequentemente associados à sarcoidose [10]. Alguns genótipos, por sua vez, têm sido associados à síndrome de Löfgren e a um curso benigno, entre outros [11].
Os processos imunológicos estão envolvidos na patogénese da sarcoidose, embora estes ainda não sejam compreendidos em pormenor. A resposta imunitária é presumivelmente desencadeada pela apresentação de um antigénio indefinido por macrófagos a linfócitos CD4+ T através de receptores MHC classe II. As quimiocinas e citocinas (incluindo TNF-α, IL-2) libertadas no processo levam à formação dos típicos granulomas constituídos por células epitelioides, células gigantes multinucleadas e linfócitos CD4+ T [12–14]. Não se sabe quais os mecanismos que levam a doença a ser auto-limitada, por um lado, e cronicamente progressiva, por outro.
Diagnóstico
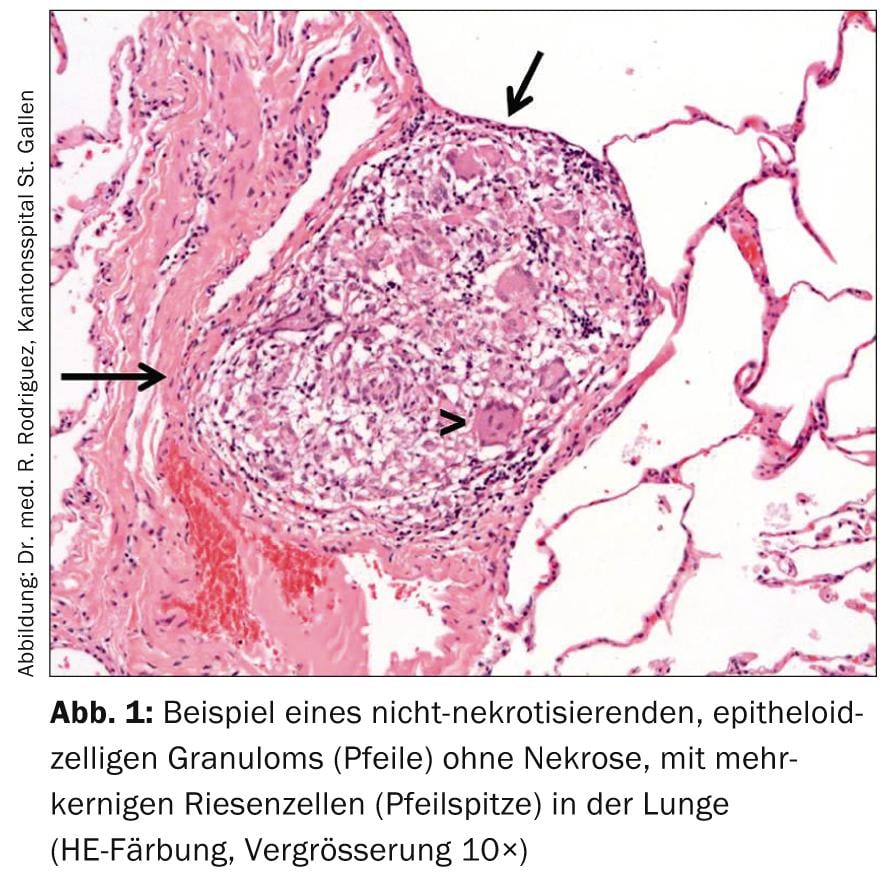
O diagnóstico de sarcoidose é feito com um quadro clínico típico, evidência histopatológica de granulomas de células não necróticas, epitélioides (Fig. 1) e após a exclusão de diagnósticos diferenciais.
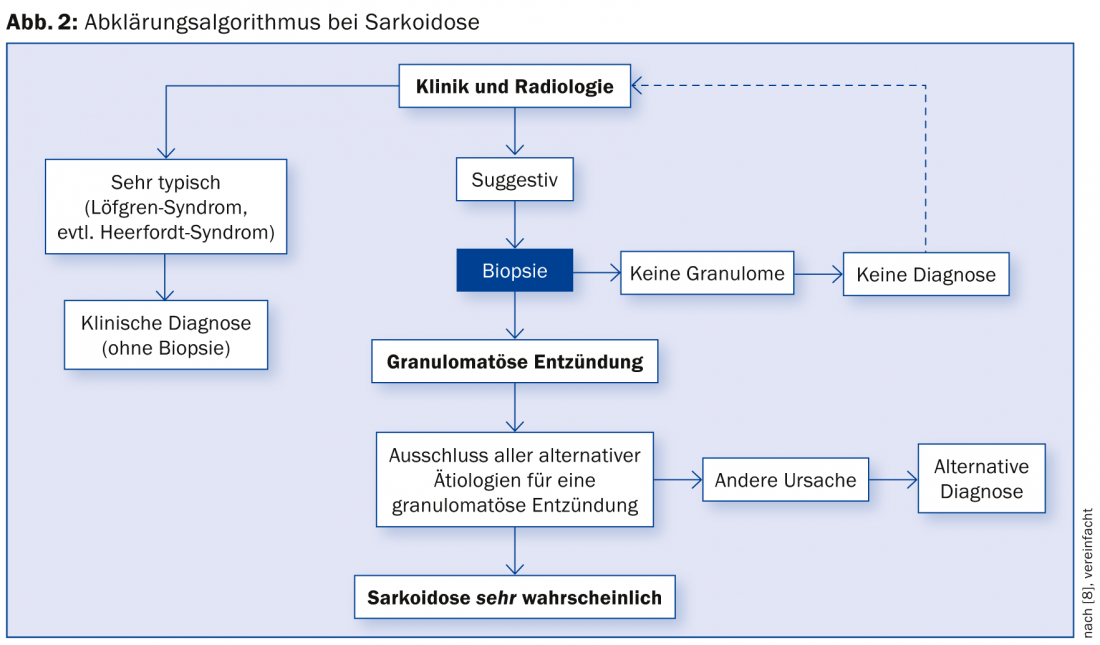
Um possível algoritmo de diagnóstico está resumido na Figura 2 [15].
Sintomas típicos
Os granulomas típicos podem desenvolver-se em qualquer órgão. Os gânglios linfáticos hilares e mediastinais, o tecido pulmonar, a pele e as estações de gânglios linfáticos extratorácicos são frequentemente afectados. É descrito com menos frequência o envolvimento oftalmológico, neurológico ou cardíaco (tab. 1); quando estes órgãos são afectados, o comprometimento clínico, a morbilidade e a mortalidade são significativos [16]. Não existe uma sintomatologia típica de sarcoidose, uma vez que praticamente todos os órgãos podem ser afectados.

Os pacientes são frequentemente assintomáticos, pelo que não é raro a sarcoidose ser um achado incidental na linfadenopatia biilar quando é realizada uma radiografia convencional [17].
Como as manifestações pulmonares estão presentes em mais de 90% dos pacientes, sintomas como tosse não produtiva, dispneia e dores torácicas são comuns. Sintomas gerais não específicos como febre, perda de peso, fadiga crónica, mal-estar, fraqueza muscular e intolerância ao exercício são também frequentemente descritos.
Síndrome de Löfgren e Síndrome de Heerfordt
A combinação de linfadenopatia bihilar, febre, eritema nodoso e artralgia/artrítides é chamada síndrome de Löfgren. Esta clínica é característica, pelo que as provas histológicas de granulomas podem ser omitidas nesta situação. A síndrome de Löfgren tem um bom prognóstico. A rara mas específica combinação de parotidite com uveíte e paresia facial periférica (“paralisia dos sinos”) com granulomas sarcóides histologicamente comprovados é conhecida como síndrome de Heerfordt.
Manifestação intratorácica
As manifestações intratorácicas vão desde a linfadenopatia bihilar isolada até à destruição parenquimatosa pulmonar grave e hipertensão pulmonar (mesmo sem alterações pulmonares). A gravidade pulmonar é classificada em cinco fases radiológicas de acordo com Siltzbach e Scadding com base na radiografia convencional (Tab. 2 e Fig. 3) [18,19].

A encenação é importante porque a informação prognóstica pode ser derivada a partir dela. Dois terços dos doentes experimentam a remissão espontânea dentro de 2-5 anos. Isto é especialmente verdade para as fases radiológicas I e II no diagnóstico.
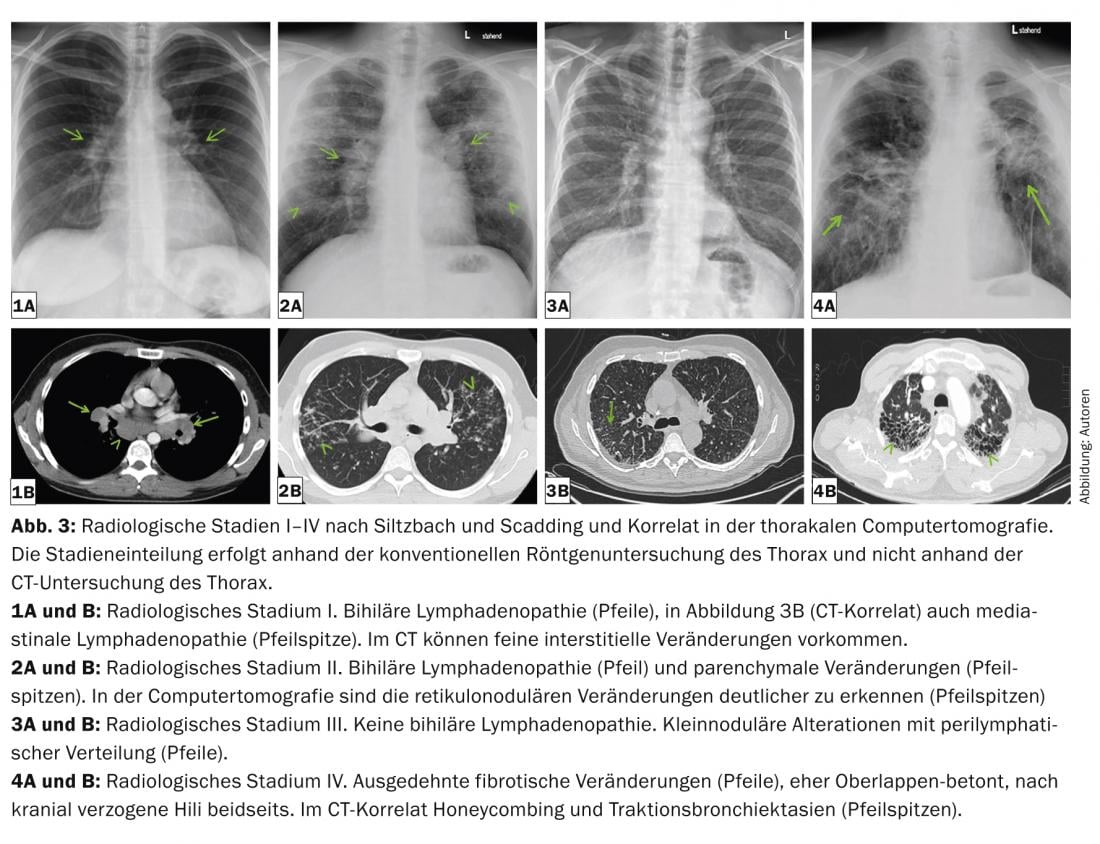
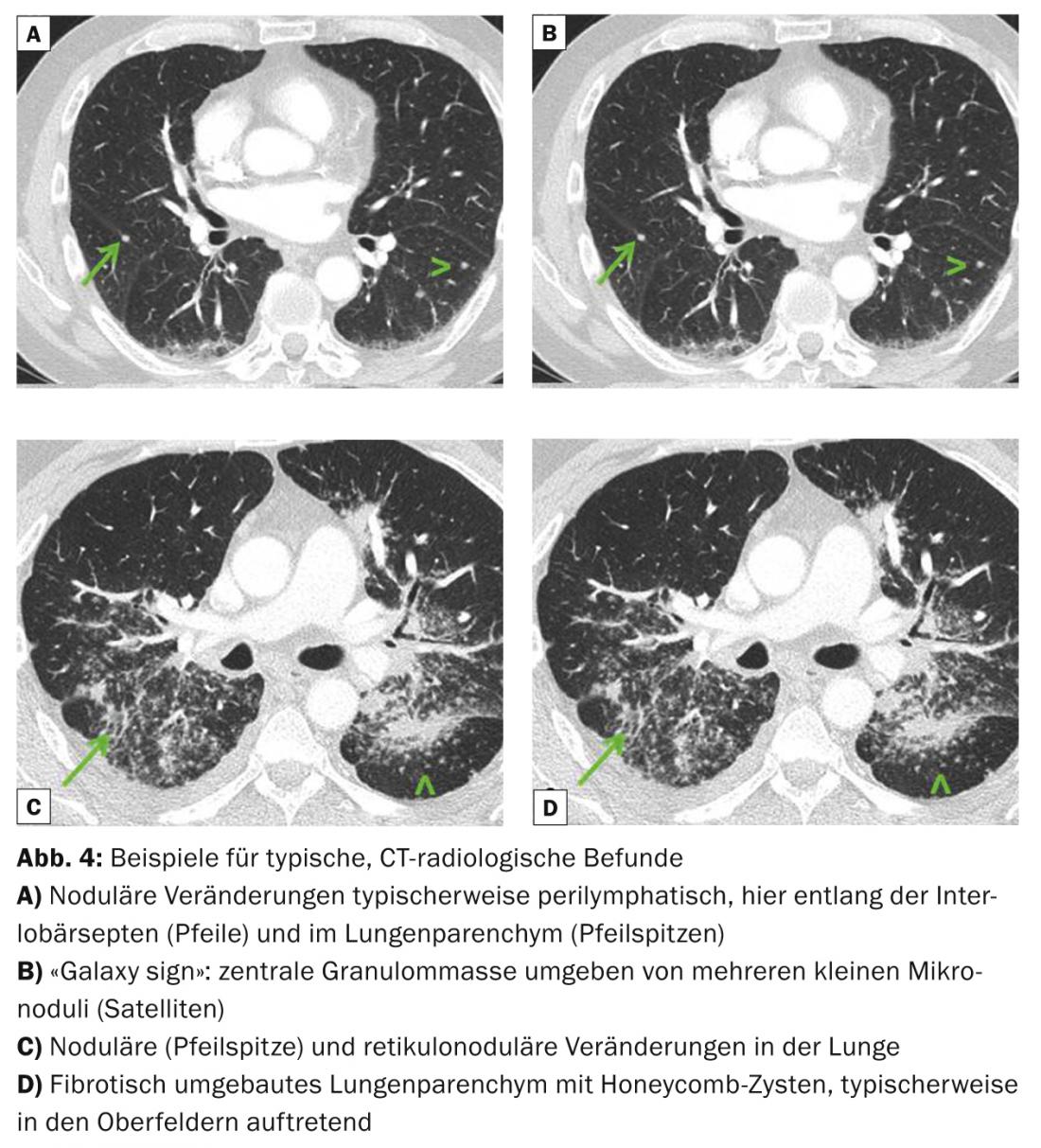
Os quadros radiológicos pulmonares típicos são um aniquilador, mas também uma linfadenopatia mediastinal simétrica, micronódulos (diâmetro <3 mm) com distribuição típica (campos superiores e médios, ao longo dos feixes bronco-vasculares, subpleurais e ao longo dos septos interlobulares), macronódulos bilaterais que raramente podem derreter (como expressão de necrose isquémica do núcleo do granuloma), opacidades de vidro moído, proliferação do desenho reticular, fibrose com colméias, bem como bronquiectasias de tracção com ênfase nos campos superiores. (Fig. 3 e 4). A tomografia computorizada de alta resolução (TCAR) é mais sensível para avaliar alterações discretas no parênquima pulmonar.
Manifestações neurológicas, cardíacas ou oftalmológicas
Na sarcoidose cardíaca, há frequentemente perturbações da condução no sentido de um bloqueio AV ou perturbações da condução intraventricular no ECG. Os pacientes podem ser assintomáticos, ter palpitações, ou ter síncope ou dispneia. sofrer arritmias até à morte cardíaca súbita, inclusive. Se o miocárdio estiver severamente envolvido, pode haver cardiomiopatia com o quadro clínico de insuficiência cardíaca. A pericardite também pode ocorrer.
O envolvimento oftalmológico manifesta-se frequentemente como uveíte, neurite do nervo óptico e inchaço das glândulas lacrimais.
No caso de envolvimento neurológico, a paresia craniana (paresia facial) ou neuropatia periférica, a irritação meníngea com evidência de linfócitos no líquido cefalorraquidiano ou infiltração da hipófise ou glândula pituitária são mais comuns. da região do hipotálamo com as correspondentes complicações endocrinológicas.
A ocorrência de hipercalcemia pode ser ameaçadora, como resultado do aumento da hidroxilação da vitamina D3 nas células epitelóides dos granulomas.
Manifestação da pele
Várias manifestações cutâneas são frequentemente descritas. São típicos os lupus pernio resp. Eritema nodoso, mas também alterações maculo-papular e nodular (Fig. 5) – frequentemente também na área das tatuagens e cicatrizes. Dependendo da localização (face), as alterações cutâneas podem levar a uma deterioração subjectiva significativa devido a desfiguração.
Provas histológicas de granulomas sarcóides
Excepto na síndrome de Löfgren, recomenda-se a evidência histológica de granulomas típicos para diagnóstico; estes são não necrotizantes, pequenos, claramente circunscritos com alguma ênfase perivascular e tendência de agregação, e possivelmente fibrose centrípeta-lamelar fina. (Fig. 2). A escolha do local de biopsia deve permitir o procedimento menos invasivo possível (por exemplo, biopsia de pele, biopsia de glândulas lacrimais, excisão de gânglios linfáticos periféricos).
Apenas cerca de 2% de todos os doentes com sarcoidose extrapulmonar não têm envolvimento pulmonar [16]. Por este motivo, são utilizadas técnicas broncoscópicas para tentar identificar histologias ou para colher amostras citológicas. Nas lesões endobrônquicas (mucosa alterada em forma de paralelepípedo em até 50% dos doentes [20]), pode ser obtida uma biopsia da mucosa através de biopsia com fórceps; um resultado positivo pode ser esperado em mais de 60% dos doentes [21]. As biópsias pulmonares transbrônquicas podem ser utilizadas para obter amostras úteis ao diagnóstico em 60-97% dos doentes (dependendo do número de biópsias realizadas e da extensão das alterações parenquimatosas pulmonares radiológicas) [22–24], e a aspiração por agulha transbrônquica (TBNA) guiada sonograficamente de gânglios linfáticos mediastinais e/ou hilares em aproximadamente 80% dos doentes [25]. A combinação destas técnicas melhora o rendimento diagnóstico, de modo que a mediastinoscopia, que costumava ser frequentemente necessária, só muito raramente é agora utilizada.
A broncoscopia envolve normalmente lavagens broncoalveolares. A sarcoidose é provável – mas não provada – se houver evidência de alveolite linfocítica (>15% linfócitos), um quociente CD4/CD8 aumentado >3,5 e uma infecção (incluindo micobactérias) é excluída. A sensibilidade do quociente CD4/CD8 é de 42-59% e a especificidade é de 76-96% para o aumento do quociente >3,5 [26,27].
Usando tecnologia PET/CT, os focos inflamatórios podem ser retratados como regiões com maior absorção de FDG em casos seleccionados. Se o local da biópsia não puder ser claramente definido devido aos resultados clínicos, a tecnologia PET/CT pode ser utilizada para tentar identificar um foco inflamatório.
Diagnósticos diferenciais a excluir
O diagnóstico de sarcoidose com um quadro clínico típico e provas dos achados histopatológicos apropriados pode ser feito quando outras doenças granulomatosas tiverem sido excluídas. Os diagnósticos diferenciais incluem doenças infecciosas tais como tuberculose, infecções fúngicas (histoplasmose, coccidioidomicose), brucelose ou tularemia. Estas doenças podem ser descartadas por meio de lavagens broncoalveolares se houver uma suspeita clínica. Os diagnósticos diferenciais incluem também doenças malignas, especialmente linfomas e carcinomas (exclusão por achados histopatológicos). A beriliose crónica pode causar um quadro pulmonar muito semelhante à sarcoidose. Para diferenciar a beriliose, é importante ter uma história profissional precisa. Em caso de suspeita, o diagnóstico é feito por estimulação in vitro das células mononucleares a partir do sangue ou de fluido no lavado broncoalveolar. Além disso, a alveolite alérgica exógena (história, quociente CD4/CD8 reduzido), pneumonite induzida por drogas (história) e granulomas no contexto de uma reacção de corpo estranho (histologia) deve ser excluída. Como os granulomas da sarcoidose também podem ocorrer perivascularmente, a diferenciação de uma vasculite no material da biópsia pode ser difícil.
Os pequenos granulomas, bem definidos nos gânglios linfáticos drenantes, no estroma circundante, mas também no fígado ou no baço de doentes com doenças malignas são referidos como “reacção sarcóide”; tais granulomas ocorrem em cerca de 4% dos doentes com carcinomas (incluindo cancro da mama, bem como carcinomas renais e gastrintestinais) e um pouco mais frequentemente em doentes com Hodgkin (14%) e doentes não-Hodgkin (7%) [28].
Outro importante diagnóstico diferencial quando é detectada doença granulomatosa é a imunodeficiência variável comum (CVID). Esta caracteriza-se por baixos níveis séricos de imunoglobulina, infecções bacterianas recorrentes e uma resposta reduzida de anticorpos. Alguns dos pacientes desenvolvem inflamação granulomatosa com granulomas não necrosantes nos pulmões, baço, fígado e gânglios linfáticos, entre outros [29].
A sarcoidose é tratada, entre outras coisas, com inibidores de TNF-α. Paradoxalmente, a inflamação granulomatosa tem sido descrita durante a terapia com inibidores de TNF-α, especialmente etanercept em artrite reumatóide, mas também infliximab [30]. Também podem ocorrer granulomas não calcificantes relacionados com a terapia com interferon-γ (por exemplo, na hepatite crónica C) [31].
Avaliação do trabalho e do progresso
Uma vez feito o diagnóstico de sarcoidose, recomenda-se a realização de um trabalho de verificação sobre a extensão da doença. Em particular, as manifestações de órgãos que possam levar a uma morbilidade significativa devem ser rastreadas (Tab. 3).
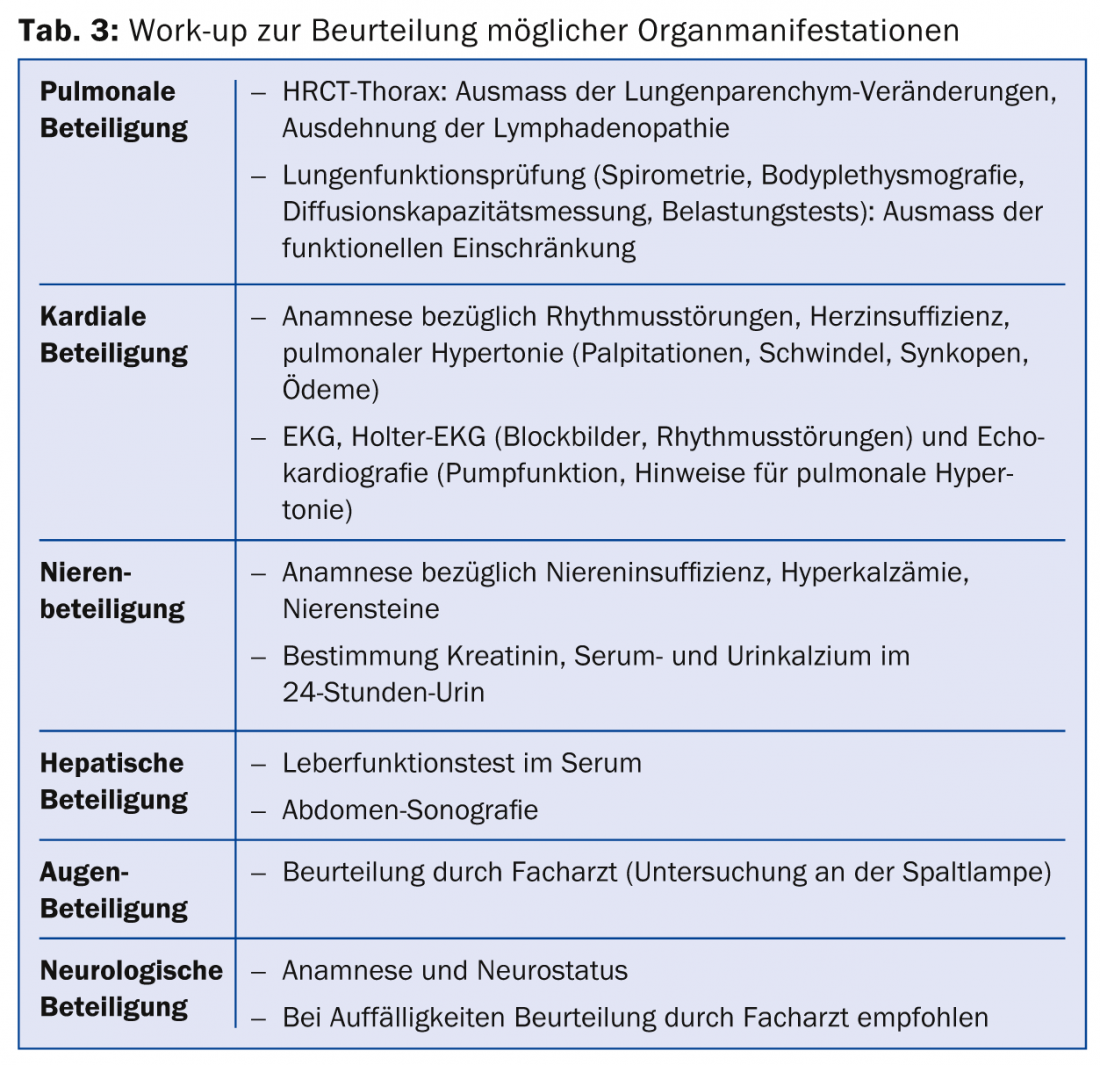
Além disso, devem ser definidos os parâmetros que podem ser utilizados para a avaliação do curso (por exemplo, também em terapia). A enzima conversora de angiotensina (ACE) está determinada a avaliar o possível envolvimento medular. ACE é produzido, entre outras coisas, nas células epitelóides dos granulomas em sarcoidose [32]. Contudo, devido à baixa sensibilidade, o ACE não é adequado como teste de diagnóstico. Se elevado no diagnóstico, o ACE é um possível parâmetro de acompanhamento. Outro possível paramentador da progressão é o receptor solúvel da interleucina-2: as células que apresentam antigénio produzem interleucina 2 (IL-2) em ligação com a formação do granuloma. Isto leva à activação de células T. Isto liberta uma forma solúvel do receptor de interleucina-2 (receptor sIL-2) para a corrente sanguínea. Uma vez que um aumento do receptor sIL-2 reflecte a activação não específica dos linfócitos T, a actividade da doença pode ser determinada com ele e, assim, o curso pode ser avaliado.
Prognóstico e indicação para a terapia
O curso da doença não pode ser previsto. Contudo, o prognóstico é favorável em cerca de dois terços dos pacientes: a remissão ocorre dentro de uma década, e em cerca de 50% dos pacientes dentro de três anos. Em cerca de um terço dos doentes, a doença progride cronicamente, com uma deficiência funcional relevante dos órgãos afectados. Menos de 5% de todos os pacientes morrem de sarcoidose. A mortalidade é principalmente devida à fibrose pulmonar com insuficiência respiratória, envolvimento cardíaco ou neurológico ou hipertensão pulmonar [33].
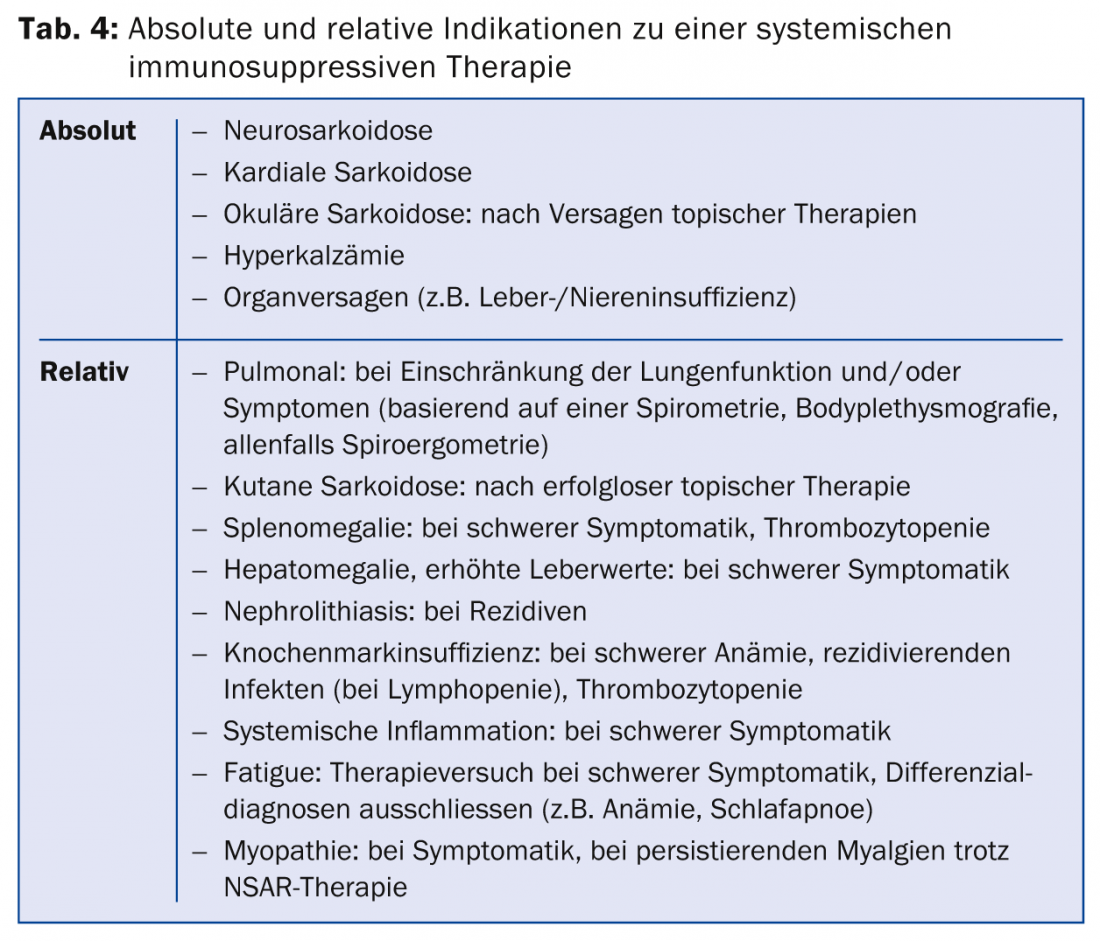
A indicação de terapia deve ser feita com muito cuidado, no conhecimento do curso mais espontaneamente favorável da doença, dos potenciais efeitos secundários da terapia e do aumento da taxa de recorrência após terapia com imunossupressores (o antigénio postulado persiste no órgão afectado, de modo a que a formação do granuloma possa voltar a ocorrer após a interrupção da terapia). Existe uma indicação absoluta de terapia em casos de neurosarcoidose, sarcoidose cardíaca ou ocular com envolvimento do segmento médio ou posterior do olho, bem como em casos de grave comprometimento funcional dos órgãos afectados, tipicamente insuficiência hepática ou renal, mas também de grave disfunção pulmonar. No caso de limitação ligeira e moderada, é possível a observação clínica cuidadosa do curso: se os sintomas estiverem presentes e a limitação funcional for progressiva, e assim houver indicações de actividade da doença, a terapia é normalmente iniciada.
Terapia com imunossupressores/imunomoduladores
Se houver uma indicação de terapia (tab. 4), são utilizados imunossupressores ou drogas imunossupressoras. são utilizados imunomoduladores (tab. 5) .
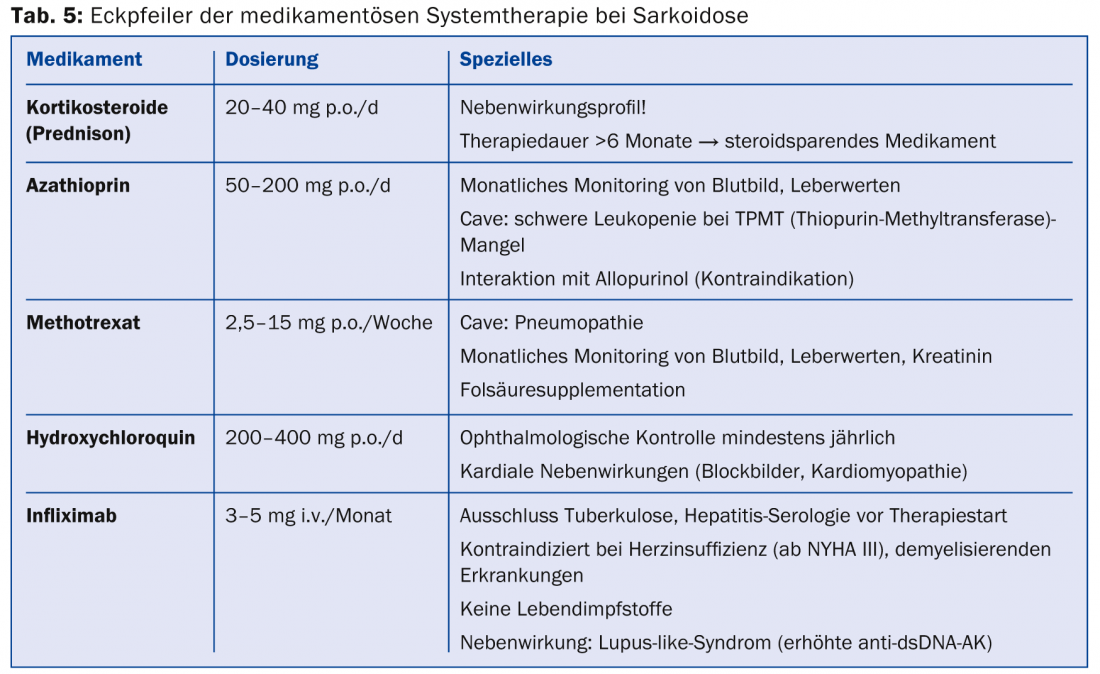
Devido à sua boa e rápida eficácia, os corticosteróides são a primeira escolha. São recomendadas doses de 20-40 mg em dosagem gradual durante cerca de meio ano, mas não há ensaios controlados aleatoriamente. A utilização de substâncias com esteroides (azatioprina, metotrexato, leflunomida, micofenolato) para efeitos secundários associados aos esteroides deve ser avaliada precocemente. No entanto, o metotrexato deve ser prescrito cautelosamente na sarcoidose pulmonar devido à possibilidade de uma pneumonia por metotrexato. Uma vez que a TNF-α está envolvida na formação de granulomas, os antagonistas de TNF-α (especialmente o infliximab) são uma boa terapia alternativa de segunda linha [34,35]. Um benefício poderia ser demonstrado sobretudo para a terapia da sarcoidose cutânea (lupus pernio) bem como para as manifestações pulmonares e neurológicas. O medicamento antimalárico hidroxicloroquina atinge bons resultados na sarcoidose cutânea e na hipercalcemia. Na síndrome de Löfgren, a terapia sintomática com anti-inflamatórios não esteróides é estabelecida.
Literatura:
- Hunninghake GW, et al: Declaração ATS/ERS/WASOG sobre sarcoidose. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidose Vasc Diffuse Lung Dis 1999; 16(2): 149-173.
- Fernandez FE: [Epidemiology of sarcoidosis]. Arch Bronconeumol 2007; 43(2): 92-100.
- Rybicki BA, Iannuzzi MC: Epidemiologia da sarcoidose: avanços recentes e perspectivas futuras. Semin Respir Criteria Care Med 2007; 28(1): 22-35.
- Pietinalho A, et al: A frequência da sarcoidose na Finlândia e Hokkaido, Japão. Um estudo epidemiológico comparativo. Sarcoidose 1995; 12(1): 61-67.
- Rossman MD, Kreider ME: Lição aprendida do ACCESS (A Case Controlled Etiologic Study of Sarcoidosis). Proc Am Thorac Soc 2007; 4(5): 453-456.
- Deubelbeiss U, et al.: A prevalência da sarcoidose na Suíça está associada a factores ambientais. Eur Respir J 2010; 35(5): 1088-1097.
- Hosoda Y, et al.: Epidemiologia global da sarcoidose. Que história nos contam a prevalência e a incidência? Clin Chest Med 1997; 18(4): 681-694.
- Izbicki G, et al: World Trade Center “sarcoid-like” granulomatous pulmonary disease in New York City Fire Department rescue workers. Peito 2007; 131(5): 1414-1423.
- McGrath DS, et al: Epidemiologia da sarcoidose familiar no Reino Unido. Tórax 2000; 55(9): 751-754.
- Rossman MD, et al: HLA-DRB1*1101: um factor de risco significativo para sarcoidose em negros e brancos. Am J Hum Genet 2003; 73(4): 720-735.
- Berlin M, et al: HLA-DR prevê o prognóstico em doentes escandinavos com sarcoidose pulmonar. Am J Respir Crit Care Med 1997; 156(5): 1601-1605.
- Baughman RP, et al: Libertação do factor de necrose tumoral por macrófagos alveolares de pacientes com sarcoidose. J Lab Clin Med 1990; 115(1): 36-42.
- Iida K, et al: Análise de subconjuntos de células T e quimiocinas beta em doentes com sarcoidose pulmonar. Tórax 1997; 52(5): 431-437.
- Pinkston P, Bitterman PB, Crystal RG: libertação espontânea de interleucina-2 por linfócitos T pulmonares em sarcoidose pulmonar activa. N Engl J Med 1983; 308(14): 793-800.
- Judson MA: O diagnóstico de sarcoidose. Clin Chest Med 2008; 29(3): 415-427, viii.
- Baughman RP, et al: Características clínicas dos pacientes num estudo de controlo de casos de sarcoidose. Am J Respir Crit Care Med 2001; 164(10 Pt 1): 1885-1889.
- Thomas KW, Hunninghake GW: Sarcoidose. JAMA 2003; 289(24): 3300-3303.
- Siltzbach LE: Sarcoidose: características clínicas e gestão. Med Clin North Am 1967; 51(2): 483-502.
- Scadding JG: Prognóstico de sarcoidose intratorácica em Inglaterra. Uma análise de 136 casos após cinco anos de observação. Br Med J 1961; 2(5261): 1165-1172.
- Chapman JT, Mehta AC: Broncoscopia em sarcoidose: intervenções diagnósticas e terapêuticas. Curr Opinião Pulm Med 2003; 9(5): 402-407.
- Shorr AF, Torrington KG, Hnatiuk OW. Biópsia endobronquial para sarcoidose: um estudo prospectivo. Peito 2001; 120(1): 109-114.
- Koerner SK, et al: Biopsia pulmonar transbrônquica para o diagnóstico de sarcoidose. N Engl J Med 1975; 293(6): 268-270.
- Gilman MJ, Wang KP: biopsia pulmonar transbrônquica em sarcoidose. Uma abordagem para determinar o número óptimo de biópsias. Am Rev Respir Dis 1980; 122(5): 721-724.
- Mitchell DM, et al: Biopsia pulmonar transbrônquica através de broncoscópio de fibra óptica no diagnóstico de sarcoidose. Br Med J 1980; 280(6215): 679-681.
- Agarwal R, et al: Eficácia e segurança da sonda convexa EBUS-TBNA em sarcoidose: uma revisão sistemática e meta-análise. Respir Med 2012; 106(6): 883-892.
- Costabel U: rácios CD4/CD8 no fluido de lavagem broncoalveolar: de valor para o diagnóstico de sarcoidose? Eur Respir J 1997; 10(12): 2699-2700.
- Zaiss AW, et al: [rácio T4/T8 no fluido de lavagem broncoalveolar: sensibilidade e especificidade para o diagnóstico de sarcoidose]. Prax Klin Pneumol 1988; 42 Suppl 1: 233-234.
- Chowdhury FU, et al: reacção tipo sarcoide à malignidade em corpo inteiro integrado (18)F-FDG PET/CT: prevalência e padrão de doença. Clin Radiol 2009; 64(7): 675-681.
- Ardeniz O, Cunningham-Rundles C: Doença granulomatosa em imunodeficiência variável comum. Clin Immunol 2009; 133(2): 198-207.
- Khasnis AA, Calabrese LH: inibidores do factor de necrose tumoral e doença pulmonar: um paradoxo de eficácia e risco. Semin Arthritis Rheum 2010; 40(2): 147-163.
- Goldberg HJ, et al: Sarcoidose após tratamento com interferon-alfa: uma série de casos e revisão da literatura. Respir Med 2006; 100(11): 2063-2068.
- Studdy PR, Bird R: enzima de conversão da angiotensina sérica na sarcoidose – o seu valor na prática clínica actual. Ann Clin Biochem 1989; 26(Pt 1): 13-18.
- Siltzbach LE, et al: Curso e prognóstico da sarcoidose em todo o mundo. Am J Med 1974; 57(6): 847-852.
- Judson MA, et al: Eficácia do infliximab em sarcoidose extrapulmonar: resultados de um julgamento aleatório. Eur Respir J 2008; 31(6): 1189-1196.
- Baughman RP, et al: Terapia Infliximab em doentes com sarcoidose crónica e envolvimento pulmonar. Am J Respir Crit Care Med 2006; 174(7): 795-802.
PRÁTICA DO GP 2015; 10(3): 10-18











