Uma rápida clarificação microbiológica com diagnósticos sensíveis e específicos é importante devido ao aumento da resistência aos antibióticos, especialmente com os gonococos. Este artigo de revisão fornece conhecimentos sobre aspectos epidemiológicos e de diagnóstico de infecções com Chlamydia trachomatis e Neisseria gonorrhoeae.
Na Suíça e noutros países europeus, tem havido um rápido aumento das doenças sexualmente transmissíveis nos últimos anos. Uma rápida clarificação microbiológica com diagnósticos sensíveis e específicos é importante devido ao aumento da resistência aos antibióticos, especialmente com os gonococos. Este artigo de revisão visa fornecer conhecimentos sobre aspectos epidemiológicos e de diagnóstico de infecções com Chlamydia trachomatis e Neisseria gonorrhoeae.
Epidemiologia
Os números de infecções por Chlamydia trachomatis, Neisseria gonorrhoeae e Treponema pallidum aumentaram significativamente em termos absolutos e relativos na Suíça e em muitos países europeus nos últimos anos [1,2]. Na Suíça, estes três agentes patogénicos bacterianos e vírus de transmissão sexual, tais como o VIH e o vírus da hepatite B, devem ser notificados pelo laboratório de diagnóstico por lei. A notificação obrigatória destas doenças permite a vigilância epidemiológica (www.bag.admin.ch) e a identificação de factores e populações de risco.
Nos cantões de Basileia-Stadt, Zurique, Genebra e Vaud, o aumento das doenças sexualmente transmissíveis é significativo, enquanto que foram documentados números mais baixos nas zonas rurais [1]. Embora seja provável que o grande desenvolvimento no diagnóstico molecular nos últimos anos e a maior cobertura diagnóstica nos centros urbanos expliquem parte deste aumento, é também muito provável que o comportamento sexual descuidado seja parcialmente responsável, embora estudos bem fundamentados sobre este tópico sejam raros. Pode postular-se que a possibilidade de profilaxia pré-exposição específica do VIH reduziu significativamente o medo de infecção pelo VIH. Isto aceita um risco sexualmente mais elevado para outras infecções. Para certas populações de risco com infecções bacterianas recorrentes, a profilaxia contra a clamídia e os gonococos está, portanto, a ser discutida [3,4]. No entanto, até agora faltam estudos randomizados nesta área, também no contexto da resistência aos antibióticos.
Neisseria gonorrhoeae: Em 2015, 1895 foram relatadas na Suíça infecções confirmadas de N. gonorrhoeae, o que é aproximadamente 23% mais do que no ano anterior com 1545 relatórios (Fig. 1A, ). A maioria dos casos afectou os homens (cerca de 80%). No entanto, tem havido um aumento significativo em ambos os sexos desde 2000. A incidência na Suíça em 2015 foi de 9 por 100.000 habitantes para as mulheres e 37 por 100.000 habitantes para os homens [5]. A maioria dos casos ocorre em centros urbanos. A maior proporção de mulheres foi encontrada na faixa etária 15-24, e entre os homens, a faixa etária 25-34 é particularmente afectada. Observou-se um aumento particularmente forte no grupo de homens que têm contacto sexual com outros homens (HSH). Estima-se que apenas 3% da população sexualmente activa são HSH, mas de acordo com estudos da FOPH mostram uma média de 38% de infecções de gonorreia [5].
Chlamydia trachomatis: Em 2015, foram relatadas 10.157 infecções confirmadas de C. trachomatis na Suíça, o que é aproximadamente 5% mais do que no ano anterior com 9677 relatórios (Fig. 1B, ). Globalmente, o número de casos mais do que duplicou nos últimos dez anos. A incidência na Suíça em 2015 foi de 161 por 100.000 habitantes para as mulheres e 80 por 100.000 habitantes para os homens [6]. Isto pode ser parcialmente um pseudo-aumento, uma vez que a percentagem de testes positivos em todos os testes realizados se manteve relativamente estável [7]. Certamente, estão também a ser diagnosticadas mais infecções assintomáticas, o que tem a ver com a disponibilidade de diagnósticos moleculares sensíveis e de rastreios mais frequentes. Aproximadamente 70% das infecções ocorrem em mulheres, metade das quais com idades compreendidas entre os 15-24 anos. Em 70-90% das mulheres, a infecção é assintomática.

Diagnóstico de N. gonorrhoeae – Colheita de espécimes
A recolha correcta de espécimes é fundamental para a detecção cultural de N. gonorreia. Os gonococos tendem à autólise e são sensíveis à dessecação e a substâncias tóxicas de alguns lubrificantes [8].
Actualmente, os meios de transporte universais líquidos são utilizados como meios de recolha e transporte de escolha, que permitem a realização de culturas bacterianas e análises de diagnóstico molecular (PCR) (por exemplo, eSwab de Copan). Estes meios de transporte contêm novos esfregaços com fibras de nylon do bando que aumentam o rendimento da colheita de amostras em comparação com os esfregaços convencionais [9–11]. Contudo, como também existem laboratórios de diagnóstico que requerem diferentes recipientes de transporte para PCR e cultura gonocócica, recomendamos que se consulte o respectivo laboratório de exame antes de colher a amostra.
O sítio de recolha deve ser escolhido de acordo com a história sexual [12]. Nos homens, os esfregaços uretrais e a urina de primeiro jacto são considerados o material de exame de eleição. Ambas as amostras devem ser colhidas pelo menos uma hora após a última micturição. Um esfregaço cervical deve ser tomado como o material de exame de eleição nas mulheres. As amostras de urina das mulheres não devem normalmente ser utilizadas, uma vez que são menos sensíveis do que os esfregaços cervicais [13]. Em raparigas pré-puberais, as infecções com gonococos devem ser procuradas vaginalmente e não cervicalmente [14]. Nesta faixa etária, raparigas e rapazes devem, naturalmente, consultar um pediatra.
Os esfregaços rectais devem ser obtidos com um rectoscópio. A utilização de lubrificantes deve ser evitada, uma vez que estes por vezes contêm substâncias tóxicas para a N. gonorreia e reduzem a sensibilidade da detecção cultural. A técnica de recolha deve cobrir uma área de esfregaço tão grande quanto possível [15]. Um estudo mostrou que, no caso da infecção orofaríngea, a maior área possível com pressão adicional durante o esfregaço quase duplicou a taxa de detecção [15]. Para uma orientação detalhada sobre a colheita óptima de espécimes para o diagnóstico da gonorreia, consulte as recomendações da Comissão Federal de Saúde Sexual e da Sociedade Suíça de Infecciologia [13]. Se for desejada uma cultura gonocócica, a amostra deve ser colhida antes da administração de antibióticos. O transporte das amostras para o laboratório deve ser o mais rápido possível e o cultivo cultural deve, de preferência, ter lugar no prazo de vinte e quatro horas [16]. A amostra pode ser enviada no meio de transporte à temperatura ambiente.
Microscopia
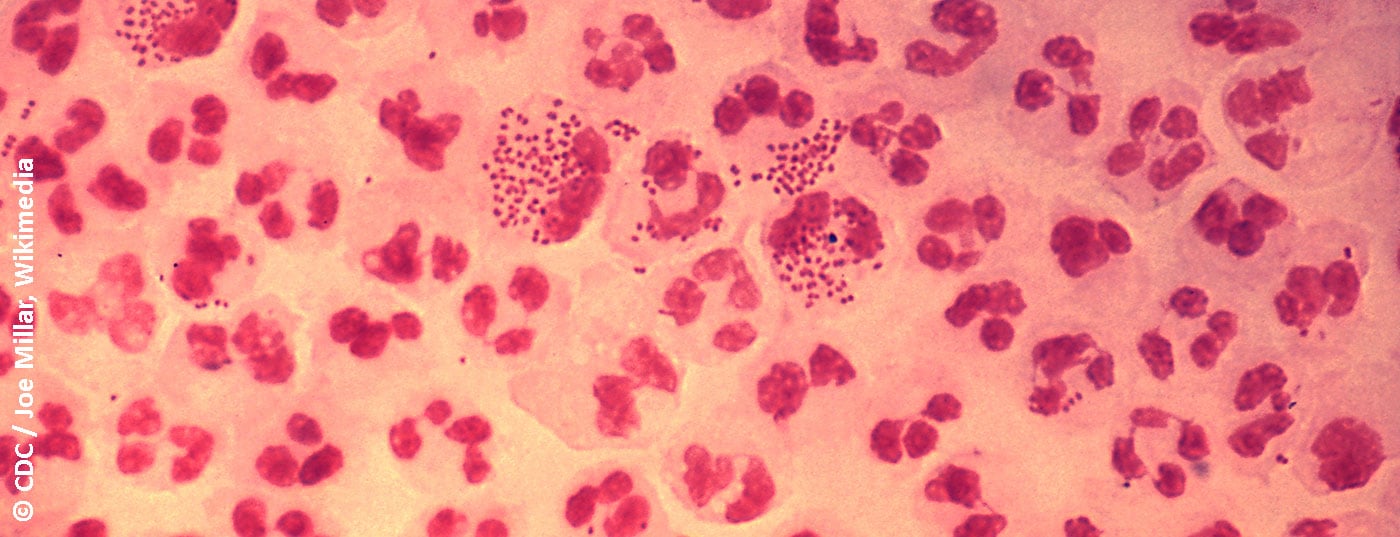
Em homens sintomáticos, a detecção é possível com uma preparação de Gram a partir de uma zaragatoa uretral. A detecção de Gram-negativos, diplococos em forma de sémen a café em leucócitos polinucleares é seminal para a gonorreia [17]. A sensibilidade e especificidade deste exame é >90% [14]. Nas mulheres, a sensibilidade da análise microscópica de um esfregaço cervical é inferior a 50-70%, mas a especificidade é >90% [14]. Naturalmente, a fiabilidade da microscopia depende da qualidade da amostra e da experiência do examinador [14]. A microscopia não é útil para diagnosticar uma infecção orofaríngea porque a Neisseria spp. apatogénica como componente da flora oral não permite uma diferenciação fiável da N. gonorrhoeae patogénica.
Métodos biológicos moleculares
Actualmente, estão disponíveis vários sistemas comerciais que permitem a detecção de N. gonorreia e C. trachomatis a partir da mesma amostra através da amplificação do ADN (PCR) – os chamados PCRs duplex. A sensibilidade e especificidade destes sistemas são excelentes, cada um em >95% [18–21], e são portanto agora padrão para a detecção de infecções por N. gonorreiae e C. trachomatis [22].
Recentemente, existem também PCRs multiplex que permitem uma clarificação mais ampla com outros agentes patogénicos como o Mycoplasma hominis, M. genitalium, Ureaplasma urealyticum, e U. parvum [23,24]. Os testes moleculares com sistemas (semi)automatizados são menos dispendiosos do que os métodos de cultura e permitem um elevado rendimento de amostras clínicas, especialmente para um rastreio rápido. O tempo desde a recepção da amostra no laboratório até ao resultado (o chamado turn-around time) é normalmente de apenas algumas horas, e os resultados estão frequentemente disponíveis no mesmo dia, dependendo da hora de recepção da amostra. Os métodos PCR não devem ser utilizados para documentar o sucesso do tratamento a curto prazo, uma vez que o ADN de N. gonorreiae ainda pode ser determinado várias semanas após o tratamento bem sucedido utilizando métodos de detecção sensíveis [14]. As reinfecções ou isolados resistentes podem também ser responsáveis [25]. Neste caso, o historial médico deve ser retomado e deve seguir-se uma detecção cultural com testes de resistência aos antibióticos.
Outros métodos de detecção
Os testes de ponto de tratamento (POC) para a detecção de esterase leucocitária e os testes imunocromatográficos mostram baixa sensibilidade nas infecções por N. gonorrohoeae, com apenas 23-85% e 60-94%, respectivamente [26]. Neste momento, os métodos baseados em PCR são, portanto, claramente superiores.
Cultura bacteriana
A detecção cultural de gonococos viáveis é necessária para detectar possíveis falhas de tratamento e para recolher dados fiáveis sobre a situação e a evolução da resistência. Os gonococos são geralmente cultivados em meios selectivos. Os meios de comunicação contêm antibióticos e antifúngicos para inibir a flora bacteriana e fúngica que os acompanha. Um meio típico, que também é utilizado no nosso laboratório, é o ágar Martin-Lewis à base de ágar sangue de cozinha. As placas inoculadas são verificadas diariamente quanto ao crescimento e incubadas durante 48 horas a 36°C numa atmosfera de 5% de CO2. Os gonococos crescem como colónias pequenas, suaves e cinzentas no primeiro ou segundo dia. Assim, uma detecção cultural de bactérias vivas demora geralmente entre dois a três dias, em contraste com uma PCR, mas oferece mais possibilidades de diagnóstico.
A identificação exacta das colónias suspeitas na placa de cultura costumava ser feita através de testes a várias reacções bioquímicas, que levavam várias horas a estabelecer um perfil bioquímico. Actualmente, a identificação de um isolado bacteriano é realizada em poucos minutos utilizando a espectrometria de massa Matrix Assisted Laser Desorption Ionisation – Time of Flight (MALDI-TOF). A espectrometria de massa MALDI-TOF tornou-se agora o padrão de identificação de uma grande variedade de bactérias e fungos em laboratórios de microbiologia [27]. No entanto, o factor de limitação temporal continua a ser o cultivo das bactérias numa placa de ágar.
Posição de resistência
A Organização Mundial de Saúde (OMS) compilou recentemente uma lista de germes resistentes para os quais deveriam ser desenvolvidos urgentemente novos antibióticos eficazes – entre eles estão os resistentes à cefalosporina e à fluoroquinolona N. gonorrhoeae (www.who.int). O teste de resistência após a detecção cultural de N. gonorreiae é importante [13,28]. Apesar da urgência, a vigilância da resistência antimicrobiana não está estandardizada ou suficientemente estabelecida em muitos países [29]. Os seguintes antibióticos são normalmente testados para N. gonorreia: Cefixime, ceftriaxona, fluoroquinolonas (por exemplo ciprofloxacina) e azitromicina. Os testes de resistência requerem um período adicional de dois dias após a identificação.
O tratamento da N. gonorreia é complicado pelo desenvolvimento da resistência aos antibióticos. Embora a penicilina ainda fosse considerada o tratamento de eleição nos anos 70, o aumento das penicilinases mediadas por plasmídeos (enzimas que libertam penicilina) e da resistência cromossómica à penicilina pôs fim à terapia de penicilina [30]. Do mesmo modo, o desenvolvimento da resistência plasmídica e cromossómica à tetraciclina levou à utilização de cefalosporinas de largo espectro nos anos 80 e, mais tarde, à utilização de fluoroquinolonas [30]. Nos anos 90 assistiu-se a um aumento dos isolados resistentes à fluoroquinolona, inicialmente no Sudeste Asiático, seguido de uma rápida propagação a muitos países. O aumento global de isolados resistentes a cefixime está a progredir e é motivo de preocupação porque este antibiótico é actualmente recomendado como uma dose oral única para tratamento [30]. Outro problema é o aumento da resistência à ceftriaxona. Devido ao aumento da N. gonorreia multi-resistente, certas orientações já recomendam agora uma combinação de ceftriaxona intramuscular e azitromicina oral como primeira escolha de tratamento [30].
Para detalhes actuais sobre a terapia da gonorreia, consulte as actuais “Recomendações da Comissão Federal de Saúde Sexual e da Sociedade Suíça de Infecciologia” [13].
Diagnóstico de C. trachomatis – Colheita de espécimes
As clamídias são bactérias intracelulares obrigatórias, por isso é importante que a amostra contenha o maior número de células possível. Isto é conseguido esfregando a zaragatoa ao recolher a amostra [31].
Os locais habituais para recolha de espécimes em infecções genitais sintomáticas com C. trachomatis são o endocérvix nas mulheres e a uretra nos homens. Amostras menos invasivas, tais como uma zaragatoa vaginal nas mulheres e uma zaragatoa do meio do jacto de urina ou do meato uretral nos homens, são também possíveis hoje em dia, aumentando assim a aceitação dos testes pelas pacientes. A sensibilidade e especificidade da detecção de C. tracomatis por PCR em amostras recolhidas de forma não invasiva são comparáveis às amostras recolhidas directamente do colo do útero ou uretra [32]. As amostras de urina de mulheres são normalmente menos adequadas para a detecção de C. tracomatis por PCR, uma vez que mostram uma sensibilidade subóptima [29]. Os esfregaços vaginais autocolhidos são descritos nas recomendações laboratoriais do CDC como espécimes exactos e aceitáveis [33]. Para a detecção de clamídia com PCR, o material deve ser processado após 48 horas, o mais tardar [31]. A amostra pode ser transportada à temperatura ambiente. Para uma orientação detalhada sobre a melhor recolha de espécimes, consulte “Recommendations of the Federal Commission for Sexual Health and the Swiss Society for Infectiology” [28].
A infecção com os serótipos C. trachomatis L1, L2 e L3 está associada ao aumento da patogenicidade e leva ao quadro clínico conhecido como linfogranuloma venéreo (LGV). As infecções por LGV ocorrem principalmente em populações de risco, como os HSH. A detecção tem lugar em esfregaços rectais ou uretrais, pus ou material de punção dos gânglios linfáticos afectados.
Métodos biológicos moleculares
Como método de escolha, a clamídia é hoje em dia detectada com métodos de amplificação de ADN (PCR). A detecção pode ser efectuada simultaneamente para C. tracomatis e N. gonorreia com excelente sensibilidade e especificidade (ver acima). A importância de um diagnóstico fiável e de uma vigilância epidemiológica é ilustrada pelo seguinte exemplo: C. trachomatis tem 4-8 cópias de um plasmídeo longo de 7500 nucleótidos. Este plasmídeo é portanto um alvo muito atractivo para um método de detecção por PCR, uma vez que o aumento da sensibilidade de diagnóstico é conseguido através de múltiplas cópias. Entre Novembro de 2005 e Agosto de 2006, registou-se uma queda inesperada na incidência de C. trachomatis numa determinada região da Suécia [34]. A redução de 25% nos casos diagnosticados foi inicialmente interpretada como o sucesso das medidas de prevenção. No entanto, este foi na realidade o resultado de uma alteração genética com uma eliminação de 377 pares de bases no referido plasmídeo [34]. Como resultado, os testes PCR comerciais frequentemente utilizados já não detectam a clamídia no material da amostra. Esta variante chamada “sueca” ou “escandinava” de C. trachomatis é predominante na Suécia e agora também pode ser encontrada noutros países escandinavos [35]. Até agora, só foram comunicados casos individuais noutros países. Os fabricantes de diagnósticos de PCR reagiram rapidamente e adaptaram e melhoraram os métodos de detecção em conformidade. A clamídia associada ao LGV pode ser determinada por PCR para a detecção dos serótipos específicos de LGV [36,37]. Num curso mais grave da doença, por exemplo, com gânglios linfáticos aumentados, o LGV deve ser procurado – especialmente em HSH – e tratado em conformidade [38]. Tal como no caso do N. gonorhoeae, o ADN de bactérias não viáveis pode permanecer detectável durante muito tempo em caso de infecção com C. trachomatis – a PCR não deve, portanto, ser repetida no prazo de três semanas [39].
Outros métodos de detecção
A detecção serológica de anticorpos ou um ELISA de antigénio de Chlamydia com uma reacção de imunofluorescência quase nunca são usados em rotina.
Posição de resistência
Dado que a clamídia só pode ser cultivada em culturas celulares complexas e isto só é feito em laboratórios especializados, não é normalmente efectuado qualquer teste de resistência. O tratamento de escolha são antibióticos com actividade intracelular como a doxiciclina e a azitromicina. O desenvolvimento da resistência em C. trachomatis ainda não foi demonstrado [28]. Para as directrizes de tratamento da infecção por C. trachomatis, remetemos para as “Recommendations of the Federal Commission for Sexual Health and the Swiss Society for Infectiology” [28].
Resumo
Doenças sexualmente transmissíveis como a N. gonorreia e a C. tracomatis estão actualmente a viver um renascimento – em parte explicado pela disponibilidade e sensibilidade dos diagnósticos moleculares modernos – mas não exclusivamente. Especialmente em tempos de aumento da resistência aos antibióticos na N. gonorreia e particularmente na clamídia virulenta (linfogranuloma venéreo), deve ser feito um diagnóstico rápido e fiável. Para além da detecção de diagnóstico molecular, também é recomendado o teste de resistência a antibióticos baseado em cultura para a N. gonorreia.
Mensagens Take-Home
- Doenças sexualmente transmissíveis como a N. gonorreia e a C. tracomatis estão actualmente a experimentar um renascimento. Este aumento não pode ser explicado exclusivamente pela disponibilidade e sensibilidade dos diagnósticos moleculares modernos.
- A crescente resistência aos antibióticos em N. gonorreiae e a detecção de clamídias particularmente virulentas (linfogranuloma venéreo) requerem diagnósticos rápidos e fiáveis.
- Para além da detecção de diagnóstico molecular, é também recomendado o teste de resistência a antibióticos baseado em cultura para a N. gonorreia.
Literatura:
- Gabinete Federal de Saúde Pública DÖG. HIV, sífilis, gonorreia e clamidiose na Suíça em 2015: uma panorâmica epidemiológica. Boletim FOPH 2016; 46: 12-13.
- (ECDC) ECfDPaC. Infecções sexualmente transmissíveis na Europa 2013. Relatório de vigilância do ECDC 2015: 1-124.
- Dubourg G, Raoult D: Os desafios da profilaxia pré-exposição de infecções de transmissão sexual bacteriana. Microbiologia clínica e infecção: a publicação oficial da Sociedade Europeia de Microbiologia Clínica e Doenças Infecciosas 2016; 22 (9): 753-756.
- Unemo M, Bradshaw CS, et al: Infecções sexualmente transmissíveis: desafios à frente. Lancet Infect Dis 2017; 17 (8): e235-e279.
- Gabinete Federal de Saúde Pública DÖG: Gonorreia na Suíça em 2015. Boletim FOPH 2016; 46: 27-30.
- Gabinete Federal de Saúde Pública DÖG: Clamidiose na Suíça em 2015. Boletim FOPH 2016; 46: 32-33.
- Schmutz C, Burki D, et al.: Testing for Chlamydia trachomatis: time trends in positivity rates in the canton of Basel-Stadt, Switzerland. Epidemiol Infect 2013; 141 (9): 1953-1964.
- Vogel U, Forsch M: Cocos aeróbicos e anaeróbicos facultativos gran negativos. Em: Neumeister M, Geiss HK et al. (ed.) Diagnósticos microbiológicos. Stuttgart, Nova Iorque: Thieme; 2009.
- Coorevits L, Vanscheeuwijck C, et al: Evaluation of Copan FLOQSwab for the molecular detection of Chlamydia trachomatis by Abbott RealTime CT PCR. Acta clinica
- Belgica 2015; 70 (6): 398-402.
- Jun JK, Lim MC, et al. Comparação de esfregaços vaginais DRY e WET com espécimes cervicais em Roche Cobas 4800 HPV e Abbott RealTime testes HPV de alto risco. J Clin Virol 2016; 79: 80-84.
- Tan TY, Ng LS, et al.: Avaliação da recuperação bacteriana e viabilidade a partir de três sistemas diferentes de transporte de zaragatoa. Patologia 2014; 46 (3): 230-233.
- den Heijer CDJ, Hoebe C, et al: Uma visão abrangente dos testes e diagnósticos de gonorreias urogenitais, anorretais e orofaríngeas da Neisseria entre diferentes prestadores de cuidados de DST: um estudo transversal. BMC Infect Dis 2017; 17 (1): 290.
- Toutous Trellu L, Oertle D, et al: Gonorrhoea: novas recomendações sobre diagnóstico e tratamento. Fórum médico suíço 2014; 14 (20): 407-409.
- Ng LK, Martin IE: O diagnóstico laboratorial da Neisseria gonorrhoeae. The Canadian journal of infectious diseases & medical microbiology = Journal canadien des maladies infectieuses et de la microbiologie medicale / AMMI Canada 2005; 16 (1): 15-25.
- Mitchell M, Rane V, et al: A técnica de amostragem é importante para um isolamento óptimo da gonorreia faríngea. Sex Transmect Infect 2013; 89 (7): 557-560.
- Wind CM, de Vries HJ, et al.: Combinação bem sucedida de Diagnóstico de Teste de Amplificação de Ácido Nucleico e Cultura de Neisseria gonorrhoeae Diferida Alvo. Journal of clinical microbiology 2015; 53 (6): 1884-1890.
- Spence JM, Wright L, Clark VL: Manutenção laboratorial da Neisseria gonorrhoeae. Protocolos actuais em microbiologia 2008; Capítulo 4: Unidade 4A 1.
- Perry MD, Jones RN, Corden SA: É necessário um teste de confirmação do teste Roche cobas 4800 CT/NG Neisseria gonorrhoeae amostras positivas? Comparação do teste Roche cobas 4800 CT/NG com um ensaio opa/pap duplex para a detecção de N gonorreia. Infecto de transmissão sexual 2014; 90 (4): 303-308.
- Ursi D, Crucitti T, Smet H, Ieven M: Avaliação do ensaio Bio-Rad Dx CT/NG/MG(R) para a detecção simultânea de Chlamydia trachomatis, Neisseria gonorrhoeae e Mycoplasma genitalium na urina. Revista europeia de microbiologia clínica e doenças infecciosas: publicação oficial da Sociedade Europeia de Microbiologia Clínica 2016; 35 (7): 1159-1163.
- Wong KC, Ho BS, et al: Sistema Duplex PCR para detecção simultânea de Neisseria gonorrhoeae e Chlamydia trachomatis em espécimes clínicos. Journal of clinical patology 1995; 48 (2): 101-104.
- Meyer T, Klos C et al.: Avaliação do desempenho do
- Kit de teste PelvoCheck CT/NG para a detecção de Chlamydia trachomatis e Neisseria gonorrhoeae. BMJ aberto em 2016; 6 (1): e009894.
- Low N, Unemo M, et al.: Molecular diagnostics for gonorrhoea: implications for antimicrobial resistance and the threat of untreatable gonorrhoea. PLoS medicina 2014; 11 (2): e1001598.
- Del Prete R, Ronga L et al: Detecção e identificação simultânea de agentes patogénicos de DST por PCR multiplex em tempo real em amostras do tracto genital numa área seleccionada da Apúlia, uma região do sul de Itália. Infecção 2017; 45 (4): 469-477.
- Fernandez G, Martro E, et al.: Utilidade de um novo ensaio de PCR multiplex em tempo real para o diagnóstico de infecções sexualmente transmissíveis. Enferm Infecc Microbiol Clin 2016; 34(8): 471-476.
- Bissessor M, Whiley DM et al: Persistência do ADN da Neisseria gonorreia após tratamento da gonorreia faríngea e rectal é influenciada pela susceptibilidade aos antibióticos e reinfecção. Clin Infect Dis 2015; 60 (4): 557-563.
- Watchirs Smith LA, Hillman R et al: Testes no local de tratamento para o diagnóstico da infecção por gonorreia de Neisseria: uma revisão sistemática das características operacionais e de desempenho. Sex Transmect Infect 2013; 89 (4): 320-326.
- Dierig A, Frei R, Egli A: A via rápida para a identificação microbiana: dessorção laser assistida por matriz/tempo de ionização da espectrometria de massa de voo (MALDI-TOF MS). Pediatr Infect Dis J 2015; 34 (1): 97-99.
- Tarr P: Infecções sexualmente transmissíveis com Chlamydia trachomatis: Recomendações da Comissão Federal para a Saúde Sexual (FCSH) e da Sociedade Suíça de Infecciologia (SSI). Boletim FOPH 2017; 35: 8-14.
- Unemo M, Shipitsyna E, Domeika M: S da Europa de Leste, Reproductive Health Network Antimicrobial Resistance G. Vigilância da gonorreia, diagnóstico laboratorial e testes de susceptibilidade antimicrobiana da Neisseria gonorrhoeae em 11 países da parte oriental da região europeia da OMS. APMIS: acta pathologica, microbiologica, et immunologica Scandinavica 2011; 119 (9): 643-649.
- Elias J, Frosch M, Vogel U: Neisseria. In: Jorgensen JH, ed. Manual de microbiologia clínica. 11ª ed. Washington, DC: ASM Press; 2015: 635-651.
- Jacobs E: Mycoplasma e bactérias intracelulares obrigatórias. In: Neumeister B, Geiss HK, BRaun RW, Kimmig P, eds. Diagnósticos microbiológicos. Stuttgart, Nova Iorque: Thieme; 2009.
- Gaydos CA, Essig A, Vogel U: Chlamydaceae. In: Jorgensen JH, ed. Manual de Mircobiologia Clínica. 11ª ed. Washington: ASM Press; 2015: 1106-1121.
- Hobbs MM, van der Pol B et al. Do NIH: procedimentos de um workshop sobre a importância dos espécimes vaginais autoobtidos para a detecção de infecções sexualmente transmissíveis. Doenças sexualmente transmissíveis 2008; 35 (1): 8-13.
- Ripa T, Nilsson P: Uma variante de Chlamydia trachomatis com eliminação em plasmídeo críptico: implicações para a utilização de testes de diagnóstico por PCR. Euro vigilância: boletim Europeen sur les maladies transmissibles = European communicable disease bulletin 2006; 11 (11): E061109 2.
- Unemo M, Clarke IN: A nova variante sueca de Chlamydia trachomatis. Curr Opinion Infect Dis 2011; 24(1): 62-9.
- de Roche M, Sawatzki M et al: Lymphogranuloma venereum. Uma doença antiga com um vestido novo. Der Internist 2011; 52 (5): 584-589.
- Goldenberger D, Dutly F, Gebhardt M: Análise de 721 espécimes de Chlamydia trachomatis-positivos urogenitais de homens e mulheres usando o ensaio de PCR em tempo real específico para linfogranuloma venéreo L2. Euro vigilância: boletim Europeen sur les maladies transmissibles = European communicable disease bulletin 2006; 11 (10): E061018 4.
- Stoner BP, Cohen SE: Lymphogranuloma venereum 2015: Apresentação clínica, diagnóstico, e tratamento. Clin Infect Dis 2015; 61 (8): S865-873.
- Gaydos CA, Crotchfelt KA, et al: Ensaios de amplificação molecular para detectar infecções por clamídia em amostras de urina de estudantes do ensino secundário e para monitorizar a persistência do ADN clamidial após a terapia. J Infect Dis 1998; 177 (2): 417-424.
PRÁTICA DE DERMATOLOGIA 2017; 27(6): 22-28