Terapias imunomoduladoras e imunossupressoras em doentes com cancro podem promover a progressão ou recaída da doença maligna. Contudo, as várias substâncias diferem no que diz respeito a este risco. Para além da selecção cuidadosa da substância activa, o rastreio tumoral consistente é também de grande importância na prevenção de recaídas e de novas doenças malignas.
A idade crescente da população e o progresso gratificante na terapia oncológica significam que os reumatologistas são cada vez mais confrontados com pacientes que têm uma doença maligna anterior mas ainda precisam de uma terapia básica baseada em orientações. A terapêutica básica é frequentemente imunossupressora e uma das principais tarefas do sistema imunitário é reconhecer e eliminar as células malignas. Consequentemente, os médicos e os pacientes estão preocupados com o facto de a terapia básica aumentar o risco de recidiva de tumores. Especialmente no caso dos inibidores do factor de necrose tumoral, esta preocupação é alimentada por infelizes nomes.
Abundância crescente de dados, interpretação difícil
Para poder tomar tais decisões terapêuticas, é geralmente de pouca ajuda lidar com a impressionante e excitante riqueza de dados sobre experiências in vitro ou modelos animais sobre a interacção entre as células tumorais e o sistema imunitário. Como mencionado acima, a vigilância de tumores é uma função importante do sistema imunitário; processos inflamatórios levam à destruição de células degeneradas. Por outro lado, a inflamação também pode contribuir para a proliferação de tumores e inibir a vigilância dos tumores. A inflamação crónica é conhecida por aumentar o risco de linfoma [1]. Observações semelhantes existem para certos tumores sólidos, dependendo da fase do tumor [2–4]. Dependendo do microambiente, os mesmos grupos celulares ou citocinas podem ter efeitos muito diferentes, isto é, tanto inibidores de tumores como promotores de tumores. Por exemplo, o TNF-alfa, também conhecido principalmente como uma citocina inibidora de tumores, pode estimular células T reguladoras no cancro dos ovários, que estão associadas a um maior risco de progressão porque provavelmente suprimem a vigilância tumoral [5].
Os estudos que de outra forma fornecem as melhores provas em medicina, nomeadamente ensaios controlados aleatórios, só são adequados numa medida muito limitada, mesmo após meta-análise, para esclarecer a questão de saber se a respectiva preparação aumenta o risco de recorrência de tumores. Há várias razões para isto:
- O cálculo do número do caso e a concepção dos estudos de registo são principalmente orientados para a prova da eficácia. Como resultado, os números dos casos são demasiado pequenos e o seguimento demasiado curto para captar certos aspectos de segurança.
- As doenças malignas são eventos raros que normalmente só ocorrem após um longo período de latência. Sob ciclofosfamida, estas latências têm entre 10 e 15 anos.
- As doenças malignas anteriores (com excepção dos cancros cutâneos não melanocíticos) e frequentemente a velhice são critérios de exclusão. Também não é raro que pacientes mais velhos tenham comorbilidades ou limitações logísticas, de modo que os pacientes com elevado risco de cancro estão geralmente sub-representados nos estudos.
Há relativamente poucos estudos que se concentram principalmente no risco de recorrência de tumores durante a terapia imunossupressora. Estas são avaliações de registos nacionais ou bases de dados de seguros. Contudo, uma vez que os próprios médicos participantes determinam nestes estudos qual a terapia que um paciente com uma doença maligna anterior recebe, podem ocorrer falsificações na medida em que as preparações que o médico considera terem um elevado potencial de promoção de tumores são utilizadas com mais cautela em pacientes com um elevado risco de recorrência de tumores. Na análise estatística destes estudos, tenta-se contrariar este preconceito, ajustando os factores de risco habituais para a recorrência de tumores (por exemplo, a fase inicial do tumor). A vantagem das bases de dados de seguros é o elevado número de casos, a desvantagem é a falta de informação detalhada sobre o paciente individual, o que torna o ajustamento consideravelmente mais difícil.
Na ausência de provas directas sobre o risco de recorrência de tumores, para a maioria das preparações tenta-se orientar sobre o risco de ocorrência de novos incidentes malignos em ensaios aleatórios, registos e bases de dados de seguros e extrapola-se este risco para o risco de recorrência.
Face a estas limitações na situação dos dados, outras possibilidades de aquisição de conhecimentos também se apresentam:
- Analisam-se estudos de terapia imunossupressora em populações de risco que têm uma maior probabilidade de malignidade: por exemplo, pacientes com condições pré-cancerosas como a neoplasia intra-epitelial cervical ou gamopatias monoclonais.
- Para estudos em que são utilizadas doses diferentes, pode ser investigado um efeito de dose.
- Os cancros cutâneos não melanocíticos (NMSCs) são doenças malignas que ocorrem com maior frequência e para as quais foram observadas diferenças mesmo em estudos com seguimento mais curto [6]. Estas entidades poderiam servir como substituto limitado para o risco global de cancro, especialmente porque normalmente não são critérios de exclusão para ensaios controlados aleatorizados. No entanto, os NMSC muitas vezes não são totalmente capturados mesmo em estudos, razão pela qual são frequentemente excluídos das considerações de risco de malignidade.
Ao analisar os estudos sobre a incidência de doenças malignas, é dada especial atenção ao respectivo grupo de controlo. As comparações com a população normal são menos úteis, uma vez que as doenças inflamatórias reumatóides têm frequentemente incidências acrescidas de certas neoplasias malignas independentes das influências da terapia, tais como o carcinoma brônquico na artrite reumatóide [7], linfomas na síndrome de Sjögren [8] e carcinoma cervical no lúpus eritematoso sistémico [9].
Declarações em orientações e recomendações
Existem muitas directrizes nacionais e internacionais para a terapia da artrite reumatóide, que tratam do tema da anamnese maligna com vários pormenores [10]. As recomendações mais claras a este respeito foram formuladas pelo American College of Rheumatology em 2012 e 2015 [11,12]. Nas recomendações mais antigas de 2012, foi ainda feita uma distinção – como na maioria das outras directrizes – sobre se o intervalo entre o fim da terapia tumoral curativa e o início da terapia básica era mais ou no máximo de 5 anos. Nessa altura, só se podia referir ao tempo habitual de maior probabilidade de recorrência de tumores e aos dados do campo de transplante de órgãos [13]. Após 5 anos, qualquer terapia biológica (principalmente inibidores de TNF nessa altura) foi considerada segura. Dentro dos 5 anos, foi dada preferência ao rituximab sem que os estudos o pudessem justificar na altura – com excepção das neoplasias de células B CD20+. O único estudo publicado até à data no campo da hematologia, mesmo com todos os problemas metodológicos, tendeu a indicar que os pacientes que receberam rituximab para além do transplante de células estaminais autólogas tinham um risco mais elevado de malignidades secundárias do que os pacientes sem rituximab [14]. Só posteriormente foram publicadas análises de registo que mostram que o rituximab é relativamente não problemático, como explicado abaixo.
Na versão mais recente das recomendações do ACR de 2015, no entanto, a distinção entre terapia tumoral e reumatóide, dependendo do intervalo, foi abandonada. Em pacientes com uma malignidade sólida, a terapia básica pode, portanto, ser tratada sem restrições, como em pacientes de AR sem um historial de malignidade. Caso contrário, foram feitas prioridades para DMARD para o cancro da pele e doenças linfoproliferativas que tão carentes de provas ou tão contrárias às provas não citadas já disponíveis na altura, que não serão reproduzidas aqui. No entanto, o facto de estes dois grupos de doenças malignas exigirem uma atenção especial será apresentado a seguir.
Provas directas sobre o risco de recorrência de tumores sob terapia reumatológica
Nos registos nacionais de pacientes de AR, os pacientes com antecedentes de malignidade foram comparados, em termos de estudos de caso-controlo, com pacientes que tinham terapias de base semelhantes e sem antecedentes de malignidade. Na maioria dos casos, foi feita uma tentativa de ajustamento para factores de risco de recorrência de tumores, tais como actividade da doença ou obesidade. Os primeiros dados significativos vieram do registo alemão RABBIT [15] e do Registo de Biologia do Reino Unido [16]. Além disso, devem ser mencionadas as análises do registo CORRONA dos EUA [17], o registo DANBIO dinamarquês [18] e – só recentemente publicado – o registo ARTIS sueco [19]. Recentemente, foi publicada uma meta-análise de 11 estudos por Xie e colegas, que inclui os registos acima mencionados [20]. Os dados só podem ser utilizados para inibidores de TNF e rituximab. Felizmente, não houve aumento do risco de recaída de inibidores de TNF ou rituximab em comparação com os pacientes que receberam terapêutica de base sintética convencional (csDMARD). Deve notar-se que na maioria dos estudos o intervalo entre a terapia oncológica e reumatológica foi em média significativamente superior a 5 anos – com duas excepções: O Rituximab foi utilizado anteriormente no registo alemão, seguindo a recomendação mais antiga do ACR, e o registo dinamarquês permitiu uma comparação de pacientes com um intervalo de mais ou menos de 5 anos para a terapia com inibidores de TNF. Aqui, numericamente, o risco de recorrência de tumores era ainda ligeiramente menor, com um intervalo mais curto, mesmo após o ajuste para as fases iniciais do tumor. No entanto, foi aqui demonstrado que os médicos participantes no registo utilizaram mais biólogos para fases iniciais do tumor mais baixas. Uma meta-análise de 16 estudos em diferentes doenças auto-imunes (AR, doença inflamatória intestinal e psoríase) também não conseguiu demonstrar uma diferença estatisticamente significativa na recorrência de tumores em intervalos de mais ou menos de 6 anos. A análise estava principalmente relacionada com inibidores de TNF, tiopurinas e metotrexato [21]. No entanto, uma vez que a maioria dos dados de registo mostram longos intervalos entre a terapia oncológica e reumatológica em média e os estudos de registo podem estar sujeitos a um considerável enviesamento, a duração do intervalo deve ainda ser incluída na decisão da terapia reumatológica.
Provavelmente o estudo mais informativo sobre o risco de recorrência de tumores com um curto intervalo é a análise de dados de seguros dos EUA com um número muito grande de casos por Mamtani e colegas [22]. Estes eram pacientes com artrite reumatóide (>90%) ou doença inflamatória intestinal que receberam metotrexato, tiopurinas, inibidores de TNF, combinações das mesmas ou nenhuma terapia de base após cirurgia curativa para o carcinoma da mama. Em mais de 90% dos pacientes, os inibidores de TNF foram reiniciados dentro de um ano após a cirurgia e mesmo com a administração contínua de inibidores de TNF, não foi observado qualquer risco acrescido de recidiva do cancro da mama. No entanto, o seguimento foi de apenas 3,4 anos. Como as recidivas do carcinoma da mama podem ocorrer muito mais tarde do que 5 anos após a cirurgia, aconselha-se, até agora, uma precaução especial e um comportamento de espera e observação ao iniciar a terapia básica. Este estudo pode ser utilizado em certa medida como contra-argumento contra esta avaliação. O registo do Reino Unido também não mostrou aumento da incidência de novos carcinomas da mama com TNFI em comparação com os csDMARD em relativamente grande número de casos [23].
Dados sobre substâncias individuais
Uma descrição detalhada dos dados sobre todas as substâncias habitualmente utilizadas em reumatologia iria demasiado longe no âmbito deste artigo de revisão. Por conseguinte, no que se segue, a situação dos dados será avaliada de forma resumida de acordo com o Quadro 1 e o risco de tumor das substâncias ou grupos de substâncias individuais. Apenas a literatura actual é citada. Para uma leitura mais aprofundada, remetemos aqui para revisões significativas [24–27].

Deve ser mencionado no início que apenas para a ciclofosfamida existe um sinal claro de um risco aumentado de tumor ou de recorrência de tumor – e que apenas em doses cumulativas mais elevadas. As terapias imunomoduladoras ou imunossupressoras que de outra forma são comuns na reumatologia têm, no máximo, uma influência menor – e em algumas situações mesmo favorável – sobre estes riscos. Com o aumento das provas, o quadro positivo tende a ser confirmado.
No quadro 2, no contexto da literatura relevante, foi feita uma tentativa de avaliar até que ponto as substâncias individuais da terapia reumatológica poderiam ter um efeito sobre o risco de ocorrência de novas malignidades ou recidivas de malignidade. Embora se trate de uma simplificação considerável do assunto complexo, deve servir como uma orientação rápida e um ponto de partida para uma maior discussão e investigação. O julgamento global sobre uma substância deve sempre referir-se tanto à qualidade dos dados como às indicações de risco maligno que deles emergem. Assim, em caso de dúvida, prefere-se escolher aquele que tem os melhores dados para substâncias alternativas com risco provavelmente baixo.
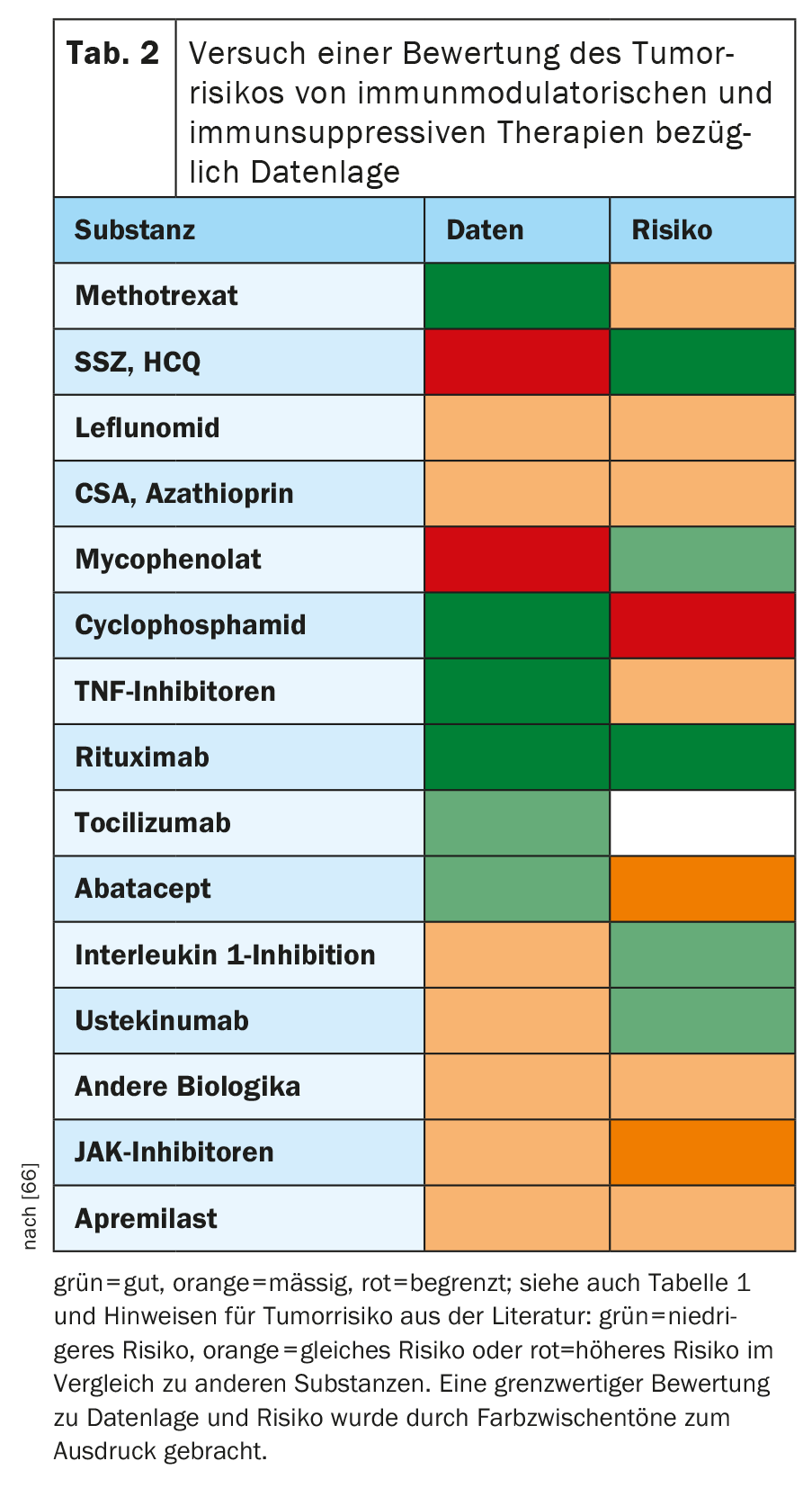
Metotrexato: Situação dos dados: boa.
O metotrexato é utilizado como terapia de manutenção para a leucemia linfática aguda. Deve assumir-se um risco ligeiramente maior de cancro da pele não melanocítico, que também foi novamente demonstrado no grande estudo randomizado sobre a utilização de metotrexato em doentes de risco cardiovascular [28,29]. A acumulação de doenças linfoproliferativas descritas principalmente por autores japoneses, que por vezes remetem espontaneamente após a descontinuação do metotrexato [30], não é confirmada na sinopse de outros dados de registo pormenorizados [31].
Leflunomida, hidroxicloroquina, sulfasalazina: Situação dos dados: moderada para leflunomida, pobre para hidroxicloroquina e sulfasalazina.
A leflunomida tem efeitos inibidores de tumores, pelo menos in vitro. O agrupamento numérico do cancro pancreático no registo RABBIT sob leflunomida não foi encontrado em outros registos [32].
Para a hidroxicloroquina, um estudo em LES e com baixo número de eventos malignos sugere um efeito protector contra as malignidades [33]. Um estudo recente sobre colagenoses sugere apenas um efeito benéfico na incidência de doenças tumorais metastáticas [34]. As terapias oncológicas em combinação com a hidroxicloroquina são discutidas devido ao efeito sobre a autofagocitose.
A sulfassalazina, tal como a mesalazina, pode reduzir o risco de cancro do cólon na colite ulcerosa [35].
Apremilast: Situação dos dados: moderada.
Os relatórios de eventos adversos da FDA sugerem que o apremilast tem um risco de tumor ainda menor do que o ustekinumab [36]. Semelhante à hidroxicloroquina e à sulfassalazina, um efeito desfavorável no desenvolvimento de tumores parece improvável, quanto mais não seja por causa do mecanismo de acção.
Azatioprina, ciclosporina A, micofenolato: Situação dos dados: moderada.
Há indicações de que a terapia combinada da azatioprina com o infliximabe poderia levar a um aumento da incidência dos muito raros linfomas hepatoesplénicos das células T nos homens com doença inflamatória intestinal [37]. O agrupamento das neoplasias mielóides por azatioprina em diferentes doenças auto-imunes postuladas num estudo recentemente publicado não foi encontrado noutros estudos e deve-se provavelmente ao facto de terem sido comparadas populações muito heterogéneas [38]. Tanto para a azatioprina como para a ciclosporina A, o risco de CEMN parece ser aumentado [39], para CSA especialmente em associação com a terapia da luz para a psoríase [40]. Os dados sobre a azatioprina de diferentes registos sobre a incidência de cancro global, carcinoma urotelial e linfoma são contraditórios, embora não surja nenhum sinal forte. Para os MMF, existem principalmente estudos do campo de transplante de órgãos. Neste caso, o risco de cancro parece ser globalmente um pouco menor para tumores de pele e para doenças linfoproliferativas pós-transplante em comparação com outros regimes imunossupressores pós-transplante [41].
Ciclofosfamida: Situação dos dados: boa.
Dependendo da dose cumulativa de ciclofosfamida, o risco de novas malignidades ou recidivas tumorais é aumentado. A maioria dos estudos indica valores entre 20 e 30 g como o limite acima do qual este risco é calculado como significativamente aumentado [42]. Um estudo de doentes com LES na Coreia do Sul encontrou mesmo um risco acrescido de incidência de malignidade numa dose cumulativa de >6 g [43]. Mesmo este valor, contudo, não é alcançado pelos protocolos modernos da ciclofosfamida, tais como o protocolo Euro-Lupus.
Biológicos
Inibidores de TNF: Situação dos dados: muito boa.
Suspeita-se de um ligeiro aumento do risco para a CNSN [44]. Se existe um risco acrescido de melanoma maligno sob TNFI foi discutido de forma controversa durante muito tempo sem que surgissem sinais claros. Uma análise de 11 registos europeus de AR [45] e a mais recente análise do registo australiano ARAD [46] para doentes de AR não encontrou provas de um aumento do risco. Vários estudos não encontraram um aumento significativo do risco de progressão da dispalsia intra-epitelial cervical conhecida para o carcinoma cervical com TNFI [47]. Uma análise recente dos dados dos seguros dos EUA sugere um risco acrescido de linfoma [48], que não foi encontrado em estudos de vários registos nacionais [49]. Os dados importantes e tranquilizadores sobre os estudos do risco de recorrência de tumores sob TNFI foram apresentados acima. Neste contexto, os dados do campo das terapias imuno-oncológicas com os chamados inibidores de pontos de controlo (ICPI) são interessantes: Os modelos de rato [50,51] e uma primeira série de casos [52] sugerem que a combinação de ICPI com TNFI poderia não só levar a uma taxa mais baixa de efeitos secundários imuno-mediados, mas também a um melhor controlo de tumores.
Rituximab: Situação dos dados: muito boa.
Embora o rituximab tenha sido utilizado há muito tempo na Alemanha de acordo com as antigas recomendações do ACR relativamente pouco tempo após a terapia curativa de tumores, não há provas na literatura sobre doenças reumatológicas (especialmente a AR) de um risco aumentado de recorrência de tumores ou de novas neoplasias malignas. Os dados de registo favoráveis sobre o risco de recorrência de tumores foram apresentados acima.
Tocilizumab, Sarilumab: Situação dos dados: bom para tocilizumab, limitado para sarilumab.
O Tocilizumab é utilizado terapeuticamente em diferentes situações terapêuticas em oncologia: Tratamento da doença de Castleman (aprovação no Japão), tratamento da tempestade de citocinas após terapia com células T de CAR (aprovação), tratamento dos efeitos secundários imuno-mediados dos inibidores de pontos de controlo (série de casos, opinião de peritos) [53]. As considerações sobre o mecanismo de acção que lança o tocilizumabe a uma luz favorável no contexto de doenças malignas não devem ser sobre-interpretadas. Uma grande análise das bases de dados de seguros dos EUA não encontrou pelo menos um risco mais elevado de eventos malignos na AR com tocilizumab em comparação com a TNFI ou abatacept, com a NMSC excluída da análise [54].
Abatacept: Situação dos dados: boa.
Mais uma vez, considerações sobre o mecanismo de acção, que é exactamente o oposto ao do inibidor do ponto de controlo ipilimumab, não devem ser sobre-interpretadas. No entanto, um grande estudo de registo [55] e uma análise dos dados de seguros dos EUA [56] sugerem um risco acrescido para o NMSC mesmo em comparação com outros biólogos. Para a incidência global de cancro e incidência de melanoma, os dados são contraditórios [57].
Secukinumab, ixekizumab: Situação dos dados: moderado para secukinumab, limitado para ixekizumab.
Os percursos de sinalização IL17 podem teoricamente ser tanto promotores de tumores como inibidores de tumores. A argumentação da directriz S3 alemã para o tratamento da psoríase, que dá preferência ao secukinumabe e ao ustekinumabe em relação ao TNFI no caso de doença maligna anterior, não parece conclusiva no que diz respeito ao secukinumabe [58]. Os dados sobre o alegado aumento do risco de tumores sob TNFI são aqui sobre-interpretados e contrastam com os dados sobre secukinumab, que não mostram qualquer evidência de aumento da incidência de cancro, mas também não são adequados para investigar esta questão devido ao baixo número de casos e ao curto seguimento.
Ustekinumab: Situação dos dados: boa.
Numa avaliação do registo PSOLAR sobre a terapia da psoríase, ustekinumabe e metotrexato mostraram um risco global de cancro inferior ao do TNFi [59]. Isto apoiaria a recomendação acima mencionada na directriz da psoríase alemã, mas deveria idealmente ser confirmada noutros estudos e situações terapêuticas, especialmente porque os dados já mencionados, de difícil interpretação dos relatórios de efeitos secundários da FDA falam de um risco mais elevado em comparação com o apremilast.
Anakinra, canakinumab: Situação dos dados: moderada a boa.
Anakinra é utilizado para o tratamento da síndrome de Schnitzler. Nesta doença, existe uma associação de vasculite urticaria com gamopatia monoclonal de significado pouco claro, que é uma condição pré-cancerígena. No ensaio CANTOS, os doentes com RPC elevado após enfarte do miocárdio receberam canakinumab ou placebo [60]. Embora o parâmetro primário tenha sido atingido, este estudo não levou à aprovação desta indicação, mas foi observada uma menor incidência de carcinoma brônquico no braço do estudo. De facto, a interleucina-1 pode ter efeitos promotores de tumores. Esta observação será seguida num programa de estudo oncológico.
Belimumab: Situação dos dados: moderada.
Não estão disponíveis resultados separados sobre o risco de doenças malignas.
Inibidores JAK: Situação dos dados: bom para o tofacitinibe, moderado para o baricitinibe, limitado para o upadacitinib.
A consideração do risco tumoral dos inibidores JAK deve ser particularmente bem fundamentada agora e no futuro, uma vez que se trata de medicamentos imunossupressores altamente potentes e certos sinais já podem ser notados, mas estes ainda não fornecem uma imagem clara. Os pacientes com neoplasias mieloproliferativas (NMP) têm populações de células B monoclonais agrupadas na medula óssea e, portanto, um risco mais elevado de neoplasias de células B. Um grupo de investigação em hematologia de Viena avaliou uma coorte de doentes com NMP, alguns dos quais foram tratados com diferentes inibidores JAK aprovados e experimentais [61]. Esta coorte mostrou um risco significativamente aumentado de neoplasia agressiva das células B sob inibidores JAK. Esta observação foi apoiada por um modelo de rato do grupo de investigação, mas não confirmada por um estudo análogo de uma coorte MPN maior do MD Anderson [62]. No programa de ensaio RA aleatório do upadacitinib, foi encontrado um risco significativamente mais elevado de CEMN na dose não aprovada de 30 mg do que na dose de 15 mg [63]. Também com baricitinibe, ocorreram relativamente mais NMSCs numericamente com a dose mais elevada de 4 mg na AR do que com 2 mg [64]. Já existem dados de registo significativos apenas para o tofacitinib. No registo CORRONA dos EUA, as taxas para NMSC e para o cancro sem NMSC sob tofacitinib foram comparáveis com as taxas biológicas e não diferiram significativamente [65]. No entanto, a possibilidade de enviesamento nos registos deve ser novamente assinalada. Além disso, este estudo ainda não está totalmente publicado.
Estratégias terapêuticas em função da situação
Com base nestas considerações, tentar-se-á formular propostas para a terapia reumatológica de pacientes com antecedentes de malignidade. Estas sugestões são uma síntese das recomendações existentes nas directrizes e das provas descritas e revistas. Não foram sujeitos a um processo de consenso e apenas reflectem a opinião individual do autor:
- As decisões terapêuticas neste contexto são muito carregadas emocionalmente e devem ser discutidas em pormenor com o paciente e o colega oncologicamente responsável.
- Numa situação de terapia paliativa, deve ser feita uma distinção entre se as opções de prognóstico e terapia oncológica são muito limitadas ou se existe a possibilidade de controlo da doença a longo prazo através de conceitos (modernos) de terapia oncológica. Em particular, a avaliação das terapias DMARD após terapias imuno-oncológicas é difícil, mas pode ser apoiada pela experiência oncológica em terapia imunossupressora dos efeitos secundários imuno-mediados destes tratamentos. Se o objectivo terapêutico principal for o alívio dos sintomas, a terapia reumatológica pode normalmente ser prosseguida sem restrições. O objectivo do controlo de tumores a longo prazo deve ser semelhante aos conceitos de terapia curativa.
- Se o objectivo da terapia for curativo, a terapia reumatológica pode provavelmente ser realizada sem restrições 5 anos após a conclusão da terapia oncológica. Vários anos de terapias de manutenção oncológica não devem atrasar ainda mais este intervalo. Mesmo para além de um intervalo de 5 anos, dever-se-ia antes evitar abatacept, inibidores de JAK e talvez também inibidores de TNF em melanoma maligno devido à situação de dados pouco claros, especialmente se existirem opções terapêuticas alternativas.
- Nos linfomas tratados curativamente, deve-se ser bastante cauteloso com os inibidores JAK e talvez também com os inibidores TNF. Em contraste, rituximab e talvez também tocilizumab têm um efeito favorável em casos de neoplasia anterior de células B ou discrasias de plasmócitos.
- Em caso de objectivo terapêutico curativo, recomenda-se um intervalo de 5 anos:
- Pausar a terapia básica e fazer a ponte com glucocorticosteróides (ou anti-inflamatórios não esteróides) durante a quimioterapia
- Consideração das interacções nas terapias de manutenção oncológica a longo prazo
- Caso contrário, uma terapia básica consistente no sentido de um conceito graduado orientado para o risco individual de recorrência de tumores e para os dados disponíveis sobre os DMARD em questão. A situação dos dados deve ser avaliada tanto de acordo com quantos estudos estão disponíveis e de que qualidade, como de acordo com as indicações de menor ou maior risco de tumores em comparação com outras substâncias.
- No entanto, a inflamação descontrolada a longo prazo ou a terapia com doses elevadas de glucocorticóides a longo prazo devido a uma contenção excessiva antes da terapia básica deve ser evitada a todo o custo.
- Devido à alta complexidade das interacções do sistema imunitário e do tumor em ligação com as terapias imuno-oncológicas (inibidores de pontos de controlo), recomenda-se que as decisões terapêuticas reumatológicas sejam tomadas por um centro especializado.
Mensagens Take-Home
- A decisão sobre terapias imunomoduladoras ou imunossupressoras em doentes com antecedentes de malignidade deve normalmente ser tomada numa base interdisciplinar e sempre em estreita consulta com o doente.
- Uma crescente riqueza de dados ajuda na avaliação de substâncias individuais DMARD. A situação dos dados é complexa de avaliar devido a diferentes limitações dos formatos de estudo, mas com muito poucas excepções, o quadro é bastante positivo.
- Existem estudos sobre algumas substâncias (inibidores de TNF, rituximab) que investigaram principalmente o risco de recidiva de tumores após a ocorrência de doenças malignas. Para outras substâncias, podem ser obtidas informações a partir de dados sobre o risco de tumores incidentes e, em certa medida, através da análise de modelos pré-clínicos.
- Apenas a ciclofosfamida em doses cumulativas elevadas tem um forte sinal para um aumento do risco de tumores. Com as alternativas disponíveis, dever-se-ia provavelmente evitar o abatacept, os inibidores JAK e talvez os inibidores TNF em algumas situações. Para os inibidores de TNF, a situação dos dados é particularmente conclusiva em certas situações (por exemplo, condição após carcinoma mamário) e parece bastante favorável.
- Várias substâncias aumentam o risco de cancros cutâneos não melanocíticos. Este risco pode ser bem combatido iniciando um rastreio consistente do tumor de pele.
Literatura:
- Baecklund E, Iliadou A, Askling J, et al: Associação de inflamação crónica, não o seu tratamento, com aumento do risco de linfoma na artrite reumatóide. Arthritis Rheum 2006; 54(3): 692-701.
- Zhang Y, Sun Y, Zhang Q: Valor prognóstico do índice de inflamação imunitária sistémica em doentes com cancro da mama: uma meta-análise. Célula cancerígena Int 2020; 20: 224.
- Hirano T, Hirayama D, Wagatsuma K, et al: Immunological Mechanisms in Inflammation-Associated Colon Carcinogenesis. Int J Mol Sci 2020; 21(9): 3062.
- Moik F, Zöchbauer-Müller S, Posch F, et al.: Systemic Inflammation and Activation of Haemostasis Predict Poor Prognosis and Response to Chemotherapy in Patients with Advanced Lung Cancer. Cancers (Basileia) 2020; 12(6): E1619.
- Kampan NC, Madondo MT, McNally OM, et al: Interleukin 6 Presente nas Ascite Inflamatórias de Pacientes com Cancro Epitelial Avançado do Ovário Promove Receptor do Factor de Necrose Tumoral 2 – Células T Reguladoras Expressoras. Immunol frontal 2017; 8: 1482.
- Krathen MS, Gottlieb AB, Mease PJ: imunomodulação farmacológica e malignidade cutânea na artrite reumatóide, psoríase, e artrite psoriásica. J Rheumatol 2010; 37(11): 2205-2215.
- Mercer LK, Davies R, Galloway JB, et al: Risco de cancro em pacientes que recebem terapia não biológica modificadora de doenças para a artrite reumatóide, em comparação com a população geral do Reino Unido. Reumatologia 2013; 52: 9198.
- Nocturne G, Mariette X: linfomas associados à síndrome de Sjögren: uma actualização sobre patogénese e gestão. Br J Haematol 2015; 168(3): 317-327.
- Feldman CH, Liu J, Feldman S, et al: Risco de displasia cervical de alto grau e cancro cervical em mulheres com lúpus eritematoso sistémico que recebem medicamentos imunossupressores. Lupus 2017 Jun; 26(7): 682-689.
- Lopez-Olivo MA, Colmegna I, Karpes Matusevich AR, et al: Systematic Review of Recommendations on the Use of Disease-Modifying Antirheumatic Drugs in Patients With Rheumatoid Arthritis and Cancer. Arthritis Care Res (Hoboken) 2020; 72(3): 309-318.
- Singh JA, Furst DE, Bharat A, et al: 2012 update of the 2008 American College of Rheumatology recommendations for the use of disease-modifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2012; 64(5): 625-639.
- Singh JA, Saag KG, Bridges SL Jr, et al: 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2016 Jan; 68(1): 1-25.
- Penn I: Avaliação de candidatos a transplante com malignidades pré-existentes. Ann Transplant 1997; 2(4): 14-17.
- Tarella C, Passera R, Magni M, et al: Factores de risco para o desenvolvimento de malignidade secundária após quimioterapia de alta dose e auto-enxerto, com ou sem rituximab: um estudo retrospectivo de acompanhamento de 20 anos em doentes com linfoma. J Clin Oncol 2011 Mar 1; 29(7): 814-824.
- Strangfeld A, Hierse F, Rau R, et al: Risco de incidentes ou malignidades recorrentes entre pacientes com artrite reumatóide expostos à terapia biológica no registo biológico alemão RABBIT. Arthritis Res Ther 2010; 12: R5.
- Dixon WG, Watson KD, Lunt M, et al: Influence of antitumour necrosis factor therapy on cancer incidence in patients with rheumatoid arthritis who have had a prior malignancy: results from the British Society for Rheumatology Biologics Register. Arthritis Care Res 2010; 62: 755-763.
- Pappas DA, Rebello S, Liu M, et al: Therapy with Biologic Agents After Diagnosis of Solid Malignancies: Results from the Corrona Registry. J Rheumatol 2019; 46(11): 1438-1444.
- Dreyer L, Cordtz RL, Hansen IMJ, et al: Risco de segunda neoplasia maligna e mortalidade em doentes com artrite reumatóide tratados com DMARD biológicos: um estudo de coorte baseado na população dinamarquesa. Ann Rheum Dis 2018; 77(4): 510-514.
- Raaschou P, Söderling J, Turesson C, et al: Tumour necrosis factor inhibitors and cancer recurrence in Swedish patients with rheumatoid arthritis: a nationalwide population-based cohort study. Ann Intern Med 2018; 169: 291-299.
- Xie W, Xiao S, Huang Y, et al: Uma meta-análise de terapias biológicas sobre o risco de cancro novo ou recorrente em pacientes com artrite reumatóide e uma malignidade anterior. Reumatologia (Oxford) 2019 Oct 17; [Epub ahead of print].
- Shelton E, Laharie D, Scott FI, et al: Recurrence Cancer Recurrence Following Immune-Suppressive Therapies in Patients With Immune-Mediated Diseases: A Systematic Review and Meta-analysis. Gastroenterologia 2016; 151(1): 97-109.e4.
- Mamtani R, Clark AS, Scott FI, et al: Associação entre recorrência do cancro da mama e imunossupressão na artrite reumatóide e doença inflamatória intestinal: um estudo de coorte. Artrite Rheumatol 2016; 68: 2403-2411.
- Mercer LK, Lunt M, Low AL, et al: Risco de cancro sólido em doentes expostos à terapia do factor anti-necrose tumoral: resultados da Sociedade Britânica de Reumatologia Biológica Registo para a Artrite Reumatóide. Ann Rheum Dis 2015; 74(6): 1087-1093.
- Schmalzing M, Strangfeld A, Tony HP: Terapia medicamentosa da artrite reumatóide com história de malignidade. Dados epidemiológicos [Tratamento medicamentoso da artrite reumatóide com história de malignidade. Dados epidemiológicos]. Z Rheumatol 2016; 75(1): 22-31.
- Regierer AC, Strangfeld A: Tratamento da artrite reumatóide em pacientes com antecedentes de cancro. Curr Opinião Rheumatol 2018; 30(3): 288-294.
- Shelton E, Laharie D, Scott FI, et al: Recurrence Cancer Recurrence Following Immune-Suppressive Therapies in Patients With Immune-Mediated Diseases: A Systematic Review and Meta-analysis. Gastroenterologia 2016; 151(1): 97-109.e4.
- De Cock D, Hyrich K: Malignidade e artrite reumatóide: Epidemiologia, factores de risco e gestão. Best Pract Res Clin Rheumatol 2018; 32(6): 869-886.
- Lange E, Blizzard L, Venn A, et al: medicamentos anti-reumáticos modificadores da doença e cancro de pele não melanoma em pacientes com artrite inflamatória: um estudo de coorte retrospectivo. Reumatologia (Oxford) 2016; 55(9): 1594-1600.
- Solomon DH, Glynn RJ, Karlson EW, et al: Adverse Effects of Low-Dose Methotrexate: A Randomized Trial. Ann Intern Med 2020 Fev 18; [Epub ahead of print].
- Rizzi R, Curci P, Delia M, et al.: Remissão espontânea de “doenças linfoproliferativas associadas ao metotrexato” após a interrupção do tratamento imuno-supressor para a doença auto-imune. Revisão da literatura. Med Oncol 2009; 26(1): 1-9.
- Hellgren K, Baecklund E, Backlin C, et al: Artrite Reumatóide e Risco de Linfoma Maligno: O risco ainda está a aumentar? Artrite Rheumatol 2017; 69(4): 700-708.
- Behrens F, Koehm M, Burkhardt H: Update 2011: leflunomida na artrite reumatóide – forças e fraquezas. Curr Opinião Rheumatol 2011; 23(3): 282-287.
- Ruiz-Irastorza G, Ugarte A, Egurbide MV,et al: Os antimaláricos podem influenciar o risco de malignidade no lúpus eritematoso sistémico. Ann Rheum Dis 2007; 66(6): 815-817.
- Fardet L, Nazareth I, Petersen I: Effects of chronic exposure of hydroxychloroquine/chloroquine on the risk of cancer, metastasis, and death: a population-based cohort study on patients with connective tissue diseases. Clin Epidemiol 2017; 9: 545-554.
- Lopez A, Pouillon L, Beaugerie L, et al: Prevenção do cancro colorrectal em doentes com colite ulcerosa. Melhor Pract Res Clin Gastroenterol 2018; 32-33: 103-109.
- Moore TJ: Safety perspectives: cancer risks of biological products for psoriasis, www.ismp.org/quarterwatch/safety-perspectives (acedido: 29 de Março de 2018).
- Thai A, Prindiville T: Linfoma hepatoesplénico de células T e doença inflamatória intestinal. J Crohns Colitis 2010; 4: 511-522.
- Ertz-Archambault N, Kosiorek H, Taylor GE, et al: Association of Therapy for Autoimmune Disease With Myelodysplastic Syndromes and Acute Myeloid Leukemia. JAMA Oncol 2017; 3(7): 936-943.
- Scott FI, Mamtani R, Brensinger CM, et al: Risco de cancro da pele não-melanoma associado ao uso de imunossupressores e agentes biológicos em doentes com historial de doença auto-imune e cancro da pele não-melanoma. JAMA Dermatol 2016; 152(2): 164-172.
- Muellenhoff MW, Koo JY: Cyclosporine and skin cancer: an international dermatologic perspective over 25 years of experience. Uma revisão abrangente e busca para definir a utilização segura da ciclosporina em dermatologia. J Dermatolog Treat 2012; 23(4): 290-304.
- Vos M, Plasmeijer EI, van Bemmel BC, et al: Azathioprine to mycophenolate mofetil transition and risk of squamous cell carcinoma after lung lung transplantation. J Transplante de pulmão de coração 2018; 37(7): 853-859.
- Hellbacher E, Hjorton K, Backlin C, et al: Linfoma maligno em granulomatose com poliangite: subtipos, características clínicas e prognóstico. Acta Oncol 2019; 58(11): 1655-1659.
- Kang KY, Kim HO, Yoon HS, et al: Incidência de cancro entre pacientes do sexo feminino com lúpus eritematoso sistémico na Coreia. Clin Rheumatol 2010; 29(4): 381-388.
- Raaschou P, Simard JF, Asker Hagelberg C, et al: Artrite reumatóide, tratamento do factor de necrose anti-tumoral, e risco de cancro da pele de células escamosas e de células basais: estudo de coorte baseado em dados prospectivamente registados a nível nacional da Suécia. BMJ 2016; 352: i262.
- Mercer LK, Askling J, Raaschou P, et al: Risco de melanoma invasivo em doentes com artrite reumatóide tratados com produtos biológicos: resultados de um projecto de colaboração de 11 registos biológicos europeus. Ann Rheum Dis 2017; 76(2): 386-391.
- Staples MP, March L, Hill C, Lassere M, Buchbinder R: risco de malignidade em doentes australianos com artrite reumatóide tratados com terapia de factor de necrose anti-tumoral: uma actualização da base de dados prospectiva da Associação Australiana de Reumatologia (ARAD)estudo de coorte. BMC Rheumatol 2019; 3: 1.
- Cordtz R, Mellemkjær L, Glintborg B, et al: Progressão maligna das lesões pré-cancerosas do colo uterino após terapia biológica de DMARD em pacientes com artrite. Ann Rheum Dis 2015; 74(7): 1479-1480.
- Calip GS, Patel PR, Adimadhyam S, et al: Inibidores do factor alfa da necrose tumoral e risco de linfoma não-Hodgkin numa coorte de adultos com condições reumatológicas. Int J Cancer 2018; 143(5): 1062-1071.
- Mercer LK, Galloway JB, Lunt M, et al: Risco de linfoma em doentes expostos à terapia do factor de necrose antitumoral: resultados da Sociedade Britânica para a Biologia da Reumatologia Registo para a Artrite Reumatóide. Ann Rheum Dis 2017; 76(3): 497-503.
- Perez-Ruiz E, Minute L, Otano I, et al: O bloqueio profiláctico de TNF desacopla a eficácia e toxicidade em imunoterapia dupla CTLA-4 e PD-1. Natureza 2019; 569(7756): 428-432.
- Bertrand F, Montfort A, Marcheteau E, et al: TNFα bloqueio supera a resistência ao anti-PD-1 no melanoma experimental. Nat Commun 2017; 8(1): 2256.
- Badran YR, Cohen JV, Brastianos PK,et al: terapia concorrente com inibidores do ponto de controlo imunitário e TNFα bloqueio em doentes com eventos adversos relacionados com a imunidade gastrointestinal. J Immunother Cancer 2019; 7(1): 226.
- Kim ST, Tayar J, Trinh VA, et al: Tratamento bem sucedido da artrite induzida por inibidores de pontos de controlo com tocilizumab: uma série de casos. Ann Rheum Dis 2017; 76(12): 2061-2064.
- Kim SC, Pawar A, Desai RJ, et al: Risco de malignidade associado ao uso de tocilizumabe versus outros biológicos em pacientes com artrite reumatóide: Um estudo de coorte com múltiplas bases de dados. Semin Arthritis Rheum 2019; 49(2): 222-228.
- Wadström H, Frisell T, Askling J; Terapia Anti-Reumática na Suécia (ARTIS)Grupo de Estudo: Neoplasias Malignas em Pacientes com Artrite Reumatóide Tratados com Inibidores do Factor de Necrose Tumoral, Tocilizumab, Abatacept, ou Rituximab na Prática Clínica: Um Estudo de Coorte Nacional da Suécia. Interno JAMA Med 2017; 177(11): 1605-1612.
- Montastruc F, Renoux C, Dell’Aniello S, et al: Abatacept initiation in rheumatoid arthritis and the risk of cancer: a population-based comparative cohort study. Reumatologia (Oxford) 2019; 58(4): 683-691.
- de Germay S, Bagheri H, Despas F, et al: Abatacept in rheumatoid artritis and the risk of cancer: a world observational post-marketing study. Rheumatology (Oxford) 2019 Dez 27; [Epub ahead of print].
- Nast A, Amelunxen L, Augustin M, et al: S3-Leitlinie zur Therapie der Psoriasis vulgaris Update 2017. AWMF-Regist Nr. 013/001.
- Fiorentino D, Ho V, Lebwohl MG, et al: Risco de malignidade com tratamento da psoríase sistémica no Registo de Avaliação Longitudinal da Psoríase. J Am Acad Dermatol 2017; 77(5): 845-854.e5.
- Ridker PM, MacFadyen JG, Thuren T, et al: Effect of interleukin-1β inhibition with canakinumab on incident lung cancer in patients with atherosclerosis: exploratory results from a randomised, double-blind, placebo-controlled trial. Lancet 2017; 390(10105): 1833-1842.
- Porpaczy E, Tripolt S, Hoelbl-Kovacic A, et al: Linfomas agressivos de células B em doentes com mielofibrose que recebem terapia inibidora JAK1/2. Sangue 2018; 132(7): 694-706.
- Pemmaraju N, Kantarjian H, Nastoupil L, et al: Características de pacientes com neoplasias mieloproliferativas com linfoma, com ou sem terapia inibidora JAK. Sangue 2019; 133(21): 2348-2351.
- Resumo de segurança integrado, dados Abbvie em ficheiro.
- Smolen JS, Genovese MC, Takeuchi T, et al: Perfil de Segurança do Baricitinib em Pacientes com Artrite Reumatóide Activa com mais de 2 Anos de Tempo Médio em Tratamento. J Rheumatol 2019; 46(1): 7-18.
- Kremer J, Bingham C, Cappelli L, et al: Comparação das taxas de malignidade e mortalidade entre Tofacitinib e DMARD biológicos na prática clínica: Resultados de cinco anos de um Registo de Artrite Reumatóide Baseado nos EUA [abstract]. Artrite Rheumatol 2019; 71 (suppl 10).
- Schmalzing M.: Rheumatologische medikamentöse Therapie bei Malignomanamnese. Aktuelle Rheumatologie 2020; Georg Thieme Verlag KG Stuttgart; doi: 10.1055/a-1247-4252.
InFo ONCOLOGy & HEMATOLOGy 2021; 9(1): 10-15