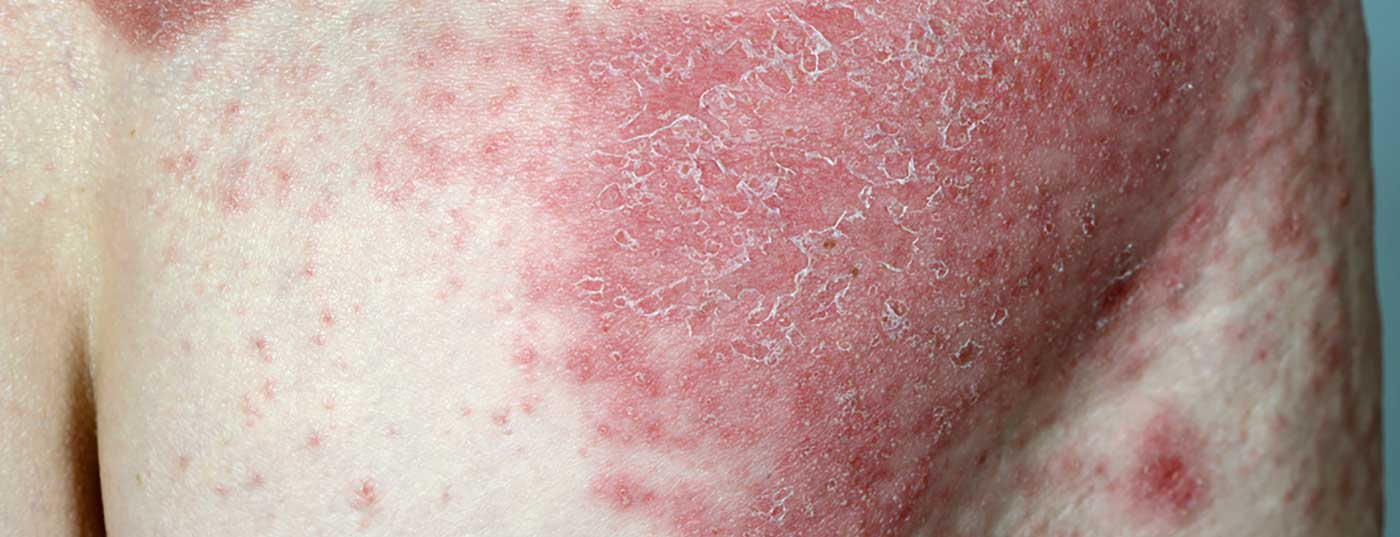
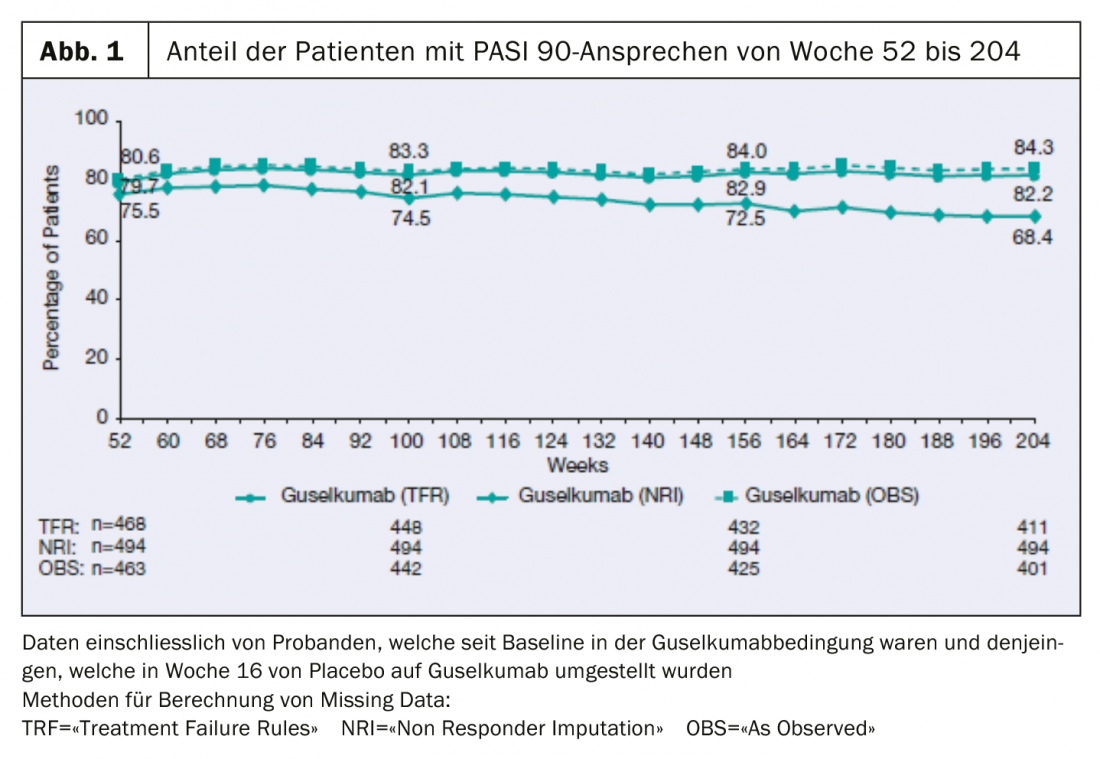
Os dados apresentados recentemente a longo prazo do ensaio clínico VOYAGE 1 fase III mostram que 84% dos pacientes continuam a alcançar o PASI-90 após 204 semanas.
O anticorpo monoclonal guselkumab (TREMFYA®) foi aprovado na Suíça desde 2018 para adultos com psoríase de placa moderada a grave que são elegíveis para terapia sistémica [1]. No ensaio VOYAGE 1 (n=837), guselkumab foi significativamente superior a adalimumab e placebo em todos os parâmetros primários (resposta PASI-90) e parâmetros secundários chave (resposta IGA 0/1, resposta PASI-75).
Elevada eficácia e tolerabilidade sustentadas
Os dados de quatro anos da fase de rótulo aberto do estudo multicêntrico, aleatório e duplo-cego VOYAGE 1 estão agora disponíveis e foram apresentados na 39th Fall Clinical Dermatology Conference em Las Vegas (EUA) [2]: A proporção de pacientes com IPPAS 90 permaneceu estável até à semana 204: 8 em cada 10 pacientes mostraram uma resposta ao IPPAS 90 com guselkumab durante este período. (Fig. 1). 82% dos pacientes que receberam TREMFYA® (guselkumab) no grupo combinado de pacientes inicialmente aleatorizados para a condição guselkumab ou placebo com uma mudança para guselkumab na semana 16 alcançaram uma melhoria de pelo menos 90% no Índice de Gravidade da Área Psoríase (PASI 90) na semana 204. Além disso, uma pontuação IGA de 0 (sem lesões) ou 1 (quase sem lesões) era mensurável neste momento de medição.
Guselkumab (TREMFYA®) é o primeiro anticorpo monoclonal totalmente humano aprovado que se liga selectivamente à subunidade p19 da interleucina-23 (IL-23) e inibe a sua interacção com o receptor IL-23 [1]. Esta substância bloqueia assim a libertação destas citocinas inflamatórias, que estão envolvidas na formação de placas na psoríase. TREMFYA® foi geralmente bem tolerado pelos doentes com psoríase durante o desenvolvimento clínico [3–5]. Também não foram identificados novos sinais de segurança durante o período de rotulagem aberta de 4 anos [2].
VOYAGE 1 Estudo de acompanhamento da Fase III
Os assuntos foram atribuídos aleatoriamente na linha de base a placebo, guselkumab ou adalimumab. A fase de tratamento controlada com placebo durou de 0 a 16 semanas. Subsequentemente, os pacientes na condição de placebo foram trocados para guselkumab até à semana 48, e foi feita uma comparação com a substância activa adalimumab (semanas 0-48). Os participantes do estudo foram aleatorizados para receber guselkumab na semana 0 e aqueles que mudaram de placebo para guselkumab na semana 16 receberam guselkumab na semana 48, com 8 semanas de intervalo. A partir da semana 52, todos os participantes receberam guselkumab. A eficácia foi avaliada utilizando o Índice de Área Psoríase e Severidade (PASI75/90/100) e as pontuações IGA (0=sem lesões, 1=sem lesões). Os dados em falta foram calculados utilizando os seguintes métodos: NRI (“Non-Responder Imputation Rules”), TFR (“Treatment Failure”) e OBS (“As Observed”).
Fonte: Janssen-Cilag AG
Literatura:
- Subject Guide Tremfya®, 02/2019, www.swissmedicinfo.ch, último acesso 24.10.2019
- Griffiths CE, et al: Manutenção da resposta com até 4 anos de tratamento contínuo de guselkumab: resultados do ensaio VOYAGE 1 fase 3. Conferência de Dermatologia Clínica Falls. Out, 2019; Las Vegas, EUA.
- Blauvelt A, et al: Eficácia e segurança do guselkumab, um anticorpo monoclonal anti-interleucina-23, em comparação com o adalimumab para o tratamento contínuo de doentes com psoríase moderada a grave: Resultados do ensaio VOYAGE 1, fase III, duplo-cego, placebo- e activo, controlado por comparador. J Am Acad Dermatol 2017; 76(3): 405-417.
- Reich K, et al: Eficácia e segurança do guselkumab, um anticorpo monoclonal anti-interleucina-23, em comparação com o adalimumab para o tratamento de doentes com psoríase moderada a grave com retirada aleatória e novo tratamento: Resultados do ensaio fase III, duplo-cego, placebo- e VOYAGE 2 controlado por comparador activo. J Am Acad Dermatol 2017; 76(3): 418-431.
- Langley R, et al: Eficácia e segurança do guselkumab em doentes com psoríase que têm uma resposta inadequada ao ustekinumab: resultados do ensaio NAVIGATE fase III aleatorizado, duplo-cego. Br J Dermatol 2018; 178(1): 114-123.
DERMATOLOGIE PRAXIS 2019; 29(6): 31 (publicado 8.12.19, antes da impressão).