A incidência da doença clamídial e gonocócica na Suíça está a aumentar. Ao mesmo tempo, os gonococos multi-resistentes e M. genitalium tornam a antibioticoterapia mais difícil. São necessárias novas estratégias para prevenir a propagação destes agentes patogénicos.
A uretrite é a doença sexualmente transmissível mais comum nos homens. Representa uma inflamação da uretra com um aumento de leucócitos no exsudado uretral. Embora possam estar presentes causas infecciosas e não infecciosas (Tab. 1), são na sua maioria causadas por agentes patogénicos sexualmente transmissíveis. Devido à elevada incidência e possíveis complicações da infecção com agentes patogénicos uretríticos em doentes e parceiros sexuais, a gestão da doença tem uma elevada prioridade nos cuidados de saúde pública. Para além do tratamento dos sintomas, os objectivos do tratamento são evitar complicações e reduzir a transmissão de co-infecções (como o VIH). A identificação e tratamento das pessoas de contacto, bem como as medidas educativas com motivação para um comportamento adaptado têm, em última análise, um significado epidemiológico adicional.

Classificação e sintomas
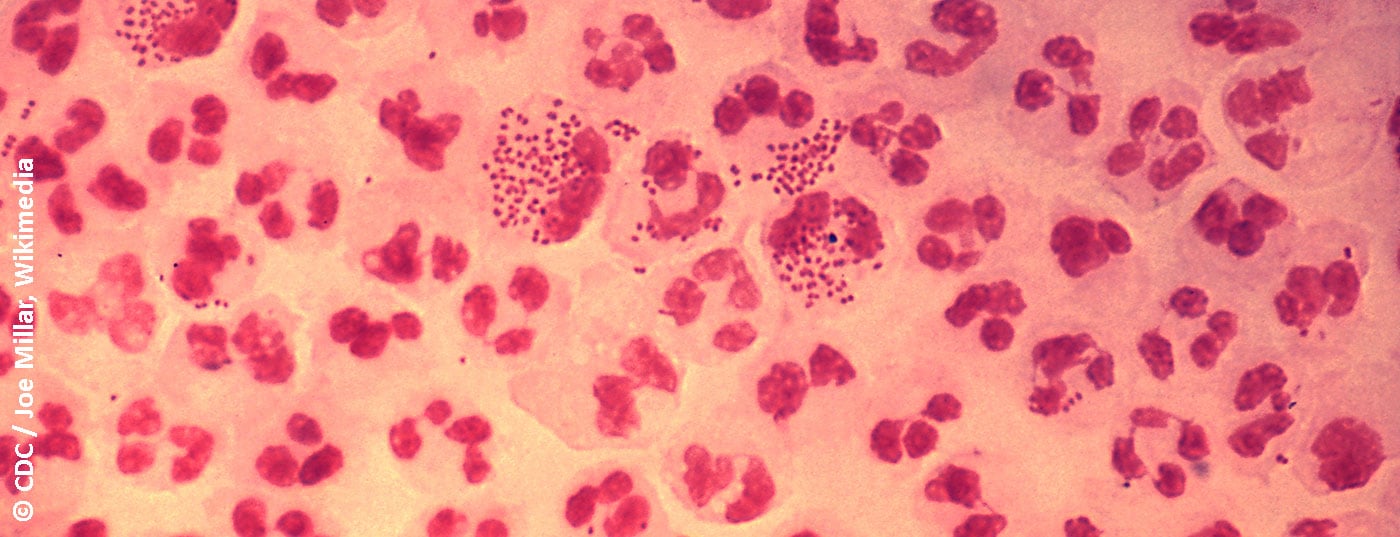
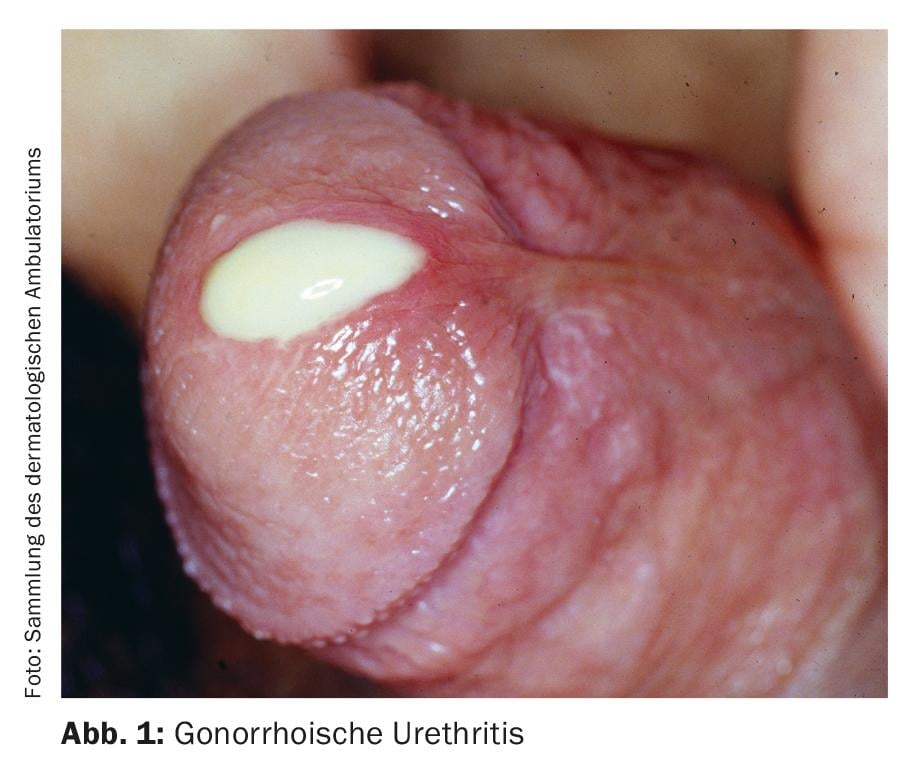
A classificação da uretrite em formas gonorreicas e não gonorreicas baseia-se na tradicional coloração de Gram de descarga uretral para diplococos gram-negativos. Os sintomas típicos são descarga, tipicamente purulenta na uretrite gonorreica (Fig. 1), mucóide na uretrite não gonorreica. Outros sintomas possíveis incluem disúria, queimadura uretral ou prurido, e irritação da uretra do meato, por vezes com balanite de acompanhamento. No entanto, a uretrite é frequentemente assintomática [4]. A uretrite deve ser distinguida de uma infecção do tracto urinário ou prostatite, que deve ser considerada como um diagnóstico diferencial.
Espectro de agentes patogénicos
Os agentes patogénicos mais comuns são Neisseria gonorrhoeae, Chlamydia trachomatis e micoplasmas, especialmente Mycoplasma genitalium (M. genitalium). A incidência de infecções por clamídia e gonorreia tem aumentado acentuadamente na Suíça nos últimos anos. Entre os micoplasmas, o significado patogénico do M. genitalium é melhor estabelecido. Deve notar-se que a dificuldade de erradicação completa e um problema crescente de resistência complicam a terapia dos micoplasmas. Actualmente, os autores das directrizes britânicas para o tratamento das infecções de M. genitais têm-se pronunciado contra o rastreio de indivíduos assintomáticos, uma vez que isto é mais susceptível de causar danos a nível da população [5]. Até agora, tem sido dada muito pouca atenção à importância dos agentes patogénicos da vaginose bacteriana como causa de uretrite. Após a relação sexual oral, germes respiratórios como Haemophilus spp. e agentes patogénicos virais como o herpes simples e adenovírus (frequentemente com conjuntivite de acompanhamento) ocorrem com mais frequência. Em viajantes que regressam de áreas endémicas, a procura de Trichomonas vaginalis também pode ser útil.
Diagnósticos
A análise dos sintomas uretríticos inclui história, exame clínico, preparação de uma amostra directa complementada por testes laboratoriais para agentes patogénicos uretríticos. Além disso, o rastreio alargado de doenças sexualmente transmissíveis como o VIH e a sífilis é geralmente apropriado. A história sexual (na língua do paciente) deve explorar práticas sexuais, medidas de protecção, número de parceiros e orientação sexual, a fim de fazer uma avaliação de risco diferenciada e de poder aconselhar o paciente de uma forma orientada. Clinicamente, para além de uma avaliação do flúor, procura-se uma linfadenopatia inguinal, bem como quaisquer ulcerações. O diagnóstico inclui, sempre que possível, uma preparação directa, no macho por meio de um esfregaço da uretra, na fêmea a partir do canal cervical [6].
A morfologia do esfregaço ajuda a distinguir a uretrite gonorreica da uretrite não-gonorreica com base nos diplococos intracelulares típicos, bem como de uma génese viral com predominância de células mononucleares. A sensibilidade e especificidade de outros métodos de diagnóstico são inferiores ao esfregaço uretral. Se a microscopia não estiver disponível, a uretrite pode ser diagnosticada pela presença de descarga mucopurulenta, um teste positivo de esterase leucocitária no exame de urina do primeiro jacto, ou se estiverem presentes estrias na urina do primeiro jacto (também fisiologicamente possível) [6].
O esfregaço uretral ou a urina do primeiro fluxo são adicionalmente testados para Neisseria gonorrhoeae, Chlamydia trachomatis e, em doentes sintomáticos, também para M. genitalium por meio de amplificação genética. Deve sempre tentar-se um exame bacteriológico do esfregaço por meio de cultura, uma vez que a cultura é utilizada para examinar o perfil de resistência dos gonococos e para procurar outros agentes patogénicos bacterianos. Se disponível, a resistência aos macrolídeos deve também ser procurada quando o M. genitalium é identificado, usando a reacção em cadeia da polimerase para analisar genes de resistência conhecidos. Em pacientes do sexo feminino, o exame do esfregaço vaginal para amplificação genética é superior à urina inicial para o diagnóstico de gonorreia ou infecção por clamídia.
Terapia
Em doentes com uretrite confirmada, recomenda-se o tratamento simultâneo de gonococos e clamídia, a menos que já estejam disponíveis resultados de testes de amplificação genética para limitar a terapia ao patogénio específico. As recomendações de tratamento da uretrite gonorreica e não gonorreica sem complicações, adaptadas de acordo com as directrizes actuais, estão resumidas no quadro 2. Para a gonorreia, o padrão é a dupla terapia de combinação antimicrobiana. A abordagem terapêutica combinada destina-se a proporcionar uma melhor garantia de erradicação, de modo a que a propagação de gonococos resistentes possa eventualmente ser evitada. Na uretrite não gonorreica, a terapia com doxiciclina visa uma infecção por clamídia; não se conhece aqui um problema de resistência. No entanto, se uma infecção com M. genitalium estiver presente, apenas 30% são tratados com doxiciclina, e a terapia não leva ao desenvolvimento de resistência [7].

A terapia com azitromicina 1 g (dose única) deve ser evitada, se possível, devido ao risco de induzir resistência aos macrólidos no M. genitalium. A azitromicina não é uma terapia fiável, especialmente para a co-infecção rectal clamídial assintomática comum. Se M. genitalium for detectado, a azitromicina deve ser administrada durante vários dias, por exemplo 500 mg no dia 1 seguido de 250 mg diários durante mais 4 dias. Isto consegue uma melhor erradicação do que com a dose única [7], para que haja um menor desenvolvimento de resistência [8]. Ao utilizar moxifloxacina, deve ser tida em conta uma possível hepatotoxicidade.
A identificação e terapia dos parceiros sexuais é obviamente de grande importância para o parceiro afectado, para o doente prevenir a reinfecção e epidemiologicamente, especialmente tendo em conta o crescente problema de resistência. Como orientação, os parceiros sexuais dos últimos 60 dias devem ser esclarecidos e tratados. A recomendação de abstinência sexual aplica-se durante pelo menos uma semana ou até que o exame esteja concluído [1].
No caso dos gonococos, o sucesso da terapia é verificado após duas semanas no mínimo [9], e no caso do micoplasma após três semanas no mínimo, ou melhor após cinco semanas [7]. Uma verificação terapêutica para a clamídia só é recomendada durante a gravidez ou após a terapia de segunda linha quatro semanas após a terapia [10]. No entanto, a reinfecção com clamídia deve ser procurada após três meses.
Medidas para conter o desenvolvimento de resistência em gonococos e M. genitalium
Nos gonococos e M. genitalium, estão a ser detectados em todo o mundo casos de resistência extensiva aos antibióticos comummente utilizados, cuja propagação é temida. Nos últimos anos, foi observada na Suíça uma redução da susceptibilidade dos gonococos à ceftriaxona [13]. Em 2018, foi identificado um total de três casos de infecções gonocócicas resistentes tanto à ceftriaxona como à azitromicina em Inglaterra e na Austrália [14]. Para M. genitalium, a resistência aos macrólidos é comum em países onde a terapia de primeira linha com azitromicina é utilizada. A resistência ao moxifloxacin está presente em <10% na Europa, e é muito mais comum na Ásia. Devido à situação de resistência, estão a ser manifestados receios de que as infecções com M. genitalium deixem em breve de ser tratáveis.
As medidas para combater a resistência nos gonococos incluem a remoção consistente de uma cultura e, no caso do M. genitalium, a procura de genes de resistência através da amplificação dos genes, se possível, a fim de utilizar uma terapia adaptada à determinação da resistência. Dependendo do agente patogénico, as infecções faríngeas e anais concomitantes, frequentemente assintomáticas, também devem ser tidas em conta, as quais devem ser cada vez mais procuradas e tratadas. A utilização de azitromicina 1 g dose única deve ser evitada, se possível, e mesmo a sua utilização em terapia combinada de gonorreia é controversa. A implementação de um controlo terapêutico, terapia de parceiro e medidas preventivas relativas ao comportamento sexual são outras medidas para prevenir a propagação de agentes patogénicos resistentes.
Mensagens Take-Home
- A incidência da doença clamídial e gonocócica na Suíça está a aumentar.
- Ao mesmo tempo, em todo o mundo, também na região europeia, na
- Nos últimos anos, foram encontrados gonococos multi-resistentes e M. genitalium que já não podem ser tratados com antibióticos comummente utilizados.
- São indicadas novas estratégias para prevenir a propagação destes agentes patogénicos.
Literatura:
- Lautenschlager S: uretrite não-gonorreica: espectro patogénico e gestão. Journal of Urology and Urogynecology 2014; 21 (1) (edição para a Suíça): 17-20.
- Moi H, Blee K, Horner PJ: Gestão da uretrite não-gonocócica. BMC Infect Dis 2015;15: 294.
- Bachmann LH, et al: Avanços na compreensão e tratamento da uretrite masculina. Clin Infect Dis 2015; 61(Suppl 8): 763-769.
- Kälin U, Lauper U, Lautenschlager S: Urethritis. Espectro de patogénese, clarificação e terapia – Parte 2. Schweiz Med Forum 2009; 9: 121-124.
- Soni S, et al: 2018 BASHH UK directriz nacional para a gestão da infecção com Mycoplasma genitalium, rascunho, download a partir de www.bashhguidelines.org/media/1182/bashh-mgen-guideline-2018_draft-for-consultation.pdf, último acesso 16.11.2018.
- Horner P, et al: 2016 European guideline on the management of nononocococcal urethritis. International Journal of STD & AIDS 2016; 27: 928-937.
- Jensen JS, Cusini M, Gomberg M, Moi H: 2016 European guideline on Mycoplasma genitalium infections. J Eur Acad Dermatol Venereol 2016; 30: 1650-1656.
- Lau A, et al: The Efficacy of Azithromycin for the Treatment of Genital Mycoplasma genitalium: A Systematic Review and Meta-analysis. Clin Infect Dis 2015; 61: 1389-1399.
- Bignell C, Unemo M: 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS 2013; 24: 85-92.
- Lanjouw E, et al: 2015 European guideline on the management of Chlamydia trachomatis infections. Int J STD AIDS 2016; 27: 333-348.
- Toutos Trellu L, et al: Gonorrhoea: novas recomendações sobre diagnóstico e tratamento. Schweiz Med Forum 2014; 14(20): 407-409.
- Horner P, et al.: 2016 European guideline on the management of nononocococcal urethritis. International Journal of STD & AIDS 2016; 27(11): 928-937.
- Kovari H, et al.: Diminuição da susceptibilidade da Neisseria gonorrhoeae isola da Suíça à cefixima e à ceftriaxona: dados de susceptibilidade antimicrobiana de 1990 e 2000 a 2012. BMC Doenças Infecciosas 2013; 13: 603.
- European Centre for Disease Prevention and Control: Rapid Risk Assessment: Extensively Resistant drug-resistant (XDR) Neisseria gonorrhoeae in the United Kingdom and Australia, Data de publicação 7 de Maio de 2018, www.ecdc.europa.eu, última vez que se acedeu a 07.11.2018.
PRÁTICA DA DERMATOLOGIA EM 2018; 28(6): 4-7