Além da clamídia e dos gonococos, há numerosos agentes patogénicos que podem causar uretrite. Ocasionalmente, características clínicas podem apontar para o germe responsável, tais como marcada dor e meatite em adeno- e herpesvírus ou balanoposte concomitante em Mycoplasma genitalium. O diagnóstico microscópico do flúor permite que a gonorreia seja diferenciada da NGU, permite uma terapia imediata e pode, adicionalmente, fornecer indicações de uretrite viral. Especialmente nas formas crónicas ou recorrentes, deve ser realizada uma ampla clarificação patogénica, tendo em conta o Mycoplasma genitalium e Trichomonas vaginalis. Em casos de falha do tratamento com terapia padrão (especialmente M. genitalium e U. urealyticum), deve ser usada azitromicina prolongada.
Após excluir uma infecção do tracto urinário, deve ser feita uma distinção entre uma forma não infecciosa e uma forma infecciosa de uretrite (tab. 1) . As causas típicas da uretrite não infecciosa são desencadeadores mecânicos-traumáticos; causas químicas (por exemplo desinfectantes, sabões) ou locais tais como anomalias congénitas, fimose, neoplasia podem também ser acompanhadas por uretrite não infecciosa. Tradicionalmente, a uretrite infecciosa está dividida em dois grupos: Uretrite gonocócica (GU) e a chamada uretrite não-gonorreica (NGU). Esta classificação surgiu historicamente para distinguir as UNG – um grupo de infecções de sintomatologia semelhante com, na altura, pouco claras, heterogéneas e difíceis de determinar aetiologia – da muito melhor pesquisada e mais grave uretrite gonorreica. A NGU, que costumava ser chamada uretrite não específica, era comparativamente rara juntamente com a gonorreia, mas agora excede em muito a sua incidência e não é raramente assintomática. No entanto, a seguir, apenas a uretrite infecciosa não gonorreica e o seu espectro patogénico, são discutidas as medidas de esclarecimento e terapêuticas necessárias.

A prevalência do espectro patogénico causador é relatada de forma diferente de acordo com as regiões (Tab. 1). A proporção de doentes em que nenhum agente patogénico poderia ser isolado depende do diagnóstico realizado e do facto de, por exemplo, as uretrites virais serem mais frequentes do que se supunha anteriormente, mas raramente são procuradas. A NGU está presente se a preparação do esfregaço corado da uretra contiver mais de cinco leucócitos polimorfonucleares.
por campo de visão (ampliação total 400x), na ausência de diplococos intracelulares.
Chlamydia
Chlamydia trachomatis compreende um total de 15 serótipos definidos por diferentes antigénios proteicos, designados pelas letras A-C, D-K e L1-L3, que causam diferentes doenças. Os serovares D-K são causa de uretrite, cervicite, endometrite e salpingite. Os agentes patogénicos não infectam o epitélio escamoso, mas apenas o epitélio cilíndrico e têm uma prevalência de 4-5% nas mulheres na Europa.
C. tracomatis é encontrada em 15-41% de todos os casos de uretrite nos homens. No entanto, na literatura dos últimos dez anos, a frequência da clamídia como agente patogénico não é relatada de forma consistente. A transmissão ocorre por contacto sexual desprotegido, com idade inferior a 20 anos, promiscuidade e falta ou uso incorrecto do preservativo como factores de risco. Recomenda-se o rastreio anual para pacientes sexualmente activos com menos de 25 anos de idade, bem como para mulheres com mais de 25 anos com factores de risco (múltiplos parceiros, novos parceiros). No entanto, as infecções de clamídia genital afectam todos os grupos sociais por igual.
A infecção por clamídia nos homens torna-se perceptível após um período de incubação de sete dias a três semanas com descarga serosa. Além disso, é relatada uma sensação de ardor e alguria. No exame, para além de um avermelhamento discreto da uretra do orifício e da aderência do orifício uretral, não há normalmente outras descobertas (Fig. 1) . Em 30-50% de todos os homens infectados, a infecção é assintomática. O local mais comum de infecção por clamídia nas mulheres é o colo do útero, sendo a infecção assintomática em até 70%. Se não for tratada, uma infecção genital por clamídia nas mulheres persiste durante uma média de dois anos. Esta infecção crónica assintomática parece ser a principal causa de oclusão tubária bilateral, que é a causa mais comum de infertilidade nas mulheres e estima-se que afecte mais de 100 000 mulheres na Alemanha. As manifestações clínicas são corrimento genital amarelo-esbranquiçado com comichão e queimadura na introdução vaginal. As infecções faríngeas não raro parecem estar presentes assintomática, mas não requerem uma terapia diferente.
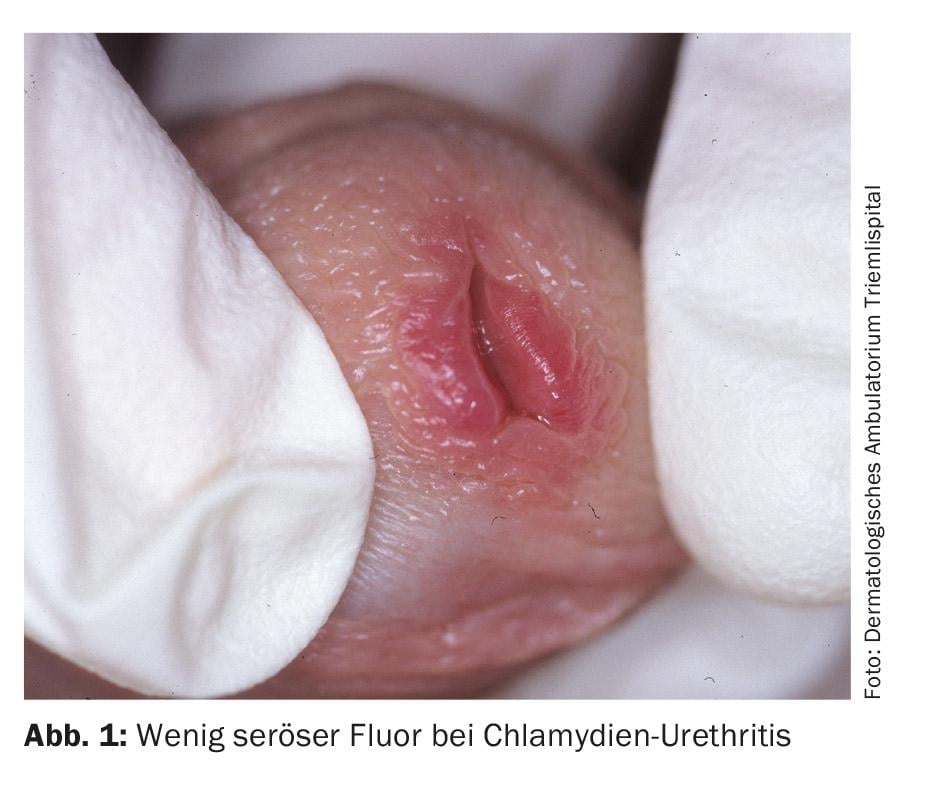
Diagnóstico: Nas mulheres, os agentes patogénicos são detectados através de testes de esfregaço do colo do útero ou vagina ou análises de urina (um pouco menos sensíveis) utilizando a PCR. Nos homens, também se pode realizar um teste de urina ou um teste de esfregaço da uretra.
Devido ao seu pequeno tamanho e baixa afinidade pelo corante, a clamídia não pode ser vista nativamente ou por coloração. Como bactérias intracelulares obrigatórias, o cultivo também é difícil, razão pela qual a cultura quase nunca é mais realizada.
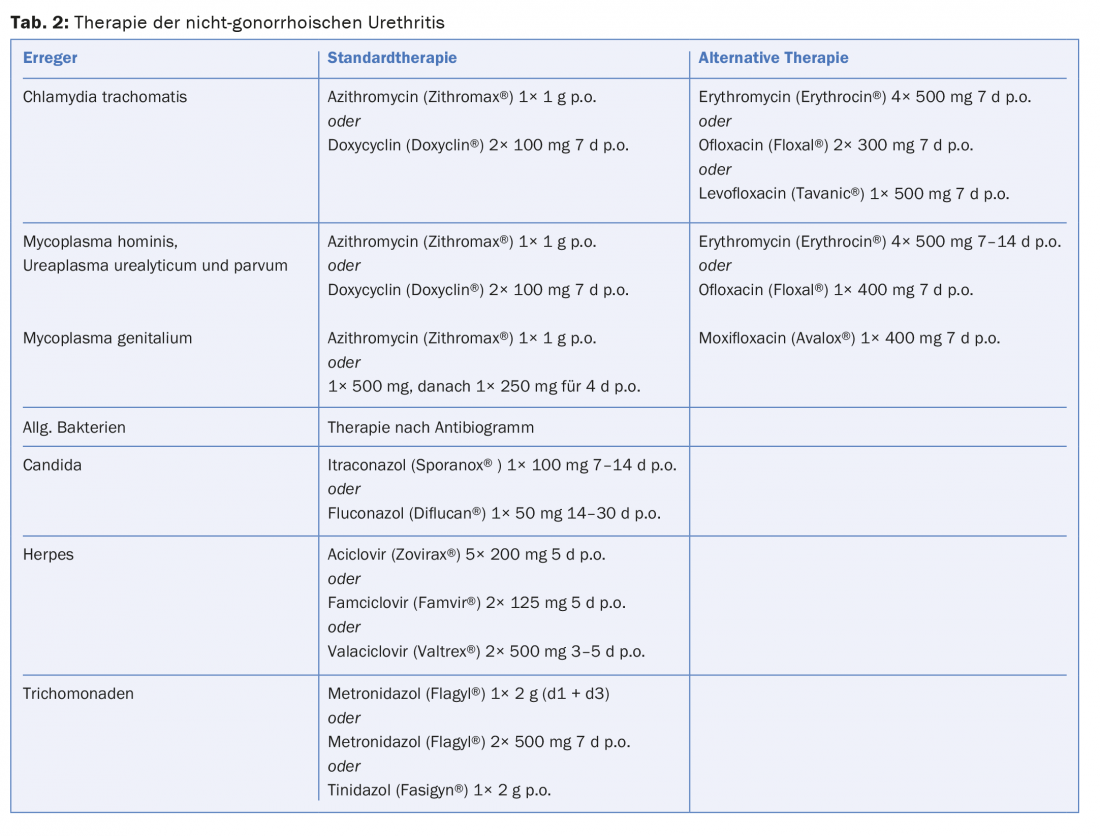
Terapia: As infecções urogenitais não complicadas podem ser tratadas com doxiciclina 2× 100 mg durante sete dias ou azitromicina 1 g uma vez. A eficácia dos dois antibióticos é quase equivalente com uma resposta ligeiramente melhor à doxiciclina, mas uma melhor conformidade sob azitromicina. Como documentado recentemente, as taxas de cura nas UNG parecem estar a diminuir um pouco sob estas terapias padrão, mas a mudança para outros medicamentos não é recomendada. Com base em dados actuais, a azitromicina, tal como a eritromicina, pode ser considerada segura na gravidez. Alternativamente, amoxicilina pode ser administrada 3× 500 mg/d durante sete dias durante a gravidez.
Mycoplasma
Os micoplasmas são bactérias gram-negativas imobilizadas. Diferem de outras bactérias no seu pequeno tamanho celular, pequeno genoma e falta de parede celular. Em meios de cultura especiais, podem distinguir-se ureaplasmas (Ureaplasma urealyticum) e micoplasmas não-ureaplasma (Mycoplasma hominis). Posteriormente, o U. urealyticum foi dividido em Biovar 1 e Biovar 2. Em 1999, Biovar 1 foi classificado como uma nova espécie bacteriana independente sob o nome U. parvum, enquanto Biovar 2 foi designado U. urealyticum. Em 1981, foi descoberta outra variante – Mycoplasma genitalium – que foi posteriormente descrita em vários estudos como o agente causador da uretrite aguda e cada vez mais também como o agente causador da uretrite crónica, mas também da cervicite, endometrite e na infertilidade feminina.
O significado dos micoplasmas genitais para o desenvolvimento de doenças sexualmente transmissíveis é controverso. M. hominis não parece ser responsável pela NGU em homens, apesar da detecção no tracto urogenital. U. urealyticum (Biovar 2) também pode ser frequentemente isolado do tracto genital de mulheres e homens saudáveis; possíveis manifestações clínicas foram postuladas em pacientes mais jovens, alta concentração bacteriana, com o serótipo específico Biovar 2 e com infecção inicial. O significado de U. parvum continua a não ser claro.
As infecções por micoplasma podem causar sintomas clínicos de uretrite nos homens, para além de cursos silenciosos. As infecções de U. urealyticum e M. genitalium em particular manifestam-se sob a forma de uretrite aguda, mas também de uretrite crónica com disúria e flúor. Uma característica clínica especial da uretrite causada por M. genitalium é a associação significativamente frequente com balanite e/ou póstite, que não é observada com clamídia e ureaplasma.
Diagnóstico: Devido ao seu tamanho e baixa afinidade com corantes, a detecção de micoplasmas em preparações Gram não é possível. U. urealyticum, U. parvum e M. hominis são detectados por PCR ou cultura, M. genitalium exclusivamente por PCR. Os testes serológicos não são significativos para o diagnóstico de infecções com micoplasmas na prática clínica diária.
Terapia: Tetraciclinas, antibióticos macrolídeos e quinolonas são os medicamentos de eleição. Doxiciclina 2× 100 mg/d durante sete dias ou azitromicina 1× 1 g são considerados terapia padrão para M. hominis, U. parvum e U. urealyticum (Tab.2). Nas formas crónicas de uretrite, pode ser necessária uma maior duração da terapia. A azitromicina é recomendada para o tratamento da uretrite genital porque o seu efeito é claramente superior ao das tetraciclinas. As falhas de tratamento têm sido observadas cada vez mais recentemente, e é por isso que, no caso de uma não resposta de 1 g azitromicina, é favorecido um tratamento que dura vários dias. (Tab.2). A moxifloxacina é considerada o medicamento de reserva absoluta; no entanto, falhas no tratamento inicial também foram recentemente descritas em casos de resistência a macrólidos e quinolonas. Com um aumento no desenvolvimento da resistência, a importância de outros medicamentos como o sitafloxacin ou o gatifloxacin deve ser investigada mais a fundo, a fim de evitar que a ameaça de M. genitalis se torne intratável.
Bactérias da flora oral e anal
Os uretrídios podem ser causados por numerosas outras bactérias. O Staphylococcus aureus pode resultar em uretrite, cistite ou prostatite, especialmente em doentes com cateteres uretrais. Os estreptococos e especialmente os enterococos também podem levar à uretrite. A E. coli raramente pode causar uretrite, cistite, prostatite ou epididimite, e pielonefrite nos homens após as relações anais. Raramente, uma infecção por Pseudomonas pode também apresentar-se com uretrite.
Os agentes patogénicos da flora oral como o haemophilus influenzae e o parainfluenzae, mas também os meningococos, não podem ser raramente causadores, especialmente porque o sexo oral é hoje em dia considerado por muitos como supostamente não problemático no que diz respeito à transmissão de infecções e, consequentemente, poucos preservativos são utilizados durante o sexo oral. A prevalência real de uretrídios causados por Haemophilus é desconhecida porque, por um lado, não há obrigação de comunicar e, por outro lado, o agente patogénico não é normalmente incluído no trabalho.
Diagnóstico: As provas bacteriológicas do agente patogénico através de cultura devem ser sempre procuradas para estabelecer o diagnóstico.
Terapia: A terapia depende do agente patogénico e do antibiograma.
Cândida
Candida albicans pode levar à uretrite secundária à balanite ou vulvovaginite, especialmente na presença de diabetes mellitus ou imunodeficiência.
Diagnóstico: A detecção é efectuada na preparação directa e por cultura micológica.
Terapia: Os derivados de imidazol como o itraconazol 100 mg/d durante 7-14 dias ou fluconazol 50 mg/d durante 14-30 dias são utilizados para terapia (Tab. 2).
Vírus
A uretrite viral deve ser suspeita se os esclarecimentos bacteriológicos forem improdutivos. Na uretrite do vírus do herpes simplex (HSV), há uma descarga serosa dolorosa, frequentemente acompanhada de erupções herpetiformes na genitália externa. Mais raramente, ocorre uma infecção exclusivamente intrauretral por HSV (Fig. 2).
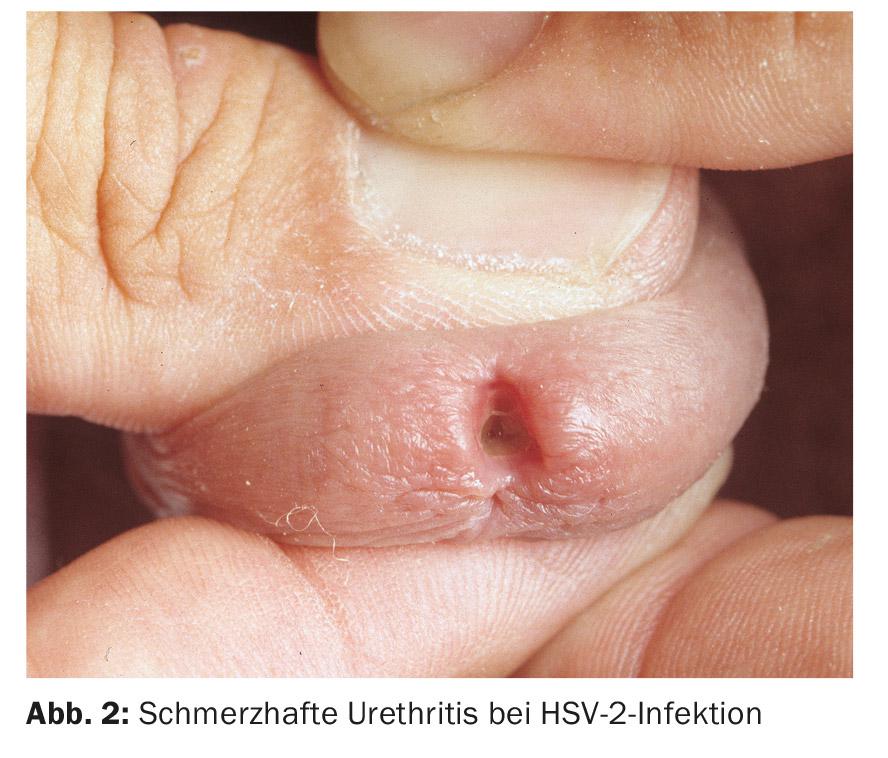
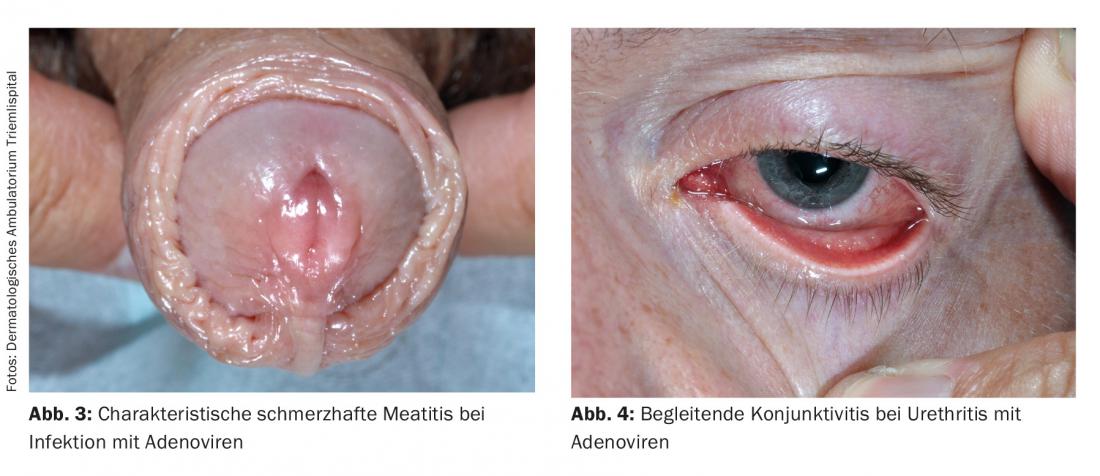
Estudos recentes mostraram que o HSV tipo 1 causa NGU mais frequentemente do que o HSV tipo 2. A proporção de HSV em NGU é relatada de forma diferente, mas representou até 12% num estudo. Os adenovírus também podem causar uretrite. Esta caracteriza-se normalmente por uma marcada meatite e dor (Fig. 3); na maioria dos casos é também acompanhada por conjuntivite altamente contagiosa (Fig. 4) . Os montes de células mononucleares na preparação directa podem ser diagnosticados de forma inovadora. Especialmente após contacto oral desprotegido, os vírus adeno- e herpes simples devem ser considerados como a causa na ausência de detecção de agentes patogénicos, dores pronunciadas e meatites. Os vírus Epstein-Barr também parecem ter um papel a desempenhar.
Diagnóstico: No caso de infecções por herpes, é recomendado um teste de esfregaço. A detecção cultural do HSV requer cerca de 48 horas. Os vírus só podem ser obtidos a partir de lesões frescas para o cultivo. O material de esfregaço pode ser analisado em poucas horas por PCR. Tanto a cultura como a PCR também podem ser feitas a partir da urina. A detecção de antigénios por imunofluorescência é também adequada para o diagnóstico. A detecção de adenovírus por PCR pode ser feita por esfregaço ou a partir de urina.
Terapia: A terapia da uretrite herpética é realizada com análogos de nucleosídeos, se necessário.
Trichomonads
Trichomonas vaginalis é um flagelado de forma oval com quatro flagelados e uma membrana ondulada. A tricomoníase é uma infecção sexualmente transmissível que ocorre em todo o mundo e a sua prevalência depende do comportamento sexual de risco. Nas estatísticas, existem diferenças consideráveis nas taxas de infecção entre grupos populacionais individuais e entre países industrializados e países em desenvolvimento. Na Suíça, por exemplo, esta infecção desempenha um papel menor em contraste com Seattle, onde até 20% dos casos de NGU em homens são causados por este patogénio.
Diagnóstico: Exame microscópico da preparação nativa com 0,9% de NaCl da abóbada vaginal, colo do útero e uretra produz taxas de sucesso de até 75%. A polarização ou o microscópio de campo escuro aumentam a taxa de acerto.
Está disponível uma gama de meios de cultura adequados com uma sensibilidade de cerca de 95%. A cultura só é oferecida em muito poucos laboratórios. A PCR, que tem a maior sensibilidade, também ainda não está muito difundida.
Terapia: A tricomoníase pode ser tratada com metronidazol 1× 2 g com possível repetição após dois dias ou com 2× 500 mg/d durante sete dias, mas note-se o efeito de antabuse-like. Raramente, a resistência ao metronidazol pode ser observada. Tinidazole 1× 2 g também pode ser usado como opção de tratamento. O tinidazol tem uma semi-vida mais longa, menos efeitos secundários e uma taxa de cura ligeiramente superior.
Um exemplo de uma possível abordagem à uretrite está listado no quadro 3.

Literatura do autor
PRÁTICA DA DERMATOLOGIA 2015; 25(4): 5-10











