Os doentes com CML têm uma esperança de vida normal quando tratados com inibidores de cinase específicos de Abl (TKIs) na fase crónica. Imatinib, dasatinib e nilotinib são aprovados para o tratamento de primeira linha de CML. Em caso de resistência ou intolerância, o bosutinib e o ponatinib estão disponíveis como alternativas TKI. O objectivo da terapia é conseguir uma remissão molecular profunda (MR). Este é um pré-requisito para os conceitos de descontinuação da TKI e a realização de uma remissão sem terapia (TFR). Os mecanismos biológicos subjacentes a um TFR não são conhecidos com precisão, mas são provavelmente mediados imunologicamente. É possível que a terapia com interferão-alfa temporário (IFN) ou terapia inibidora do ponto de controlo imunitário possa aumentar a taxa de TFR. Estas questões estão actualmente a ser abordadas em ensaios clínicos.
Cada paciente com LMC deve ser tratado com um TKI específico para Abl aprovado na terapia de primeira linha. Uma resposta atempada à terapia molecular é relevante em termos de prognóstico. Para se poder avaliar isto, é essencial o registo regular da carga de mRNA BCR-ABL (de três em três meses até se conseguir um MMR estável, depois pelo menos de seis em seis meses) durante a terapia TKI [1]. O número da cópia BCR-ABL é medido em laboratórios normalizados e normalizado na unidade internacional “IS” [2]. A carga BCR-ABL após IS faz uma declaração sobre a profundidade da remissão alcançada. A diminuição do número de cópias BCR-ABL no sangue periférico é expressa em etapas logarítmicas a partir da linha de base no diagnóstico. Simplificado, um MR3 (MMR) corresponde a uma queda na carga de BCR-ABL por três níveis de registo, um MR4 a uma queda por quatro níveis de registo, etc.
A medição da carga de BCR-ABL em função do tempo da terapia permite uma avaliação da resposta e, se necessário, a mudança de terapia em caso de resistência terapêutica [1]. No caso de resistência, comorbidades ou intolerância, inibidores de Abl como o bosutinib ou o ponatinib estão disponíveis como alternativas de tratamento, para além das terapias de primeira linha.
O transplante alogénico de células estaminais (allo-SCT) é uma opção de tratamento que normalmente só é indicada em pacientes com CML avançada ou CML refractária a múltiplas TKIs.
Interferon alfa (IFN)
A monoterapia IFN não é muito eficaz em doentes com LMC.
Em contraste, a terapia combinada de imatinibe ou um TKI de segunda geração (nilotinibe, dasatinibe) com interferão alfa peguilado (IFN) é altamente eficaz. A RM profunda é alcançada mais rapidamente e em significativamente mais pacientes com a combinação do que apenas com TKI [3–5]. Em estudos não controlados, a terapia de manutenção IFN após terapia combinada anterior também induziu uma elevada taxa de TFR [6,7].
Objectivos terapêuticos na fase crónica
O principal objectivo da terapia TKI em CML é conseguir uma remissão molecular o mais rapidamente possível, que deve estar pelo menos ao alcance de um MMR (MR3). Isto é importante porque a remissão molecular profunda protege contra a progressão da doença e normaliza a sobrevivência global com CML [8–10].
O objectivo terapêutico secundário é a realização rápida de uma RM profunda (por exemplo, no sentido de um MR4, MR4.5 ou MR5), porque isto permite a inclusão em conceitos de descontinuação TKI.
Remissão gratuita de tratamento (“TFR”)
Originalmente, a terapia TKI para CML foi concebida para ser contínua, pois rapidamente se tornou claro que os inibidores de BCR-ABL (imatinib, dasatinib, nilotinib) não podiam erradicar as células estaminais CML [11,12].
Surpreendentemente, relatórios e estudos clínicos subsequentes (STIM, STIM-2, EURO-SKI) mostraram que cerca de 50% dos doentes que foram tratados com imatinib durante muitos anos e que, assim, conseguiram um MR4.5 estável podem parar o imatinib sem sofrer uma recaída molecular (ricochete da carga de BCR-ABL ou perda de um MMR) [13–17].
Até agora, os mecanismos subjacentes a um TFR são mal compreendidos. Por conseguinte, não estão actualmente estabelecidas estratégias terapêuticas comprovadas para aumentar a taxa de TFR. Contudo, assume-se o controlo imunológico das células CML residuais por células T e células NK. Os factores associados a uma taxa de TFR significativamente mais elevada são a duração da pré-terapia imatinibular (mais de 5,8 anos) e a duração de um MR4 (mais de 3,1 anos). O número de células dendríticas plasmocitóides maduras (CD86+pDC) e de células NK maduras é um marcador biológico potencial associado a uma taxa mais elevada de TFR [18,19].
Conceitos para melhorar a taxa TFR
Conseguir a remissão sem tratamento no maior número possível de doentes é o objectivo ambicioso dos actuais conceitos terapêuticos CML de primeira linha (CML-V, Tiger) e estudos de descontinuação (NAUT, ENDURE, INCEPTION).
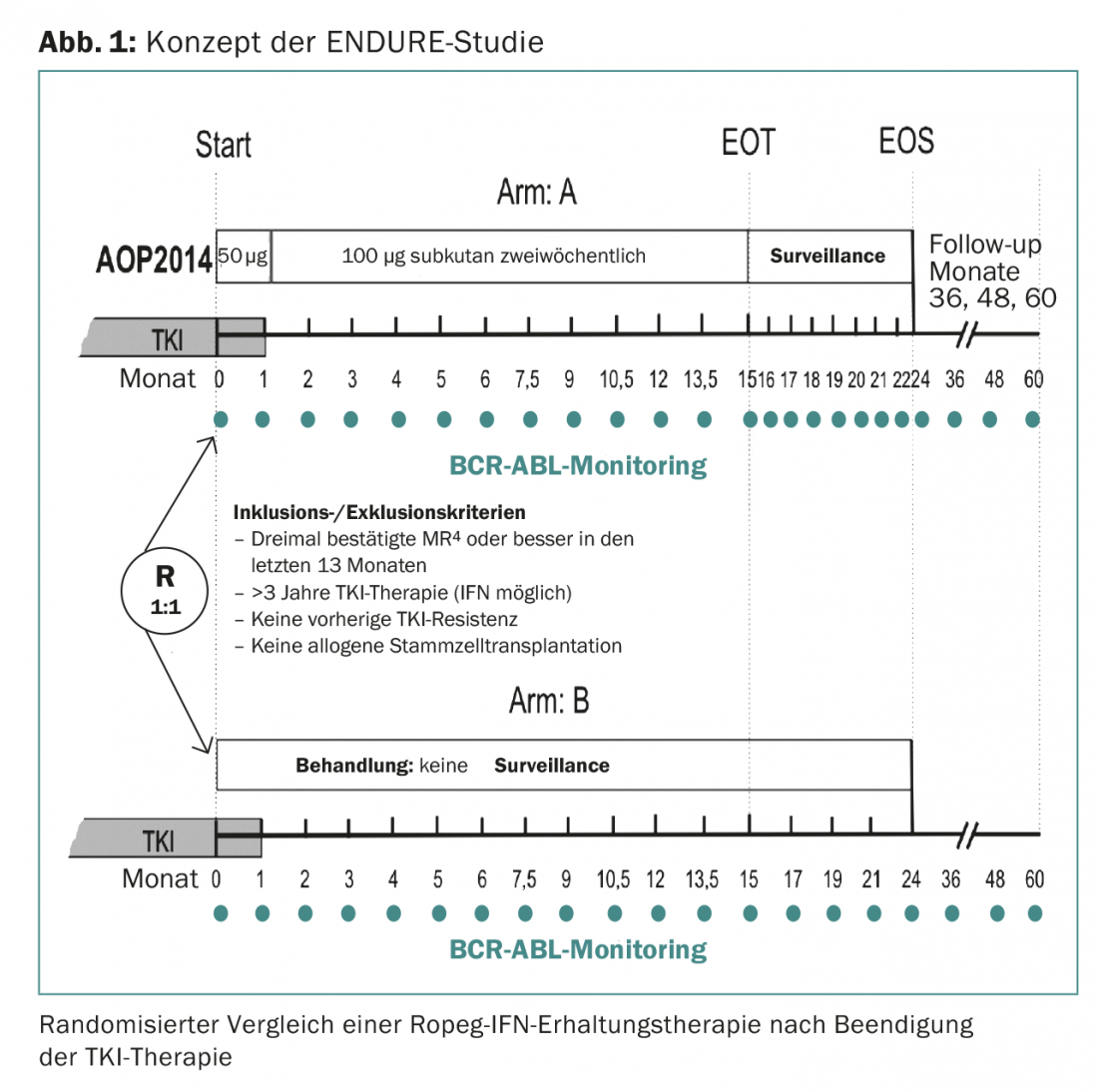
O estudo ENDURE, que terá início em breve em 15 centros na Alemanha, está a testar se uma terapia de manutenção IFN de 15 meses pode reduzir a taxa de recidivas moleculares em 214 pacientes submetidos a RM profunda (pelo menos RM4) (Fig. 1). O IFN utilizado é o Ropeg-IFN (AOP2014). O Ropeg-IFN é um novo IFN com uma meia-vida mais longa e é por isso melhor tolerado do que os IFNs peguilados disponíveis anteriormente. A preparação só precisa de ser injectada de 14 em 14 dias.
Outro conceito terapêutico inovador será em breve testado no estudo INCEPTION. Aqui, os pacientes após a pausa TKI – estratificada pelo fenótipo de células T de exaustão e imunofenótipo pDC – são tratados aleatoriamente com os inibidores de ponto de controlo nivolumab e ipilimumab.
Perspectivas
Com a introdução das TKIs como terapia padrão para a LMC, a sobrevivência com LMC normalizou-se. O objectivo da futura terapia CML é conseguir uma RM profunda e liberdade de tratamento a longo prazo e seguro no maior número de pacientes possível.
Literatura:
- Baccarani M, et al: European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Sangue 2013; 122: 872-884.
- Cross NCP, et al: Recomendações laboratoriais para a pontuação de respostas moleculares profundas após tratamento para a leucemia mielóide crónica. Leucemia 2015; 29: 999-1003.
- Simonsson B, et al: A combinação de IFN-α2b peguilado com imatinibe aumenta as taxas de resposta molecular em doentes com leucemia mielóide crónica de baixo ou médio risco. Sangue 2011; 118: 3228-3235.
- Preudhomme C, et al: Imatinib mais peginterferon alfa-2a em leucemia mielóide crónica. N Engl J Med 2010; 363: 2511-2521.
- Nicolini FE, et al: Nilotinib e peginterferon alfa-2a para leucemia mielóide crónica de fase crónica recentemente diagnosticada (NiloPeg): um estudo multicêntrico, não aleatório, de fase 2 aberta. Lancet Haematology 2015; 2: e37-e46.
- Burchert A, et al.: Resposta molecular sustentada com manutenção de interferon alfa após terapia de indução com imatinib mais interferon alfa em doentes com leucemia mielóide crónica. J Clin Oncol 2010; 28: 1429-1435.
- Burchert A, et al: A terapia de manutenção Interferon alfa 2 (IFN) pode permitir altas taxas de descontinuação do tratamento na leucemia mielóide crónica (LMC). Leucemia 2015; 29: 1331-1335.
- Hehlmann R, et al: Resposta Molecular Profunda é Alcançada pela Maioria dos Pacientes Tratados com Imatinib, Prevê Sobrevivência, e É Alcançada Mais Rapidamente pelo Imatinib de Alta Dose Optimizada: Resultados do Estudo de CML-Estudo IV Aleatório. J Clin Oncol 2014 Fev 10; 32(5): 415-423.
- Hehlmann R, et al: Tolerabilidade-adaptado imatinib 800 mg/d versus 400 mg/d versus 400 mg/d mais interferon-α em leucemia mielóide crónica recentemente diagnosticada. J Clin Oncol 2011; 29: 1634-1642.
- Bower H, et al: Life Expectancy of Patients With Chronic Myeloid Leukemia Approaches the Life Expectancy of the General Population. J Clin Oncol 2016; 34: 2851-2857.
- Graham SM, et al: As células estaminais primitivas, quiescentes, filadelphia-positivas de doentes com leucemia mielóide crónica são insensíveis à STI571 in vitro. Sangue 2002; 99: 319-325.
- Jørgensen HG, et al: Nilotinib exerce efeitos equipotentes antiproliferativos para imatinibir e não induz apoptose nas células CML CD34+. Sangue 2007; 109: 4016-4019.
- Mahon FX, et al: Descontinuação do imatinibe em doentes com leucemia mielóide crónica que tenham mantido uma remissão molecular completa durante pelo menos 2 anos: o ensaio prospectivo, multicêntrico Stop Imatinib (STIM). Lancet Oncol 2010; 11: 1029-1035.
- Rousselot P, et al: Descontinuação do mesilato Imatinib em doentes com leucemia mielóide crónica em remissão molecular completa durante mais de 2 anos. Sangue 2007; 109: 58-60.
- Rousselot P, et al: Perda da resposta molecular principal como gatilho para reiniciar a terapia inibidora da tirosina quinase em doentes com leucemia mielóide crónica de fase crónica que pararam o imatinibe após uma doença indetectável durável. J Clin Oncol 2013; 32: 424-430.
- Ross DM, et al: Segurança e eficácia da cessação da imatinibração para doentes com CML com doença residual mínima estável e indetectável: resultados do estudo TWISTER. Sangue 2013; 122: 515-522.
- Mahon FX, et al: Análise Interina de um Ensaio Pan-Europeu de Inibidores de Tirosina Kinase em Leucemia Mielóide Crónica: O estudo EURO-SKI. Sangue 2014; 124: 151.
- Ilander M, et al: O aumento da proporção de células NK maduras está associado à descontinuação bem sucedida do imatinibe na leucemia mielóide crónica. Leucemia 2016. DOI: 10.1038/leu.2016.360 [Epub ahead of print].
- Schütz C, et al.: A expressão do CTLA-4 ligand CD86 em células dendríticas plasmocitóides (pDC) prevê o risco de recorrência da doença após a interrupção do tratamento em CML. Leucemia 2017. DOI: 10.1038/leu.2017.9 [Epub ahead of print].
InFo ONCOLOGy & HEMATOLOGy 2017; 5(1): 17-19