A cirurgia estereotáxica no tratamento da síndrome de Parkinson idiopática é uma opção terapêutica promissora. Estado da investigação, utilização e princípios básicos dos métodos de estimulação cerebral profunda (DBS) e ultra-som orientado por MR-guia (MRgFUS).
No ano passado, celebrámos o 200º aniversário da primeira descrição da doença de Parkinson por James Parkinson em 1817. É impressionante como a síndrome de Parkinson ainda hoje pode ser diagnosticada com base nos seis casos que descreveu com os seus respectivos sintomas motores e não motores. No entanto, embora tenham sido feitos grandes progressos na investigação da fisiopatologia da síndrome de Parkinson idiopática nas últimas décadas, a causa da doença é ainda desconhecida e a doença é correspondentemente incurável.
Categorização e clínica
Entre as perturbações do movimento, distinguimos as hipercinéticas (tremor, distonia, mioclonus, coréia e carrapato) e as hipocinéticas, sendo o principal representante desta última categoria a síndrome de Parkinson. A síndrome de Motor Parkinson requer a presença de rigor, tremor (tipicamente um tremor em repouso que aumenta com a actividade cognitiva e desaparece quando o movimento é iniciado) e abrandamento geral no sentido de bradicinesia. Nas últimas décadas, porém, tomámos consciência de que tanto os doentes como os familiares sofrem adicionalmente de sintomas não motores. Estes incluem perturbações do olfacto, perturbações do comportamento do sono REM, perturbações autonómicas (disfunção sexual, perturbações da bexiga, flutuações da pressão arterial, queixas gastrointestinais, tais como obstipação e esvaziamento gástrico retardado), bem como queixas psiquiátricas (depressão, alucinações, fadiga, etc.) [1].
1% de todas as pessoas com mais de 60 anos sofrem da síndrome de Parkinson idiopática; na Suíça, mais de 15.000 pessoas são afectadas por esta doença [2]. No entanto, não são de modo algum apenas os mais velhos que desenvolvem a doença, embora a velhice continue a ser o maior factor de risco para a síndrome de Parkinson idiopática. Nas nossas consultas para perturbações do movimento, verificamos que cerca de 10% dos doentes adoecem antes dos quarenta anos de idade.
Diagnóstico
Por razões que ainda não foram explicadas, há uma perda de neurónios dopaminérgicos em particular, que também pode ser objectivada pela medicina nuclear utilizando DaTSCAN-SPECT no sentido de um défice pré-sináptico dopaminérgico. No entanto, em regra, o diagnóstico deve ser feito unicamente com base na neurologia clínica e na anamnese, e depois de descartadas outras causas. No momento da manifestação da síndrome de Parkinson motor, mais de 50% das células dopaminérgicas já pereceram.
Diagnósticos diferenciais importantes da síndrome de Parkinson idiopática são síndromes atípicas de Parkinson, tais como a atrofia multissistémica (aqui há provas adicionais de envolvimento de outros sistemas neurológicos, por exemplo, na forma de síndrome do tracto piramidal, síndrome cerebelar e distúrbios autónomos precoces) e a paralisia progressiva do olhar supranuclear (PSP) com os seus vários subtipos. A degeneração corticobasal também deve ser considerada como um diagnóstico diferencial. Se a síndrome de Parkinson idiopática e a atrofia multisistémica forem alfa-sinucleinopatias, a PSP ou a degeneração corticobasal é neuropatologicamente baseada na tauopatia. O importante diagnóstico diferencial é também parkinsonoide induzido por drogas causadas por terapia neuroléptica ou hidrocefalia de pressão normal. As síndromes de Parkinson como resultado de envenenamento por manganês, como descrito acima em politoxicomania, ainda não ocorreram na Suíça. Em pacientes mais jovens, a doença de Wilson deve ser excluída como uma condição tratável.
Terapia com medicamentos
O padrão ouro da terapia continua a ser a terapia medicamentosa, especialmente através da administração de L-dopa nas suas variantes farmacológicas e sempre em combinação com um inibidor de descarboxilase para prevenir a degradação prematura na periferia. Os agonistas da dopamina como o pramipexole, rotigotina ou ropinirole são também utilizados com sucesso, mas não são tão eficazes como a própria L-dopa. São também utilizados inibidores COMT (entacapone, tolcapone) e inibidores da MAO-B (rasagilina ou safinamida). Raramente utilizados são anticolinérgicos, que tendem a causar delírios no chão da doença neurodegenerativa. Em situações de crise, a amantadina intravenosa pode ser administrada. Como regra geral, os pacientes antes dos setenta anos de idade são principalmente iniciados na terapia agonista com dopamina, e os pacientes com mais de setenta anos de idade são principalmente iniciados em L-dopa. Em princípio, contudo, a qualidade de vida do paciente deve estar em primeiro plano. Se não for possível obter melhorias clínicas suficientes com a administração de um agonista dopaminérgico, mudamos generosamente para a terapia mais eficaz sob a forma de L-dopa. Os efeitos secundários importantes são inicialmente náuseas, distúrbios circulatórios, edema das pernas (principalmente devido a agonistas dopaministas), fadiga e efeitos secundários psiquiátricos, tais como alucinações. O perigo de distúrbios de controlo de impulsos deve ser realçado. Por vezes pode ocorrer dependência do jogo, hipersexualidade, aumento das compras e actividades repetitivas compulsivas. Este grave efeito secundário pode dividir as famílias, pelo que é dever de todo o médico que prescreve estes medicamentos perguntar também sobre esta forma de efeito secundário. No início, os doentes com síndrome de Parkinson idiopática respondem muito bem à terapia, de modo que se pode falar de uma fase de “lua-de-mel”, que, no entanto, pode transformar-se num “paraíso perdido” ao longo do tempo. O bom efeito inicial muda. Há flutuações de efeito ao longo do dia, um atraso ou ausência “on”, discinesias induzidas por L-dopa, distonia como síndrome de deficiência de L-dopa (tipicamente de manhã) ou também efeitos secundários psiquiátricos. O mais tardar nesta situação, deve ser considerada a possibilidade de intervir em terapias. Por um lado, há a possibilidade de uma bomba apomorfina. Aqui, a apomorfina é continuamente aplicada de forma subcutânea através de um sistema de bomba. A apomorfina é o mais potente agonista da dopamina, mas só pode ser administrada por via parenteral. Outra alternativa é a infusão contínua intrajejunal de L-dopa. Devido à estimulação dopaminérgica contínua, há uma diminuição das flutuações de efeito e uma melhoria das discinesias induzidas por L-dopa com ambas as terapias [2].
Estimulação profunda do cérebro (DBS)
Outras possíveis terapias invasivas disponíveis incluem a cirurgia estereotáxica como a estimulação cerebral profunda (DBS) e, mais recentemente, a ultra-sonografia orientada por RM (MFgFUS). Nos anos 80, neurologistas e neurocirurgiões de França, mas também da Suíça, tentaram estabelecer este novo método. É justo dizer que este é o maior passo terapêutico no tratamento da doença de Parkinson desde a introdução da L-dopa nos anos 60.
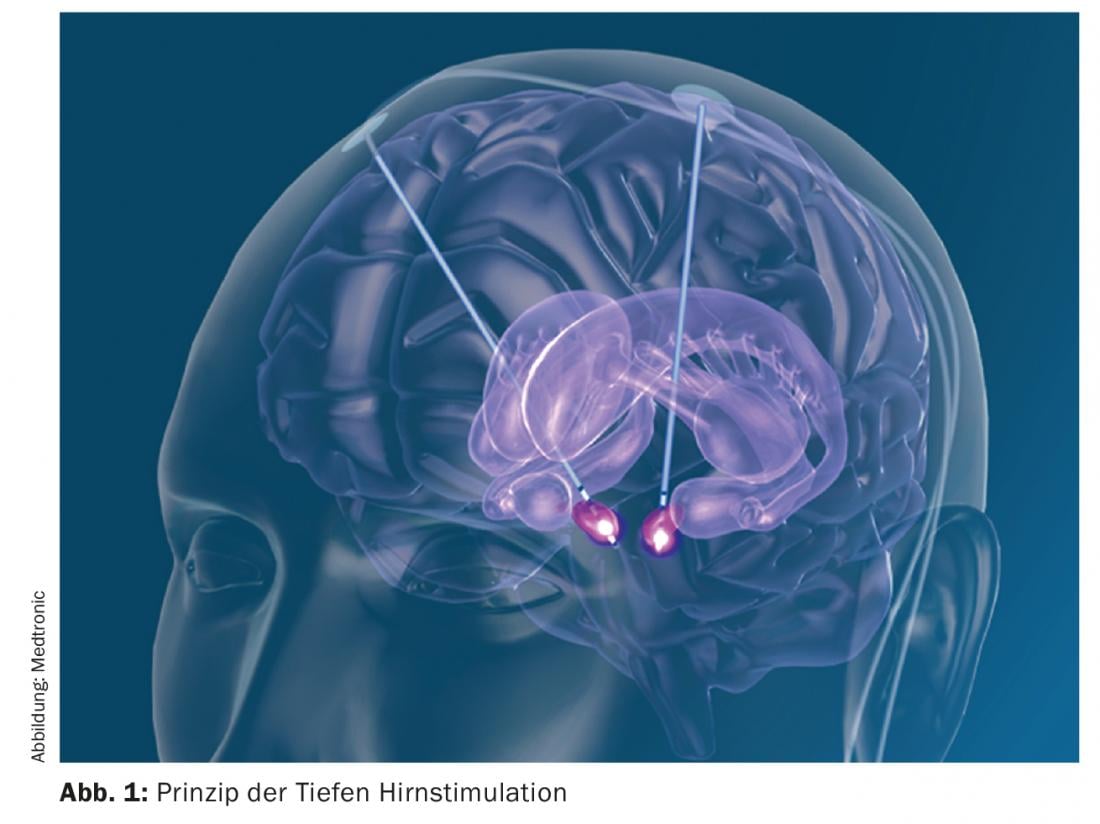
A estimulação cerebral profunda é um método nãoesional no qual os eléctrodos são implantados num ponto-alvo específico como parte de uma operação estereotáxica. Posteriormente, são colocados cabos debaixo da pele e é implantado um neuroestimulador subclavicular ou abdominal. Os parâmetros que permitem a realização da neuroestimulação podem ser definidos externamente (Fig. 1) . Deve salientar-se que a neuroestimulação não destrói nenhum tecido, mas apenas o desactiva funcionalmente. Os alvos típicos no tratamento da doença de Parkinson são o núcleo subthalâmico (STN), o globus pallidus internus (Gpi) ou certas áreas nucleares do tálamo. Tanto a STN como o Gpi causam uma melhoria em todos os sintomas cardinais de Parkinson (rigor, bradicinesia e tremor). No caso da neuroestimulação da STN, é possível reduzir a terapia dopaminérgica para cerca de metade e assim melhorar as discinesias induzidas pela L-dopa. A neuroestimulação no núcleo ventralis intermedius Thalami (Vim) leva a uma redução do tremor sem afectar os outros sintomas cardinais. Durante a cirurgia estereotáxica, o paciente, que normalmente está acordado, é fixado num sistema de armação estereotáxica para permitir a implantação dos eléctrodos com uma precisão milimétrica. Com preparação cuidadosa e selecção de pacientes, é um procedimento cirúrgico com comparativamente poucos efeitos secundários [3]. Os possíveis efeitos secundários relacionados com a cirurgia são hemorragias intracranianas, infecções e erosões cutâneas, o desencadeamento de crises epilépticas, o desenvolvimento de uma fístula do líquido cefalorraquidiano ou, no pior dos casos, danos directos no tecido cerebral. No entanto, como a operação pode ser planeada especificamente com software, estes efeitos secundários são inferiores a 3%, dependendo do estudo. Além disso, há possíveis disfunções do sistema neuroestimulador, tais como migração dos eléctrodos, quebra ou mau funcionamento, mas isto também é extremamente raro devido aos sistemas muito fiáveis. Na profundidade do cérebro, importantes sistemas de neurónios correm muito próximos uns dos outros, inclusive nos pontos-alvo de estimulação cerebral profunda. Consequentemente, também podem ocorrer efeitos secundários induzidos pela estimulação. É a arte do neurologista que trata da neurologia encontrar o cenário certo na multiplicidade de cenários possíveis para que o efeito desejado ocorra e sejam evitados efeitos secundários relacionados com a estimulação, tais como perturbações da fala, cãibras da mão contralateral, insensações, etc., o que normalmente é bem feito. Tal como a terapia medicamentosa, a neuroestimulação também pode causar efeitos secundários psiquiátricos. Estes são também muito raros e reversíveis. Como em qualquer cirurgia cerebral, especialmente em pessoas que sofrem de uma doença neurodegenerativa, as síndromes delirantes pós-operatórias são temporariamente possíveis. No entanto, a estimulação directa também pode levar a um certo aumento do impulso e do comportamento hipomaníaco, bem como a hipersexualidade através da co-espelhação de fibras límbicas. Também para reconhecer estes efeitos secundários, é importante envolver os familiares no processo de tratamento desde o início.
Recentemente, também se tornaram disponíveis sistemas de eléctrodos direccionais. Estes tornam possível estimular em direcções específicas e assim evitar ou corrigir os efeitos secundários induzidos pela estimulação.
A selecção cuidadosa dos pacientes como pré-requisito
O método mantém-se de pé e cai com uma cuidadosa selecção de doentes, para a qual os envolvidos devem levar tempo suficiente. Os doentes com síndrome de Parkinson idiopática são particularmente adequados. As síndromes atípicas de Parkinson, anteriormente mencionadas como diagnósticos diferenciais, não respondem de forma comparável ao DBS. Apenas os pacientes que beneficiam de tratamento com L-dopa também experimentarão melhorias com a estimulação cerebral profunda. Isto torna possível prever o efeito terapêutico. Apenas o tremor dos sintomas cardinais não melhora necessariamente com o tratamento com L-dopa, mas é um excelente sintoma alvo para a DBS. Hoje, podemos falar de DBS como uma terapia estabelecida para a síndrome de Parkinson idiopática, o que leva a uma melhoria da actividade diária através da regulação das funções motoras, a uma redução das discinesias induzidas por L-dopa através de uma redução da terapia dopaminérgica diária, e assim a uma melhoria global da qualidade de vida. Estão disponíveis estudos controlados que mostram uma vantagem da DBS sobre uma população de doentes comparável que “apenas” recebe tratamento medicamentoso [3]. Por conseguinte, as possibilidades de DBS devem ser consideradas logo no decurso da doença, uma vez que esta terapia já é indicada quando a indicação correspondente está presente (flutuações de efeito, discinesias) [4].
Ultra-som orientado por MR (MRgFUS)
Além da DBS como procedimento de terapia estereotáxica nãoesional, também existem procedimentos estereotáxicos lesionais. Contudo, devido à sua irreversibilidade, estas tornaram-se menos importantes do que a DBS nas últimas décadas. Ablação por radiofrequência, radiocirurgia com faca gama e, mais recentemente, ultra-som orientado por MR-guia (MRgFUS) estão disponíveis [5].
Graças a um processamento técnico da energia sonora, a técnica de ultra-sons, de outro modo diagnosticada, pode ser utilizada para lesões milimétricas sem ter de abrir a tampa do crânio. O sistema contém mais de 1000 fontes de ultra-sons e pode ser integrado numa ressonância magnética 3T (Fig. 2). Apenas o sistema Exablate Neuro da empresa israelita InSightec está aprovado para uso clínico. Antes do procedimento, a cabeça do paciente é completamente raspada para assegurar a transmissão adequada da energia ultra-sónica. No centro de RM, a armação estereotáxica é colocada sob anestesia local e o paciente é fixado no sofá de tratamento utilizando a armação estereotáxica, da mesma forma que para a DBS. O sistema de neurotratamento Exablate é montado sobre este, que é integrado num sistema de ressonância magnética 3T. Todo o procedimento é realizado no paciente acordado e é acompanhado por uma equipa de anestesiologia. De acordo com a nossa experiência, a terapia da dor em pacientes acordados durante operações de DBS é realizada, se possível, apenas com remifentanil, a fim de não influenciar os sintomas alvo.

O espaço entre o transdutor hemisférico e o couro cabeludo do paciente é preenchido com água desgaseificada a 16°C, que circula para transmitir som e arrefecer o couro cabeludo localmente; uma membrana de silicone é usada para o selar ao couro cabeludo do paciente. A seguir, as actuais sequências de ressonância magnética são fundidas com sequências de planeamento previamente preparadas. O ponto alvo é determinado neurosurgicamente e neurorradiologicamente com a inclusão de atlas estereotáxicos e em alvos directos baseados na anatomia individual do paciente. No início da intervenção propriamente dita, as sonicações (sonicações) com baixa energia de sonicação são realizadas durante dez segundos de cada vez. Entre as sonicações, o neurologista efectua um teste clínico do sintoma alvo e dos possíveis efeitos secundários. Durante cada sonicação, a evolução da temperatura no voxel alvo e a sua localização de acordo com o plano é monitorizada na consola de controlo utilizando as sequências de ressonância magnética correspondentes. Juntamente com o feedback clínico do neurologista, é importante verificar a energia sonora e a duração antes de a aumentar gradualmente. 30’000 J acima do máximo. 30 segundos) e assim o aumento da temperatura, é possível uma correcção da energia sonora, bem como a posição do ponto-alvo. Desta forma, a temperatura alvo de 56-60°C, que provoca a coagulação irreversível do tecido, é atingida gradualmente e de forma controlada. Este procedimento permite o teste seguro do efeito clínico e dos possíveis efeitos secundários, bem como o ajustamento do ponto-alvo antes da ablação final e irreversível.
Imediatamente após atingir um limiar de temperatura entre 48-55°C, é evidente um efeito anatómico, bem como clínico, com base no qual o procedimento posterior pode ser planeado. Dependendo da resposta clínica ao sintoma alvo, da evidência morfológica da imagem da extensão de uma lesão no local alvo, bem como da documentação da temperatura alvo atingida, é tomada uma decisão interdisciplinar quando se deve terminar a terapia [6].
Uma vantagem do MRgFUS é que o ponto-alvo pode ser planeado durante a intervenção na RM e também directamente verificado quanto a efeitos secundários ou o efeito terapêutico pode ser monitorizado. A abertura do crânio não é necessária e o risco de infecção é, portanto, insignificante. A lesão colocada com MRgFUS atinge um tamanho máximo após cerca de 72 horas e depois, de acordo com a nossa experiência, regressa em seis meses a um ano de tal forma que a lesão quase já não é detectável na ressonância magnética. Isto é uma vantagem sobre outras lesões, algumas das quais têm sido descritas como tendo aumentado de tamanho ao longo do tempo.
Existem vários alvos anatómicos definidos na região subtalâmica posterior que são candidatos a tratamento estereotáxico, seja com DBS ou com um procedimento lesional. O ponto-alvo a escolher depende da doença subjacente. Na nossa experiência, não só a síndrome de Parkinson idiopática mas também o tremor essencial ou distónico pode ser uma indicação para o tratamento com MRgFUS. Em 2016, foi realizado um ensaio randomizado e controlado por simulacro, que mostrou uma clara vantagem do grupo de doentes tratados em relação aos doentes tratados por simulacro no que diz respeito à redução de tremores [7]. Em geral, o tremor parece ser um sintoma alvo particularmente bom para o tratamento com MRgFUS. O efeito de redução do tremor também se mostrou estável no estudo de seguimento após dois anos. Nós próprios tivemos uma boa experiência com pacientes que sofrem de síndrome do tremor essencial. Utilizámos o tracto cerebello-talâmico (Fasciculus cerebello thalamicus, FCT) como ponto alvo, o que resultou em mais de 80% de melhoria dos sintomas [8]. Até agora, a intervenção tem sido realizada apenas unilateralmente no nosso centro para evitar possíveis efeitos secundários bilaterais. Após a intervenção, alguns dos pacientes mostraram uma ligeira instabilidade transitória da marcha como efeitos secundários e dores de cabeça e uma sensação não específica de vertigens durante a intervenção. Contudo, não foi possível registar quaisquer efeitos secundários a longo prazo, especialmente nenhuma disartrofonia ou disfagia.
Uma selecção cuidadosa dos doentes é essencial para os doentes muito mais gravemente afectados e frequentemente mais mórbidos que sofrem da síndrome de Parkinson idiopática avançada. Por vezes há incerteza sobre a estrutura alvo a ser escolhida para uma lesão com MRgFUS. Se o objectivo for a redução do tremor puro, a FCT também pode ser lesionada unilateralmente como um cerebelar aferente ao tálamo nestes pacientes, resultando na redução contralateral do tremor. Contudo, os outros sintomas cardinais, tais como rigor e bradicinesia não são influenciados por isto e não é claro até que ponto existe a possibilidade de reduzir a medicação pós-intervenção, a fim de evitar também as discinesias induzidas pela L-dopa.
No nosso centro, também conseguimos ganhar experiência com o tratamento de doentes com Parkinson. A maioria destes eram pacientes que não eram elegíveis para DBS com eléctrodos por várias razões. Nestes pacientes, escolhemos o tracto palido-talâmico (PTT) como o ponto alvo. Estas são fibras do pálido que convergem para o tálamo e são assim facilmente acessíveis ao tratamento lesional. Também neste caso, experimentámos, em particular, as síndromes dominantes do tremor, que sofreram uma melhoria significativa que durou vários anos. Além disso, alguns pacientes registaram uma melhoria na bradicinesia e no rigor, de modo que também se pode esperar uma melhoria de outros sintomas cardinais. No entanto, para poder avaliar isto no curso, é ainda necessária mais experiência no âmbito de estudos clínicos e observações a longo prazo no âmbito de um estudo em curso no nosso centro [8].
Recentemente, um grupo de investigação de Madrid utilizou MRgFUS em doentes com síndrome de Parkinson idiopática gravemente assimétrica, visando o núcleo subtalâmico da lesão. O objectivo era, portanto, o mesmo ponto-alvo que no DBS acima descrito. De acordo com os dados disponíveis até agora, houve também aqui uma melhoria da síndrome contralateral de Parkinson, sem qualquer hipercinesia relacionada com lesões [9].
Globalmente, pode afirmar-se que o tratamento com MRgFUS é uma opção terapêutica nova e muito promissora para as perturbações do movimento no futuro. Trata-se de um procedimento lesional e, portanto, irreversível. Contudo, a intervenção em si é não invasiva e alguns efeitos secundários relacionados com a segurança que conhecemos no DBS não desempenham um papel neste procedimento. Nas doenças neurodegenerativas progressivas como a síndrome de Parkinson idiopática, não é possível adaptar o efeito conseguido pela terapia à progressão da doença, uma vez que aqui seria necessária uma nova lesão.
No entanto, em comparação com o grande corpo de experiência em DBS disponível através de ensaios controlados, ainda não foi adquirida mais experiência com esta terapia.
Conclusão
A cirurgia estereotáxica no tratamento da doença de Parkinson idiopática e outras perturbações do movimento é uma opção de tratamento invasiva mas promissora. Esta oferta deve ser disponibilizada aos nossos pacientes numa fase avançada e depois de esgotadas todas as opções de terapia medicamentosa. Com uma cuidadosa selecção de doentes e esclarecimento preliminar, os procedimentos têm comparativamente poucos efeitos secundários.
Mensagens Take-Home
- Embora a terapia medicamentosa continue a ser o padrão de ouro, a cirurgia estereotáxica é uma opção terapêutica promissora no tratamento da doença idiopática de Parkinson.
- A selecção cuidadosa dos pacientes é essencial para o sucesso da terapia.
- A estimulação cerebral profunda (DBS) é um método não lesional de neuroestimulação utilizando eléctrodos implantados.
- A ecografia orientada por MR (MRgFUS) é um procedimento lesional e irreversível. Uma vez que a intervenção não requer a abertura do crânio ou a implantação de material estranho, alguns efeitos secundários relacionados com a cirurgia são eliminados.
- MRgFUS parece ser particularmente bem sucedido em síndromes dominantes por tremores.
Literatura:
- Postuma RB, Berg D: Os Novos Critérios de Diagnóstico da Doença de Parkinson. Int Rev Neurobiol 2017; 132: 55-78.
- Diener HC, et al: Guidelines for Diagnostics and Therapy in Neurology: Publicado pela Comissão de Directrizes da Sociedade Alemã de Neurologia, 5ª edição. Stuttgart 2012.
- Deuschl G, et al: Um ensaio aleatório de estimulação cerebral profunda para a doença de Parkinson. N Engl J Med 2006; 355: 896-908.
- Schuepbach WM, et al: Neurostimulation for Parkinson’s disease with Early Motor Complications. N Engl J Med 2013; 368(7): 610-622.
- Schreglmann SR, et al: neurocirurgia lesional funcional para o tremor: de volta ao futuro? J Neurol Neurosurg Psychiatry 2017; 210: 1-9.
- Schreglmann SR, et al: Ablação focalizada por ultra-sons como tratamento de tremores. Nervenarzt 2018 [Epub ahead of print].
- Elias WJ, et al: A Randomized Trial of Focused Ultrasound Thalamotomy for Essential Tremor. N Engl J Med 2016; 375(8): 730-739.
- Schreglmann SR, et al: Ablação unilateral do tracto cerebelotalâmico em tremor essencial por ultra-sons focalizados guiados por ressonância magnética. Neurologia 2017; 88: 1329-1333.
- Martínez-Fernández R, et al: Subtalamotomia de ultra-sons focalizada em doentes com doença de Parkinson assimétrica: um estudo piloto. Lancet Neurol 2018; 17(1): 54-63.
InFo NEUROLOGIA & PSYCHIATRY 2018; 16(4): 6-10.











