A síndrome do intestino irritável é a desordem funcional mais comum do tracto gastrointestinal. O artigo fornece uma actualização sobre a fisiopatologia, diagnóstico e terapia deste complexo de sintomas.
A síndrome do intestino irritável (SII) é a perturbação funcional mais comum do tracto gastrointestinal com uma prevalência estimada de 7-30% na Europa [1]. A doença representa um complexo de sintomas descrito pelos critérios de Roma IV (Tab. 1) [2]. São descritos três subtipos de acordo com a consistência das fezes: SII tipo Diarreia (IBS-D/IBS-D), SII tipo obstipação (IBS-O/IBS-C) – SII tipo misto (IBS-M/IBS-M).

O diagnóstico é geralmente feito antes dos 50 anos de idade, sendo as mulheres mais frequentemente afectadas do que os homens (2:1). Apenas um quarto de todos os doentes procura tratamento médico, o que significa que o número de casos não notificados é elevado. Os pacientes com SII têm uma qualidade de vida significativamente reduzida em comparação com a população normal, o que causa custos directos consideráveis (visitas médicas, medicação, doenças concomitantes) e custos indirectos (faltas ao trabalho, desempenho reduzido). Das comorbidades, os distúrbios psiquiátricos, especialmente a depressão, são mais comuns em doentes com SII, com até 30% em comparação com 18% da população normal [3]. Há também uma alta associação com doenças como a fibromialgia, enxaqueca e síndrome de fadiga crónica.
Fisiopatologia
A IBS é uma doença complexa multifactorial que, apesar das numerosas descobertas novas nos últimos anos, ainda está longe de ser compreendida (Fig. 1) . O eixo cérebro-estômago envolve a interacção dos sistemas autonómico, neuroendócrino e neuroimunológico com o sistema nervoso central. O tracto gastrintestinal é altamente valorizado e uma multidão de fibras nervosas aferentes gera informação sobre o conteúdo intestinal e processos reguladores da digestão, absorção e defesa imunitária [4]. Na IBS, há provas de que tanto o processamento central desta informação como a resposta aos sinais intestinais são perturbados [5]. A característica comum das doenças funcionais do tracto gastrointestinal é a hipersensibilidade visceral. Os pacientes com SII têm um limiar perceptivo e doloroso inferior aos estímulos intestinais, o que pode promover ainda mais a sensibilização do sistema nervoso central [6]. A causa desta sensibilização é, em última análise, pouco clara. Na SII, as perturbações subtis da motilidade gastrointestinal são também conhecidas, possivelmente como um efeito de hipersensibilidade visceral, que pode levar a um tempo de trânsito prolongado ou acelerado, dependendo da gravidade.
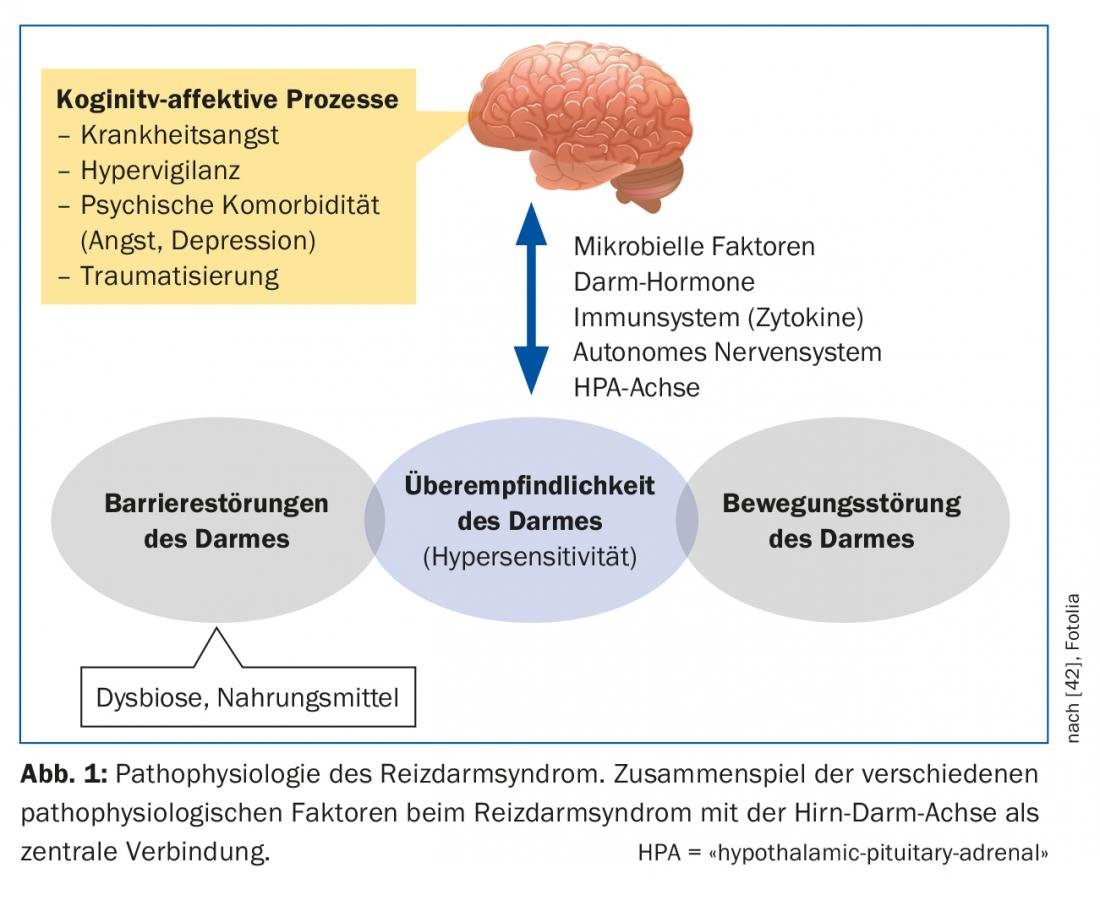
A mucosa do intestino tem uma enorme superfície com a qual estamos em contacto diário com o mundo exterior. Esta interacção pode ser alterada de várias maneiras em pacientes com SII. A chamada barreira intestinal consiste de uma camada singular de ligações celulares (“junções apertadas”). Se não funcionarem correctamente, podem aumentar a permeabilidade intestinal (“leaky gut”). Assim, os antigénios podem penetrar no epitélio e desencadear e manter processos imunológicos ou inflamatórios [7]. O microbioma intestinal também desempenha aqui um papel. É constituída por um grande número de diferentes espécies bacterianas e é parte integrante de muitos processos na área da barreira intestinal. Se o equilíbrio natural for perturbado, há disbiose intestinal, que pode ocorrer por várias razões (por exemplo, terapia antibiótica). Há provas de que os pacientes com SII têm disbiose quantitativa e qualitativa, que pode afectar a função do eixo intestinal-cérebro. Também se discute se a inflamação persistente e de baixo grau da mucosa, por exemplo após infecções gastrointestinais agudas, pode alterar a permeabilidade intestinal. Em estudos individuais, foram encontradas células inflamatórias aumentadas na mucosa de doentes com SII [8].
O papel do stress crónico, especialmente após experiências traumáticas na infância, pode promover a probabilidade de uma reacção exagerada interstinal à dor na idade adulta [9]. O stress também pode influenciar o eixo hipotalâmico do cortisol e assim influenciar os processos inflamatórios na mucosa.
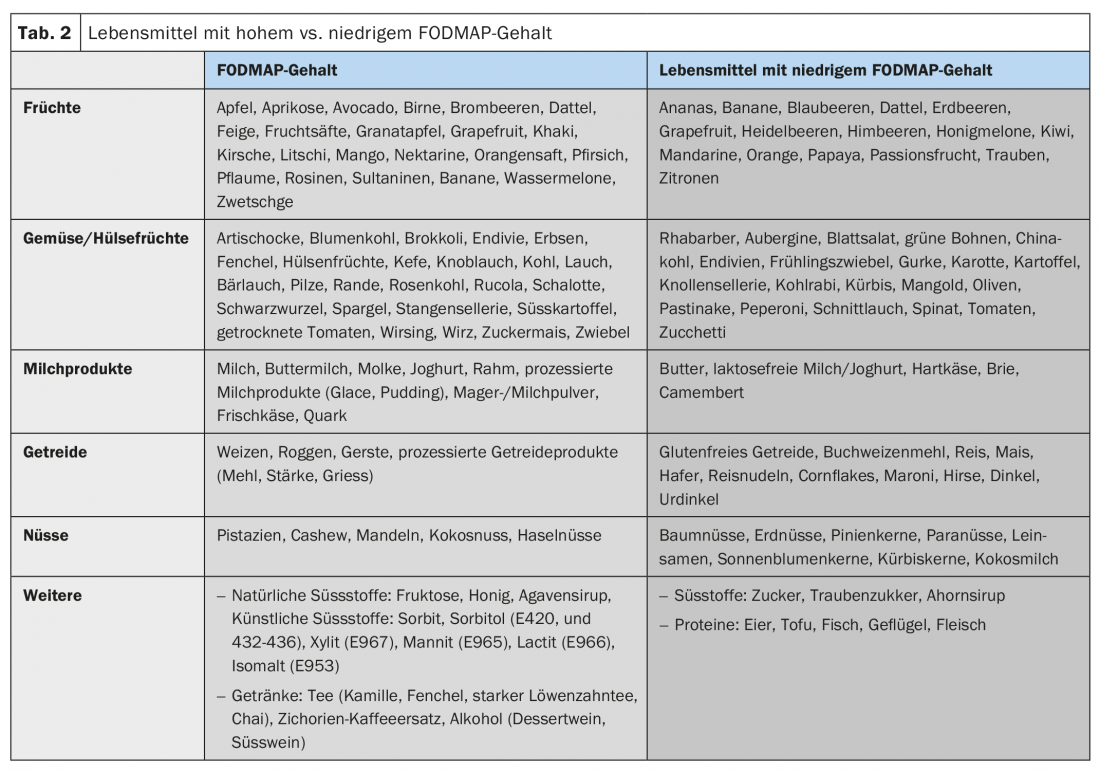
A maioria dos pacientes descreve um aumento dos seus sintomas após as refeições e a maioria dos pacientes sabe quais os alimentos a evitar [10]. Devido aos efeitos osmóticos e à fermentação bacteriana, componentes alimentares pouco absorvíveis em particular, incluindo os chamados FODMAPs (oligo-, di- e monossacáridos e polióis fermentáveis), podem agravar as queixas abdominais relacionadas com a SII (Tab. 2). No entanto, a fermentação destes FODMAPs depende também da composição do microbioma intestinal. Além disso, suspeita-se de interacções bioactivas directas com a mucosa e de activações imunitárias por alimentos. Os factores cognitivos (a antecipação da dor após as refeições) também desempenham aqui um papel.
A IBS funciona em famílias, o que sugere um historial genético para além de factores sociais. Os gémeos monozigóticos são mais susceptíveis de serem afectados pela SII do que os gémeos dizigóticos (33% contra 13%) e uma história familiar positiva é mais comum na SII do que na população normal (33% contra 2%) [11].
Diagnósticos
O SII não é um diagnóstico de exclusão, mas pode ser estabelecido com a ajuda dos critérios de Roma IV e de um número limitado de exames. Se não houver sinais de alarme – idade >50 anos, perda de peso, febre, descarga de sangue ab ano, disfagia, vómitos, febre, anemia, história familiar positiva de tumores colorrectais, doença inflamatória intestinal e doença celíaca – a SII pode ser diagnosticada com boa certeza se os critérios de Roma forem cumpridos [12]. Em apenas 5% de todos os pacientes com SII é uma doença orgânica encontrada durante o curso da doença, mas especialmente no primeiro ano após o aparecimento dos sintomas de SII é importante excluir as doenças sistémicas relevantes [13]. Após a idade de 50 anos, a probabilidade de cancro do cólon após um (suposto) diagnóstico de SII é de 1%, o que é significativamente mais elevado do que a população normal. Nas mulheres, o cancro dos ovários deve ser sempre considerado, uma vez que os sintomas semelhantes aos da SII ocorrem frequentemente como o primeiro sintoma [14].
Nos doentes com RDS-D, recomenda-se a exclusão serológica da doença celíaca e a determinação da transglutaminase IgA e dos anticorpos IgA totais. A prevalência da deficiência de IgA na doença celíaca é 1,7-3%, significativamente mais elevada do que na população geral (0,2%). HLA-DQ2 e -DQ8 não devem ser utilizados como teste de rastreio.
tornar-se.
Até 40% dos doentes com doença inflamatória intestinal também preenchem os critérios da SII, pelo que a inflamação intestinal deve ser excluída com a determinação não invasiva e rentável da calprotectina fecal. O risco de doença inflamatória intestinal com uma calprotectina <40 ug/g é inferior a 1% [15]. A desvantagem é que a calprotectina não é muito específica, razão pela qual devem ser feitos mais esclarecimentos se os valores forem elevados.
Na presença de sintomas típicos de SII sem sinais de alarme, a probabilidade de cancro do cólon ou doença inflamatória intestinal é de cerca de 1%, pelo que as directrizes americanas recomendam a colonoscopia apenas em doentes com mais de 50 anos [16]. As directrizes europeias recomendam a colonoscopia para RDS-D mesmo antes dos 50 anos de idade, especialmente para excluir a colite microscópica [17].
Em casos que permanecem pouco claros, investigações laboratoriais mais extensas podem ser úteis: Marcadores inflamatórios sistémicos (CRP, hemograma diferenciado), parâmetros de má absorção (estado do ferro, vitamina, albumina), TSH, elastase pancreática nas fezes, teste de respiração da lactose H2, parasitologia das fezes).
Um exame ultra-sonográfico na avaliação inicial das queixas abdominais para excluir patologia grosseira é normalmente realizado porque está prontamente disponível e é pouco dispendioso. Contudo, não há provas positivas sobre o benefício no diagnóstico da SII.
Em resumo, o diagnóstico da SII baseia-se em quatro factores: história, exame físico, um número limitado de testes laboratoriais e endoscopia em casos seleccionados. Além disso, o exame ginecológico nas mulheres deve ser mencionado.
Terapia
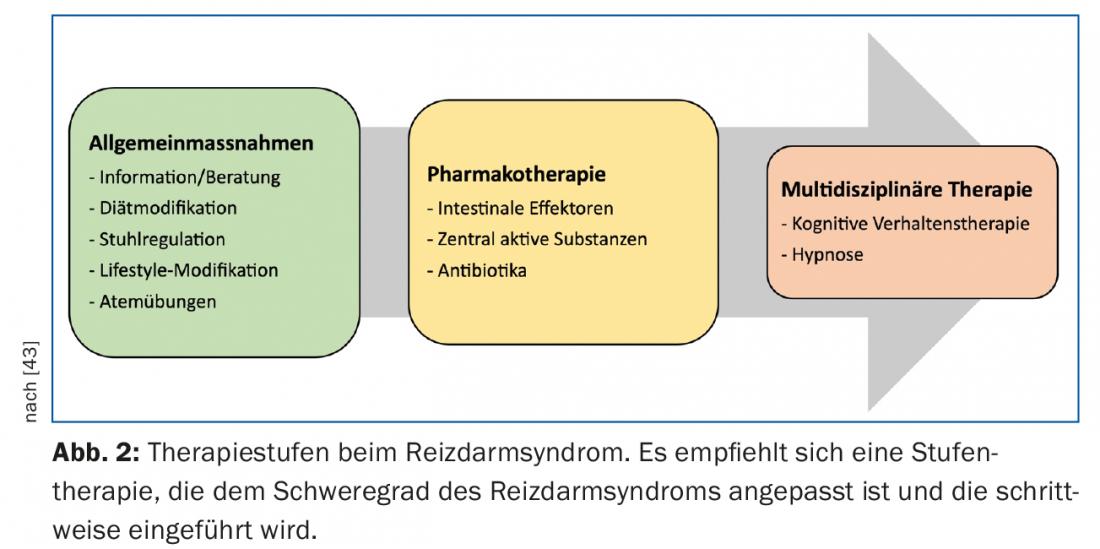
No tratamento da SII, recomenda-se uma abordagem por etapas, tendo em conta a gravidade dos sintomas descritos (Fig. 2) . A maioria dos pacientes pode ser gerida com sucesso no consultório do médico de família. Apenas uma pequena proporção com um curso difícil e refractário da doença beneficia dos cuidados de uma consulta especializada em gastroenterologia.
Um componente central no tratamento da SII é uma relação médico-paciente estável e intacta. Os pacientes com SII queixam-se frequentemente de falta de empatia e compreensão pelos sintomas que descrevem, o que, para além de queixas persistentes, leva também a repetidas consultas, pedidos de esclarecimento e, não raro, também a mudanças regulares de médico. A terapia de base consiste num diagnóstico detalhado, com uma explicação compreensível e orientada para o paciente sobre a fisiopatologia e as opções terapêuticas sem terminologia médica. A autenticidade das queixas tem de ser levada a sério pelo paciente e os receios têm de ser levados a sério. É especialmente importante perguntar sobre a compreensão da doença e as expectativas, mas ao mesmo tempo devem ser estabelecidos objectivos realistas (“não é possível uma certeza de diagnóstico a 100%”). Os pacientes precisam de ser envolvidos nas decisões de tratamento, para que a satisfação/qualidade de vida e a progressão da doença possam ser positivamente influenciadas.
Modificação da dieta: A maioria dos pacientes já relatou no passado, durante a consulta inicial, auto-testes com dietas de exclusão, mas um ajustamento estruturado da dieta é frequentemente o primeiro passo no tratamento dos sintomas da SII. Os componentes alimentares osmoticamente pouco absorvíveis, especialmente os chamados FODMAPs, desempenham aqui um papel. A eficácia de uma dieta pobre em FODMAP na SII tem sido demonstrada em vários estudos (cerca de 70% de resposta clínica), razão pela qual as modificações dietéticas devem ser sempre uma das primeiras etapas terapêuticas na SII [18]. Uma dieta estagiária e sem glúten por si só não pode ser recomendada de acordo com os dados actuais.
Terapia analgésica: Os espasmolíticos anticolinérgicos são muito frequentemente utilizados na SII, embora as provas sobre o efeito destes medicamentos sejam fracas [19]. Na Suíça, são principalmente utilizadas as seguintes substâncias: Butilscopalamina (Buscopan®), Mebeverina (Duspatalin®), Brometo de Pinaverina (Dicetel®), Trimebutina (Debridat®) e Metixen (Spasmocanulase®). Possíveis efeitos secundários podem incluir boca seca e distúrbios visuais.
Os fitoterápicos são bem aceites pelos doentes; o mais utilizado na Suíça é o Iberogast®, uma mistura à base de álcool de nove extractos de plantas. Um ensaio aleatório, controlado por placebo, mostrou uma melhoria significativa na dor abdominal associada à SCI [20]. Foi também demonstrada uma redução significativa dos sintomas de SII para as cápsulas de óleo de hortelã-pimenta frequentemente utilizadas (Colpermin®) [21,22]. Aqui, o efeito é provavelmente multifactorial, incluindo efeitos antagonistas nos canais de cálcio (relaxamento muscular) e efeitos agonizantes nos receptores de opiáceos. Outra preparação é o concentrado de alcachofra Hepa-S®, mas aqui os dados limitados não mostram nenhum benefício definido [23].
Antidepressivos como os inibidores da recaptação de serotonina (SSRIs) e os antidepressivos tricíclicos destinam-se a corrigir um défice serotonérgico com um efeito no eixo do cérebro intestinal. Numa Cochrane Review [24], foram alcançados efeitos positivos tanto no bem-estar geral como especificamente nas queixas abdominais (número necessário para tratar (NNT) = 4 resp. 5). Contudo, os pacientes com SII sem depressão como comorbidade não parecem beneficiar de terapia com SSRIs.
Tratamento da SII com obstipação: A utilização de agentes de volume como Sterculia (Colosan®, Normacol®) e psyllium/flaxseed (Metamucil®, Mucilar®, Linomed®) ou de laxantes isoosmóticos à base de polietilenoglicol (Transipeg®, Movicol®) pode melhorar a frequência e a consistência das fezes, mas estas preparações não têm qualquer efeito na dor ou flatulência abdominal associada à SII [19]. Os laxantes estimulantes devem ser evitados devido à fraca tolerância.
Linaclotide (Constella®) é um agonista da guanilato ciclase que actua localmente no intestino e é aprovado para o tratamento da SII com obstipação. A acção do receptor local leva à activação de canais iónicos no intestino e, portanto, à secreção de cloreto, bicarbonato e água para o lúmen intestinal. Além disso, há também um efeito analgésico sobre os nociceptores do intestino. Linaclotide aumenta significativamente o número de defecações completas e reduz o número e a gravidade da dor abdominal [25,26].
Lubiprostone (Amitiza®) é um activador do canal do cloro que actua localmente no intestino e é aprovado na Suíça para o tratamento da obstipação crónica idiopática e da obstipação induzida por opiáceos. Em doses mais baixas, o medicamento também é aprovado nos EUA e Japão para a SII-O, onde tem mostrado bons resultados nos sintomas da SII (dor, inchaço) [27].
O Prucalopride (Resolor®) é um agonista receptor selectivo de serotonina de alta afinidade (5-HT4) aprovado na Suíça para o tratamento da obstipação crónica idiopática. Existem dados para utilização em SII-O que mostraram um efeito positivo nos sintomas de SII [28].
Tratamento da SII com diarreia: A Loperamida (Imodium®) é frequentemente utilizada na SII-D para regular as fezes, mas não tem qualquer efeito nos sintomas de dor. Em combinação com um agente de inchaço, o efeito anti-diarreico pode ser melhorado. Para o tratamento da diarreia, a colestiramina aglutinante de ácido biliar (Quantalan®) também pode ser utilizada a título experimental, uma vez que cerca de 25% de todos os doentes com SII-D apresentam provas de uma síndrome de perda de ácido biliar [29]. Em estudos não randomizados, foi demonstrado que a colestiramina reduz a frequência das fezes e o desconforto abdominal [30].
Eluxadolina (Truberzi®) é um agonista dos receptores de μ-opioides e κ-opioides e antagonista dos receptores de δ-opioides que actuam localmente no intestino e, portanto, tem propriedades anti-diarreicas e analgésicas. Em Fevereiro de 2018, o medicamento foi aprovado pelo Swissmedic para o tratamento da IBS-D, mas ainda não está disponível na Suíça. Num ensaio aleatório, Truberzi mostrou um melhor controlo da dor e da diarreia do que placebo após 12 semanas de terapia durante o período subsequente de 1 ano [31]. Isto também se aplicava a doentes que tinham sido previamente tratados com a loperamida μ-opioid receptor [32].
Ondansetron (Zofran®) é um antagonista dos receptores de serotonina (5-HT3) aprovado na Suíça para o tratamento de náuseas associadas à quimioterapia. Em doentes com SII-D, observou-se também um abrandamento do peristaltismo intestinal e uma redução da hipersensibilidade visceral e da dor abdominal [33]. Estão previstos outros estudos para confirmar estes resultados promissores.
O Rifaximin (Xifaxan®) é um antibiótico específico do intestino que é aprovado na Suíça para a prevenção de recaídas na encefalopatia hepática. Nos EUA, o medicamento também pode ser utilizado para o tratamento da IBS-D. A Rifaximin demonstrou ter um efeito positivo nos sintomas de SII durante as próximas dez semanas após duas semanas de terapia (8-10% mais frequentemente do que placebo) [34]. A terapia antibiótica parece levar a uma mudança positiva no microbioma intestinal, mas os mecanismos exactos não são claros. Se necessário, o ciclo terapêutico pode ser repetido como desejado. As preocupações iniciais sobre o desenvolvimento da resistência não foram confirmadas, e o perfil de efeitos secundários é baixo.
As provas para o uso de probióticos na SII não são conclusivas, os estudos são heterogéneos, com resultados positivos na maioria dos estudos mais pequenos. Lactobacillus spec., Bifidobacterius spec. e Saccharomyces boulardii parecem ter os melhores resultados. Numa recente revisão sistemática, os probióticos demonstraram ser eficazes em certos pacientes com síndrome do cólon irritável. [35].
Terapias não-farmacológicas: Parece haver algum benefício para a terapia cognitiva comportamental e hipnose no tratamento da SII, mas ainda não está claro se a melhoria dos sintomas da SII está relacionada com uma redução eficaz da dor visceral ou simplesmente reflecte um melhor processamento da dor. Em duas análises da Cochrane em 2009, o efeito destas terapias foi avaliado cautelosamente [36,37]. Numa recente revisão sistemática, o efeito destas terapias foi avaliado positivamente, mas a forma de contacto, duração do tratamento e tipo de comunicação ainda não está claramente definida [38].
Tratamento da SII com sintomas de inchaço: O inchaço com ou sem um aumento visível da circunferência abdominal é uma característica de várias doenças funcionais do tracto gastrointestinal e é frequentemente considerado muito incómodo pelos pacientes. Para além das modificações dietéticas (dieta baixa de FODMAP) e do uso de rifaximin, existem poucas opções terapêuticas. Não há provas da utilização de substâncias desespumantes como o simeticone (Flatulex®) ou o dimeticone (Spasmocanulase®) para queixas de flatulência causadas funcionalmente. A sua utilidade é, na sua maioria, decepcionante. Vários estudos elegantes demonstraram que a flatulência em pacientes com SII não é causada por um aumento do volume de gás intestinal, mas por deslocamentos cautelosos e centrais do conteúdo intra-abdominal. Pelo contrário, devido a um reflexo viscero-somático, há uma reacção muscular anormal do diafragma (contracção) e dos músculos abdominais inferiores (relaxamento), resultando na protrusão do abdómen [39]. O mesmo grupo de investigação conseguiu então alcançar uma redução significativa dos sintomas e também da circunferência abdominal em doentes com SII com sintomas agudos de inchaço, com a ajuda de terapia respiratória específica de biofeedback-assisted [40]. Num ensaio aleatório subsequente, os sintomas de flatulência continuaram a diminuir com exercício regular durante um período de observação de seis meses [41].
Resumo
A síndrome do intestino irritável continua a ser um complexo sintomático que só agora começa a ser compreendido, e as opções de tratamento ainda são limitadas. Com a crescente compreensão da fisiopatologia, será provavelmente possível caracterizar outros subtipos no pote actualmente muito heterogéneo de doenças intestinais funcionais. Não com base em sintomas clínicos, como os critérios de Roma IV tentam fazer hoje, mas com a ajuda de biomarcadores que permitirão, na melhor das hipóteses, um diagnóstico positivo deste quadro clínico no futuro. Uma melhor compreensão da fisiopatologia conduziria então inevitavelmente ao desenvolvimento de novas abordagens terapêuticas que vão para além do actual tratamento puramente orientado para os sintomas.
Mensagens Take-Home
- A síndrome do intestino irritável não é um diagnóstico de exclusão, mas pode ser estabelecida com a ajuda dos critérios de Roma IV e de um número limitado de exames.
- O tratamento da SII baseia-se numa abordagem gradual, tendo em conta a severidade.
- As modificações dietéticas, especialmente um FODMAP (oligo-, di- e monossacarídeos fermentáveis), e uma dieta pobre em polióis deve ser uma das primeiras etapas terapêuticas.
- Os sintomas de flatulência funcional podem ser aliviados pela fisioterapia e terapia respiratória.
Literatura:
- Saha L: Síndrome do intestino irritável: Patogénese, diagnóstico, tratamento, e medicina baseada em provas. Mundo J Gastroenterol 2014; 20(22): 6759-6773.
- Lacy BE, et al: Perturbações intestinais. Gastroenterologia 2016; 150(6): 1393-1407e5.
- Grundmann O, Yoon SL: Síndrome do intestino irritável: Epidemiologia, diagnóstico e tratamento: Uma actualização para os profissionais de saúde. J Gastroenterol Hepatol 2010; 25(4): 691-699.
- Brookes SJH, Spencer NJ, Costa M, Zagorodnyuk VP: Sinalização primária extrínseca aferente no intestino. Nat Rev Gastroenterol Hepatol 2013; 10(5): 286-296.
- Lee YJ, Park KS: Síndrome do intestino irritável: Paradigma emergente na fisiopatologia. Mundo J Gastroenterol 2014; 20(10): 2456-2469.
- Soares RLS: Síndrome do intestino irritável: Uma revisão clínica. Mundo J Gastroenterol 2014; 20(34): 12144-12160.
- Matricon J, et al.: Artigo de revisão: Associações entre activação imunitária, permeabilidade intestinal e a síndrome do cólon irritável. Aliment Pharmacol Ther 2012; 36(11-12): 1009-1031.
- Katiraei P, Bultron G: Necessidade de uma abordagem médica abrangente à neuro-imuno-gastroenterologia da síndrome do intestino irritável. Mundo J Gastroenterol 2011; 17(23): 2791-27800.
- Larauche M, Mulak A, Taché Y: Alterações da sensação visceral relacionadas com o stress: modelos animais para estudo da síndrome do intestino irritável. J Neurogastroenterol Motil 2011; 17(3): 213-234.
- Heizer WD, Southern S, McGovern S: The Role of Diet in Symptoms of Irritable Bowel Syndrome in Adults: A Narrative Review. J Am Diet Assoc 2009; 109(7): 1204-1214.
- El-Salhy M: Síndrome do intestino irritável: Diagnóstico e patogénese. Mundo J Gastroenterol 2012; 18(37): 5151-5163.
- Whitehead WE, Palsson OS, Simrén M: Síndrome do intestino irritável: o que significam as novas directrizes de diagnóstico Roma IV para a gestão de doentes? Perito Rev Gastroenterol Hepatol 2017; 11(4): 281-283.
- El-Serag HB, Pilgrim P, Schoenfeld P: Revisão sistemática: História natural da síndrome do cólon irritável. Aliment Pharmacol Ther 2004; 19(8): 861-870.
- Hamilton W, Peters TJ, Bankhead C, Sharp D: Risco de cancro dos ovários em mulheres com sintomas nos cuidados primários: Estudo de caso-controlo baseado na população. BMJ 2009; 339(7721): 616.
- Menees SB, et al: Uma meta-análise da utilidade da proteína C-reactiva, taxa de sedimentação eritrocitária, calprotectina fecal, e lactoferrina fecal para excluir a doença inflamatória intestinal em adultos com SII. Am J Gastroenterol 2015; 110(3): 444-454.
- AGA: American Gastroenterological Association Medical Position Statement: Irritable Bowel Syndrome. Gastroenerologia 2002; 123(6): 2105-2107.
- Layer P, et al.: S3-Leitlinie Irritable Bowel Syndrome: Definição, Fisiopatologia, Diagnóstico e Terapia. Directriz conjunta da Sociedade Alemã de Doenças Digestivas e Metabólicas (DGVS) e da Sociedade Alemã de Neurogastroenterologia e Motilidade. Journal of Gastroenterol 2011; 49(2): 237-293.
- Halmos EP, et al: A Diet Low in FODMAPs Reduz os Sintomas da Síndrome do Colón Irritável. Gastroenterologia 2014; 146(1): 67-75.
- Ruepert L, et al: Agentes a granel, medicamentos antiespasmódicos e antidepressivos para o tratamento da síndrome do cólon irritável. Cochrane Database Syst Rev 2011; (8): CD003460.
- Madisch A, Holtmann G, Plein K, Hotz J: Tratamento da síndrome do intestino irritável com preparações herbais: Resultados de um ensaio duplo-cego, randomizado, controlado por placebo, multicêntrico. Aliment Pharmacol Ther 2004; 19(3): 271-279.
- Merat S, et al.: O efeito do óleo de hortelã-pimenta com revestimento entérico e de libertação retardada sobre a síndrome do intestino irritável. Dig Dis Sci 2010; 55(5): 1385-1390.
- Khanna R, MacDonald JK, Levesque BG: Óleo de hortelã-pimenta para o tratamento da síndrome do intestino irritável: Uma revisão sistemática e meta-análise. J Clin Gastroenterol 2014; 48(6): 505-512.
- Liu J, et al: Medicamentos herbais para o tratamento da síndrome do intestino irritável (Revisão). Cochrane Database Syst Rev 2006; (1): CD004116.
- Kaminski A, et al: Antidepressivos para o tratamento de perturbações gastrointestinais funcionais relacionadas com a dor abdominal em crianças e adolescentes. Cochrane Database Syst Rev 2011; (7): CD008013.
- Chey WD, et al: Linaclotide for Irritable Bowel Syndrome with Constipation: A 26-Week, Randomized, Double-blind, Placebo-Controlled Trial to Evaluate Efficacy and Safety. Am J Gastroenterol 2012; 107(11): 1702-1712.
- Rao S, et al: Um ensaio de 12 semanas, aleatorizado e controlado com um período de retirada aleatório de 4 semanas para avaliar a eficácia e segurança do linaclotide na síndrome do intestino irritável com obstipação. Am J Gastroenterol 2012; 107(11): 1714-1724.
- Drossman DA, et al: Clinical trial: Lubiprostone in patients with constipation-associated irritable intestel syndrome – Resultados de dois estudos randomizados, controlados por placebo. Aliment Pharmacol Ther 2009; 29(3): 329-341.
- Malagelada C, et al.: Efeito do prucalopride na tolerância aos gases intestinais em pacientes com perturbações intestinais funcionais e obstipação intestinal. J Gastroenterol Hepatol 2017; 32(8): 1457-1462.
- Wedlake L, et al: Revisão sistemática: A prevalência de má absorção de ácido biliar idiopático como diagnosticado pelo scanning SeHCAT em doentes com síndrome do cólon irritável por diarreia-predominância. Aliment Pharmacol Ther 2009; 30(7): 707-717.
- Camilleri M: Opções de gestão para a Síndrome do Colón Irritável. Mayo Clin Proc 2018; 93(12): 1858-1872.
- Lembo AJ, et al: Eluxadolina para a Síndrome do Colón Irritável com Diarreia. N Engl J Med 2016; 374(3): 242-253.
- Lacy BE, et al: Eluxadoline Efficacy in IBS-D Patients Who Report Prior Loperamide Use. Am J Gastroenterol 2017; 112(6): 924-932.
- Garsed K, et al: Um ensaio aleatório de ondansetron para o tratamento da síndrome do cólon irritável com diarreia. Trip 2014; 63(10): 1617-1625.
- Pimentel M, et al: Terapia de Rifaximin para Doentes com Síndrome do Colón Irritável sem Obstipação. N Engl J Med 2011; 364(1): 22-32.
- Hungin APS, et al: Systematic review: probiotics in the management of lower gastrointestinal symptoms in clinical practice — um guia internacional baseado em provas. Aliment Pharmacol Ther 2013; 38(8): 864-886.
- Webb AN, Kukuruzovic RH, Catto-Smith AG, Sawyer SM: Hipnoterapia para o tratamento da síndrome do cólon irritável. Base de dados Cochrane Syst Rev 2007; (4): CD005110.
- Zijdenbos IL, et al: Tratamentos psicológicos para a gestão da síndrome do cólon irritável. Cochrane Database Syst Rev 2009; (1): CD006442.
- Radziwon CD, Lackner JM: Cognitive Behavioral Therapy for IBS: How Useful, How Frequently, and How Does It Work? Curr Gastroenterol 2017; 19(10): 49.
- Accarino A, et al: Resultados da Redistribuição Abdominal de Conteúdo da Caudo-ventral Redistribuição de Conteúdo. Gastroenterologia 2009; 136(5): 1544-1551.
- Barba E, et al: Mecanismos abdominotóricos de distensão abdominal funcional e correcção por biofeedback. Gastroenterologia 2015; 148(4): 732-739.
- Barba E, Accarino A, Azpiroz F: Correcção da Distensão Abdominal através do Controlo da Actividade Muscular Abdominotórax Guiada por Biofeedback num Julgamento Randomizado e Controlado por Placebo. Clin Gastroenterol Hepatol 2017; 15(12): 1922-1929.
- Van Oudenhove LV, et al: Biopsychoscial aspects of functional gastrointestinal disorders: how central and environmental processes contribute to the development and expression of functional gastrointestinal disorders. Gastroenterologia 2016; 150(6): 1355-1367.e2.
- Jaynk GS, Gyawali CP: Síndrome do intestino irritável: conceitos modernos e opções de gestão. The American Journal of Medicine 2015; 128(8): 817-827.
PRÁTICA DO GP 2019; 14(1): 11-18











