Os tratamentos possíveis para sarcomas de tecidos moles incluem cirurgia, radioterapia e quimioterapia. Recentemente, têm sido feitas tentativas para intensificar os efeitos expondo as células cancerosas ao calor – com sucesso.
Nos adultos, os sarcomas de tecido mole são raros em comparação com outros tipos de cancro (em geral, representam menos de 1% de todos os tumores malignos). A terapia é planeada individualmente e depende, entre outras coisas, da localização, tamanho do sarcoma e metástases. As formas localizadas são geralmente submetidas a cirurgia combinada com radiação pré ou pós-operatória, e a quimioterapia perioperatória é também recomendada como opção para pacientes de alto risco.
“Cadinho” para células cancerígenas
Nos ensaios clínicos pré-clínicos, mas também nos primeiros ensaios clínicos aleatórios, foram encontrados efeitos sinérgicos quando a rádio e a quimioterapia foram combinadas com uma exposição ao calor regional de 40 a 43°C. O calor não só mata as células cancerosas através da toxicidade térmica directa, mas também aumenta o efeito dos medicamentos ou das células cancerosas. sensibilização do tecido à quimioterapia ou radiação e, por fim, induz uma resposta imunitária (anti-tumor) através de proteínas de stress e vários outros mecanismos de sinal de alerta [1].
Um grupo de investigadores de Munique provou a viabilidade e eficácia do procedimento para os sarcomas de alto risco já em 1990 [2]. Muitos mais anos se passaram. O primeiro autor na altura e um dos cientistas mais activos neste campo, o Prof. Dr. med. Rolf D. Issels, do Hospital Universitário de Munique, permaneceu no assunto. Em colaboração com centros universitários da Noruega, Áustria e EUA, bem como seis hospitais alemães sob a recente liderança de Munique, foram apresentados pela primeira vez em 2010 [3] os resultados de um ensaio aleatório de fase III comparando a hipertermia regional em combinação com a quimioterapia neoadjuvante apenas com a quimioterapia.
O sistema de hipertermia BSD-2000 foi utilizado para este fim. Num dispositivo reclinável em forma de anel, a energia térmica de alta frequência está selectivamente concentrada na região alvo de tratamento no interior profundo dos membros, pélvis, abdómen ou tórax. A chamada configuração de phased array agrupa a energia de radiação através da disposição de radiadores individuais. Uma forte directividade é conseguida com antenas de phased array. No local alvo, a temperatura aumenta (o tecido contendo água é aquecido pelo acoplamento de ondas electromagnéticas), enquanto que o sistema suprime a radiação noutros locais. Tudo isto é monitorizado e controlado por computador e através de sensores ou “termóstato”. A temperatura alvo no estudo foi de 42°C (ou seja, febre muito alta) durante uma hora no dia 1 e 4 de cada ciclo de quimioterapia.
Dos 341 adultos aleatorizados com sarcomas de tecido mole de alto risco localizados, quase todos foram submetidos a (re)ressecção e um bom dois terços por grupo foram submetidos a radioterapia. Em média, os doentes receberam doses de radiação de 53,2 vs. 52,7 Gy. A terapia neoadjuvante consistiu nos dois agentes quimioterápicos mais activos neste campo, a doxorubicina e a ifosfamida. Este último funciona mais eficazmente a temperaturas de 40,5 a 43°C. Além disso, foi dado etoposídio, que, de acordo com os autores, poderia ser omitido no futuro, uma vez que tem apenas uma baixa actividade em sarcomas de tecido mole. Os mesmos agentes foram utilizados para a terapia pós-indução (novamente com ou sem hipertermia) após ressecção e/ou radiação, que cerca de metade dos pacientes de cada grupo foram completamente submetidos (mais no grupo da hipertermia).
Eficácia a longo prazo confirmada
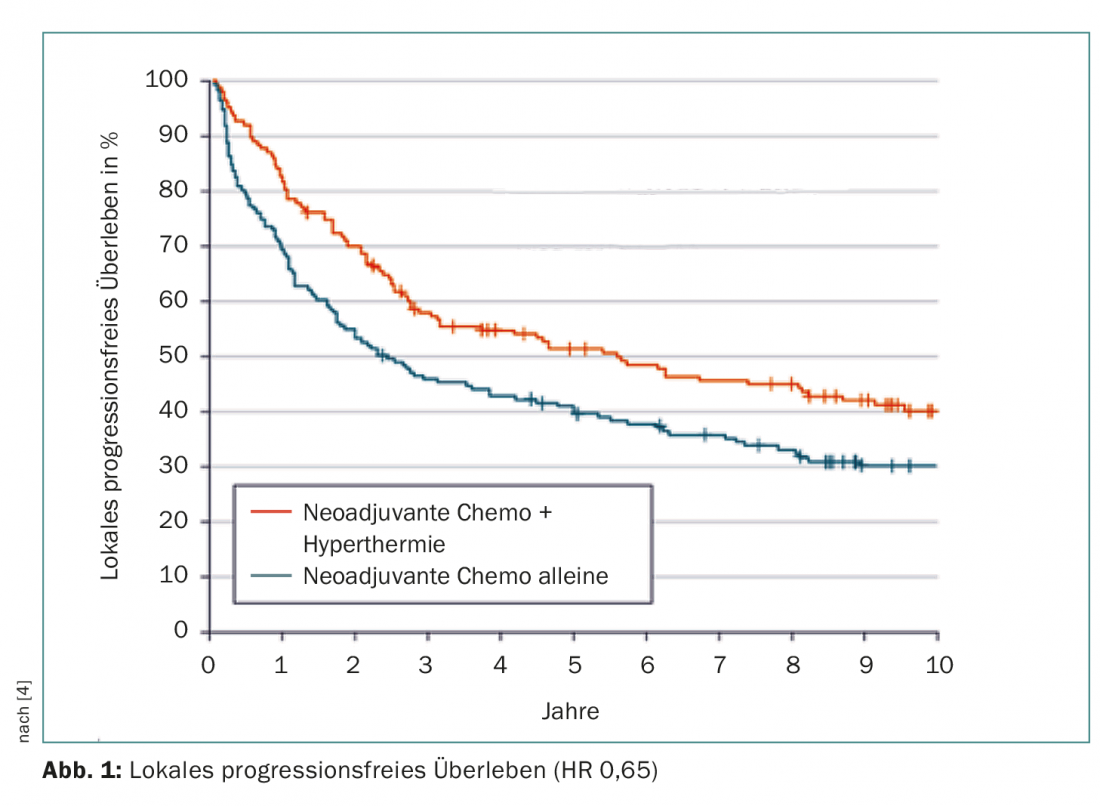
Em Dezembro de 2014, a recolha de dados foi concluída. Nesta altura, após uma mediana de mais de onze anos de seguimento, a adição de hipertermia tinha reduzido a probabilidade de progressão local ou morte em 35% (HR 0,65; 95% CI 0,49-0,86; p=0,002). Este foi o principal desfecho. As curvas divergiram rapidamente desde o início do estudo, a progressão precoce foi efectivamente impedida (Fig. 1). O risco de mortalidade foi igualmente melhorado com uma redução significativa de 27% no grupo de estudo (em que apenas foram analisados casos associados a doenças ou tratamentos) – nomeadamente de uns bons seis para cerca de 15 anos. Após cinco anos, 62,7% vs. 51,3% e após dez anos 52,6% vs. 42,7% das pessoas tratadas estavam vivas. Nove pacientes precisavam de ser tratados com hipertermia para salvar um da morte em cinco anos (Número Necessário para Tratar).
Os resultados a longo prazo [4] confirmam a avaliação inicial que teve lugar em 2010. Nessa altura, o parâmetro primário tinha mostrado uma redução de risco superior a 40% e um benefício de sobrevivência naqueles que tinham completado a quimioterapia de indução com hipertermia. 28,8% contra 12,7% responderam ao respectivo tratamento. O ensaio foi mais eficaz para os sarcomas retroperitoneal e abdominal (não-extremidade).
Segurança aceitável
Em termos de segurança, os resultados da estratégia de tratamento combinado foram mistos. Os autores falaram de uma “toxicidade moderada”, e o tratamento poderia geralmente ser efectuado em segurança. A terapia comparativa já representa um fardo para os pacientes, que só é aumentado de forma limitada pela hipertermia. Se havia uma morte associada a um tratamento apenas com quimioterapia, havia duas com hipertermia simultânea. Leucopénias graves eram significativamente mais frequentes, foram também encontradas trombocitopénias em 17% vs. 13,8% dos casos (possivelmente devido ao co-tratamento térmico da medula óssea, especialmente em grandes tumores abdominais ou pélvicos). Os pacientes poderiam ter sido mais susceptíveis a tais efeitos da quimioterapia por causa do calor. Houve também vários efeitos secundários específicos, tais como dor e queimaduras de pele em graus variáveis. A pressão das “almofadas” de silicone/água que rodeiam o paciente no aplicador (e que se destinam a visar as ondas para a área de cobertura) foi por vezes considerada desconfortável e pode ter promovido vómitos e neurotoxicidade local em alguns casos, especialmente em pacientes após cirurgia e radioterapia.
Continua a ser questionável se a relação risco-benefício da abordagem terapêutica seria assim também positiva em doentes com menor risco. A hipertermia também está actualmente a ser testada num grande ensaio de fase III em carcinomas pancreáticos ressecados.
Literatura:
- Issels RD: A hipertermia aumenta a quimioterapia. Eur J Cancer 2008 Nov; 44(17): 2546-2554.
- Issels RD, et al: Ifosfamide plus etoposide combined with regional hyperthermia in patients with local advanced sarcomas: um estudo de fase II. J Clin Oncol 1990; 8(11): 1818-1829.
- Issels RD, et al: quimioterapia neo-adjuvante sozinha ou com hipertermia regional para sarcoma localizado de tecidos moles de alto risco: um estudo multicêntrico randomizado de fase 3. Lancet Oncol 2010 Jun; 11(6): 561-570.
- Issels RD, et al: Effect of Neoadjuvant Chemotherapy Plus Regional Hyperthermia on Long-term Outcomes Among Patients With Localized High-Risk Soft Tissue Sarcoma. O EORTC 62961-ESHO 95 Ensaio Clínico Aleatório. JAMA Oncol 2018. DOI:10.1001/jamaoncol.2017.4996 [Epub ahead of Print].
InFo ONCOLOGy & HaEMATOLOGy 2018; 6(3): 5-6.