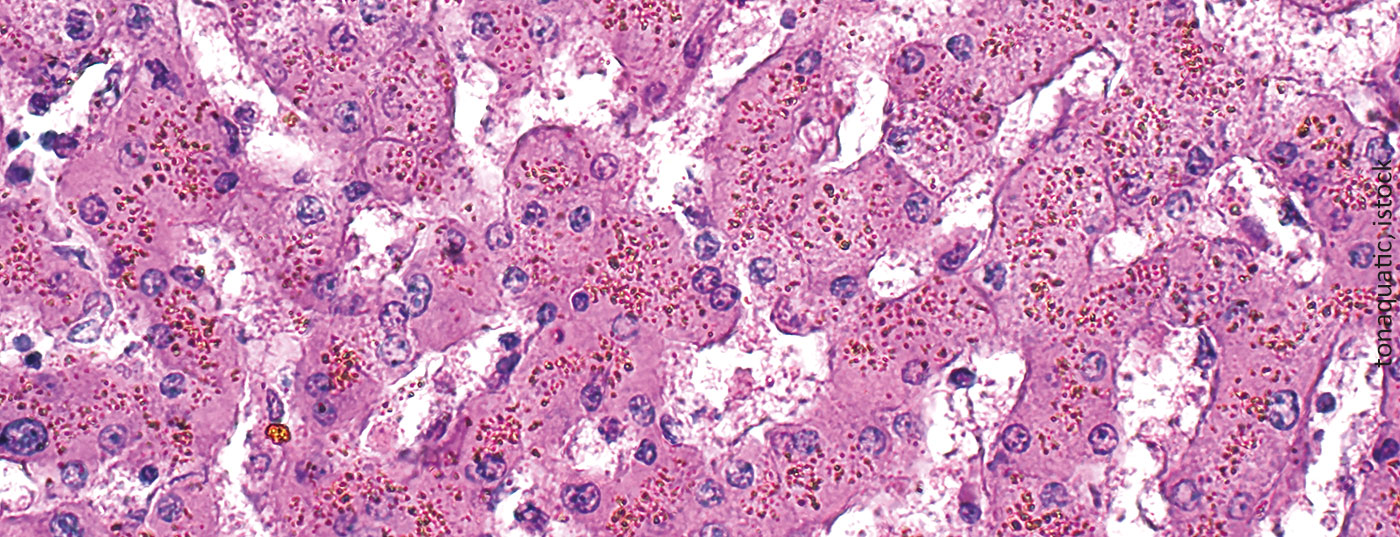
A sobrecarga de ferro é uma consequência inevitável e potencialmente fatal de múltiplas transfusões de concentrados de eritrócitos. Como as manifestações clínicas são inespecíficas e geralmente se desenvolvem lentamente, esta complicação é muitas vezes ignorada.
A sobrecarga de ferro é uma consequência inevitável e potencialmente fatal de múltiplas transfusões de concentrados de eritrócitos. Como as manifestações clínicas são inespecíficas e geralmente se desenvolvem lentamente, esta complicação é frequentemente ignorada.
Geralmente, já não se faz hoje uma distinção entre sobrecarga de ferro primária e secundária, porque tal definição depende, entre outras coisas, da sensibilidade dos métodos de exame. O termo “siderose” é normalmente usado para descrever a deposição de ferro sem danos nos tecidos, como ocorre com a deposição local de ferro devido a sangramento (por exemplo, siderose pulmonar).
Emergência de sobrecarga de ferro
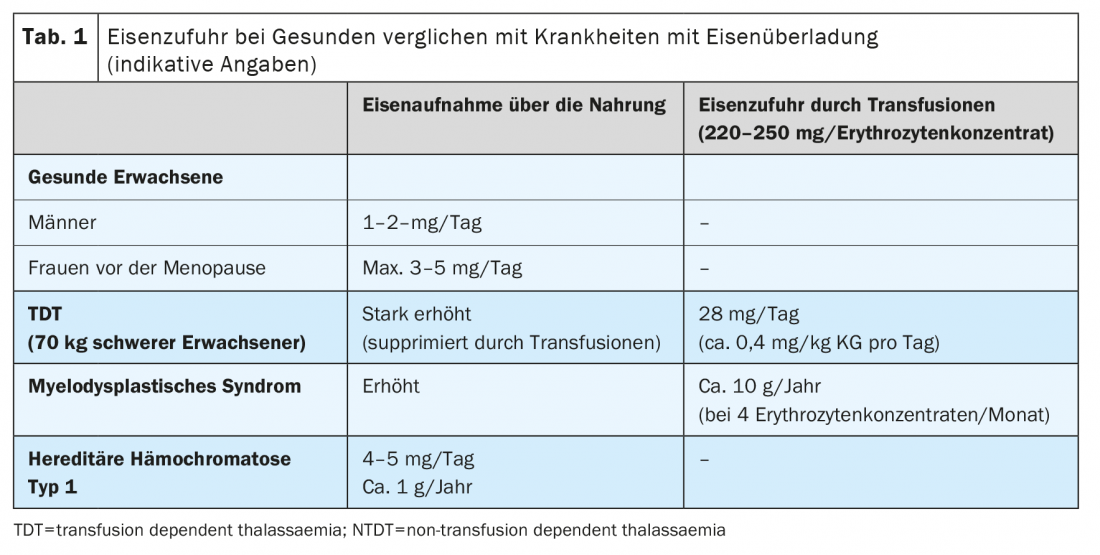
Uma dieta ocidental típica contém cerca de 6 mg de ferro/1000 kcal, dos quais apenas 1-2 mg/dia (cerca de 10%) são normalmente absorvidos e um máximo de 3-5 mg/dia quando a absorção intestinal de ferro é upregulada. O ferro de armazenamento normal é 500-1000 mg nos homens e 300-400 mg nas mulheres pré-menopausa e encontra-se na sua maioria no fígado. O organismo não tem mecanismos fisiológicos activos para excretar o excesso de ferro. Os adultos saudáveis excretam cerca de 1 mg de ferro/dia através da pele e células gastrointestinais, as mulheres pré-menopausadas perdem em média 0,5-1 mg/dia adicionais através da menstruação.
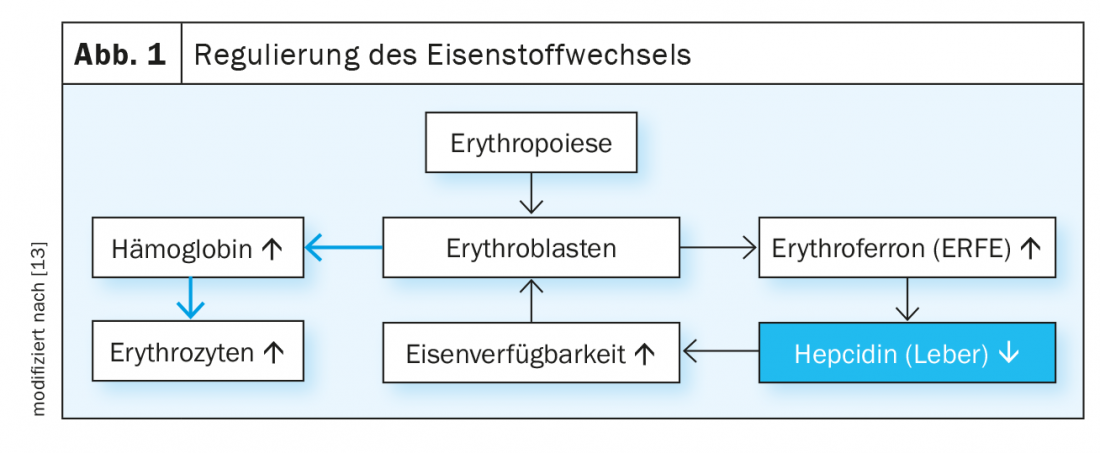
Os níveis de ferro plasmático são regulados pelo sistema hepcidin/ferroportina (Fig. 1). A hormona peptídeo hepcidina induz a degradação da ferroportina da proteína de exportação do ferro. A ferroportina é expressa principalmente em células da mucosa duodenal, células hepáticas e macrófagos e medeia a regulação da absorção de ferro dos alimentos, a libertação de ferro do fígado conforme necessário e a reciclagem de ferro em macrófagos. Com suficiente disponibilidade de ferro, a síntese hepática de hepcidina aumenta, bloqueando ainda mais a absorção de ferro gastrointestinal. A anemia crónica e a eritropoiese ineficaz, por outro lado, levam à inibição da síntese de hepcidina no fígado e, portanto, ao aumento da absorção de ferro no duodeno. A hormona eritroferrónica, que é produzida sob a influência da eritropoietina nos eritroblastos, também suprime a produção de hepcidina e assim estimula a absorção e mobilização do ferro das lojas em situações de stress eritropoiético.
O armazenamento excessivo de ferro é devido a dois mecanismos principais: O fornecimento iatrogénico de ferro através de transfusões de concentrados de glóbulos vermelhos e o aumento da ingestão de ferro dos alimentos. Cada concentrado de eritrócitos contém 220-250 mg de ferro. Em doentes adultos, deposição de ferro relevante ocorre após 15-20 transfusões, em crianças pequenas já após mais de 10 administrações de concentrados de eritrócitos. O aumento da absorção gastrointestinal desempenha um papel central em todas as situações com eritropoiese aumentada ou ineficaz. Aqui, os eritroblastos perecem através da morte celular na medula óssea antes de poderem amadurecer em eritrócitos. Isto leva à sobre-estimulação e hiperplasia da eritropoiese, que varia dependendo da doença subjacente. Quanto mais pronunciada for a diminuição da eritropoiese, mais a absorção de ferro dos alimentos é upregulada (Tab. 1).
Na hemocromatose hereditária, uma desordem genética do metabolismo do ferro sem anemia, a deposição de ferro resulta da desregulação do eixo hepcidin-ferroportina, mais frequentemente da diminuição da produção de hepcidina (como na hemocromatose hereditária tipo 1). Mais raramente, há uma disfunção de outras moléculas reguladoras do ferro.
Dependendo da doença, o curso temporal e a extensão da acumulação de ferro, bem como a distribuição do ferro nos órgãos, são diferentes. Isto também é influenciado por outros factores, tais como infecções crónicas (por exemplo, hepatite crónica) e doenças metabólicas (por exemplo, esteato-hepatite).
Efeitos do excesso de ferro sobre as células
A toxicidade associada ao ferro é observada principalmente nos tecidos que armazenam ferro em altas concentrações. Estes são em particular o fígado, o sistema endócrino e o miocárdio. O ferro das transfusões é primeiro depositado nos macrófagos do fígado, baço e medula óssea, depois nos hepatócitos e só mais tarde nos órgãos endócrinos (especialmente no pâncreas) e no músculo cardíaco.
O ferro em circulação é ligado pela transferrina de proteínas e depois entregue às células pela ligação da transferrina aos receptores apropriados (TfR1, expresso em todas as células, e TfR2, presente nos hepatócitos). A proporção normal de transferrina ligada ao ferro é de 16-45% e é medida como saturação da transferrina. Na presença de ferro em excesso, a capacidade de ligação da transferrina é excedida e a níveis superiores a 70-75%, surgem moléculas de ferro não ligadas (ferro não ligado à transferrina , NTBI) que são rapidamente levadas para as células através de vias não reguladas (por exemplo, através de canais de cálcio para as células do miocárdio). A ingestão contínua de NTBI aumenta tanto as reservas fisiológicas intracelulares de ferro (ferritina) como a ocorrência de formas de ferro lábil. Estes últimos catalisam reacções bioquímicas tais como a reacção de Fenton, produzindo radicais oxigenados reactivos (ROS). As consequências são a peroxidação das moléculas intracelulares, especialmente dos lípidos, com danos nas organelas, morte celular, estimulação da fibrogénese e finalmente disfunção orgânica. Além disso, o ADN é danificado, o que pode levar à instabilidade do genoma e a uma tendência para a mutagénese (Fig. 2) .
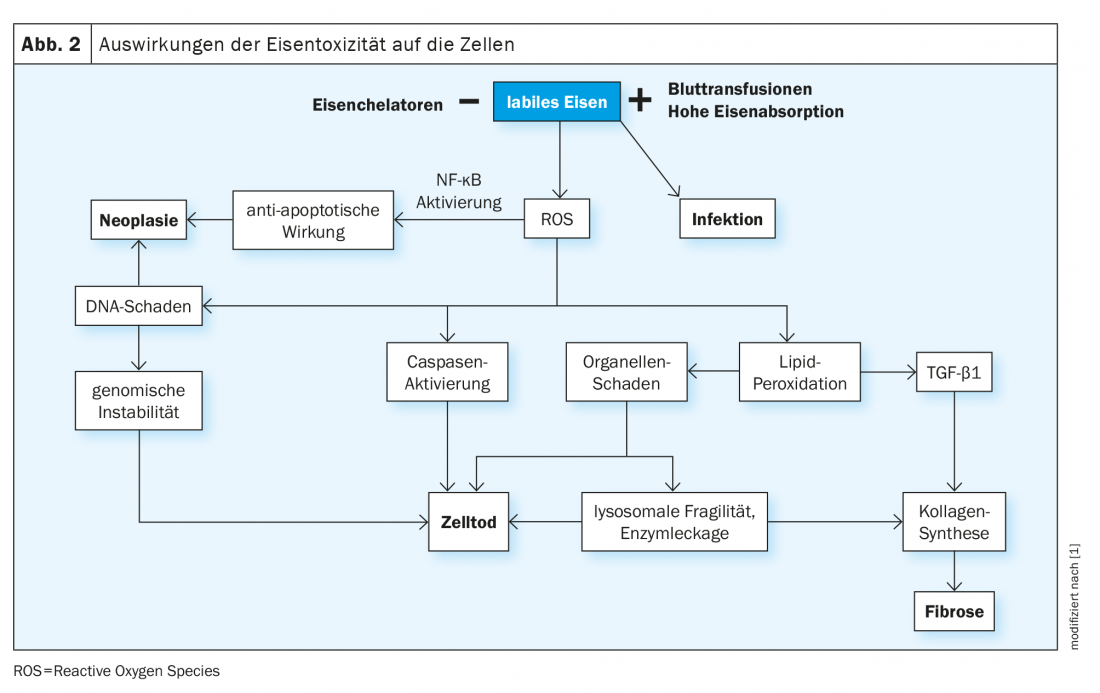
A deposição de ferro é tolerada de forma diferente pelos diferentes tecidos. Por exemplo, o fígado pode armazenar muito mais ferro do que o miocárdio sem consequências nocivas. Outro factor decisivo para o desenvolvimento de lesões de órgãos é a duração da exposição celular às NTBI. Isto pode agora persistir durante várias décadas em doenças congénitas dependentes da transfusão, tais como a talassemia grave, e está associado a um risco acrescido de doenças malignas.
Um efeito subestimado da sobrecarga de ferro é o favorecimento do crescimento bacteriano e o correspondente risco de infecções. A rápida disponibilidade de ferro livre para os microorganismos, por um lado, e os efeitos na função dos macrófagos e leucócitos, por outro, explicam o aumento da susceptibilidade às infecções de doentes com talassemia dependente de transfusões. Novas observações mostram também que o excesso de ferro causa stress oxidativo no endotélio de todos os vasos e reduz a exportação de colesterol por macrófagos na parede do vaso, o que pode levar a um aumento da formação de placas.
Pacientes em risco de sobrecarga de ferro
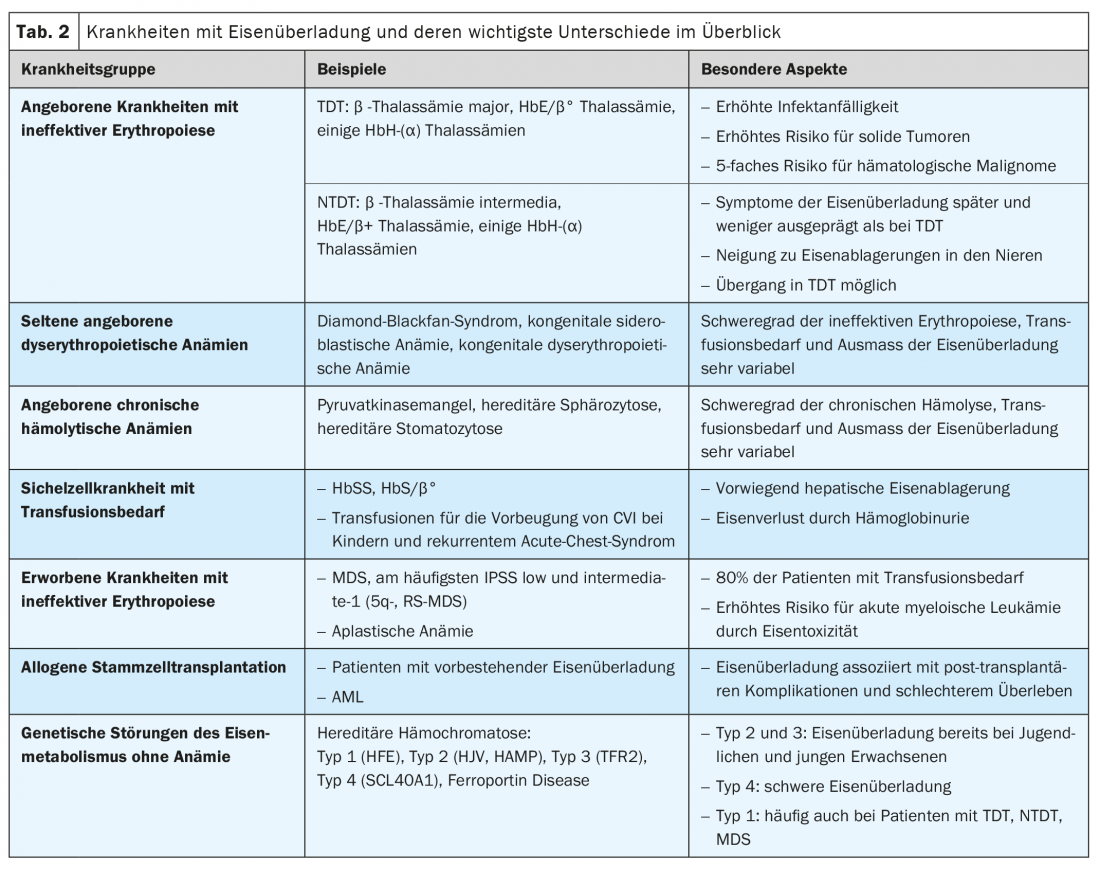
As situações clínicas associadas à sobrecarga de ferro incluem doenças congénitas e adquiridas com eritropoiese ineficaz (por exemplo, talassemia e síndrome mielodisplásica), doenças hemolíticas crónicas, doença falciforme (SCD) que requerem transfusão e doenças genéticas do metabolismo do ferro sem anemia (hemocromatose hereditária). (Tab. 2). Além disso, o excesso de ferro é de importância prognóstica nos pacientes após o transplante alogénico de células estaminais.
Talassemia dependente de transfusões (TDT) e não dependente de transfusões (NTDT)
As síndromes de talassemia estão entre as doenças genéticas mais comuns a nível mundial e são causadas por defeitos genéticos no cromossoma 11(β-talassemia) ou 16(α-talassemia), que levam a uma síntese reduzida ou ausente das cadeias de globina correspondentes. O enorme número de variantes genéticas e as suas combinações descritas até agora, bem como o tipo de herança, explicam a elevada variabilidade clínica. De um ponto de vista clínico, é feita uma distinção entre as talassemias dependentes de transfusão (TDT) e não dependentes de transfusão (NTDT). Esta subdivisão corresponde aproximadamente àquela em Thalassämia major e intermedia.
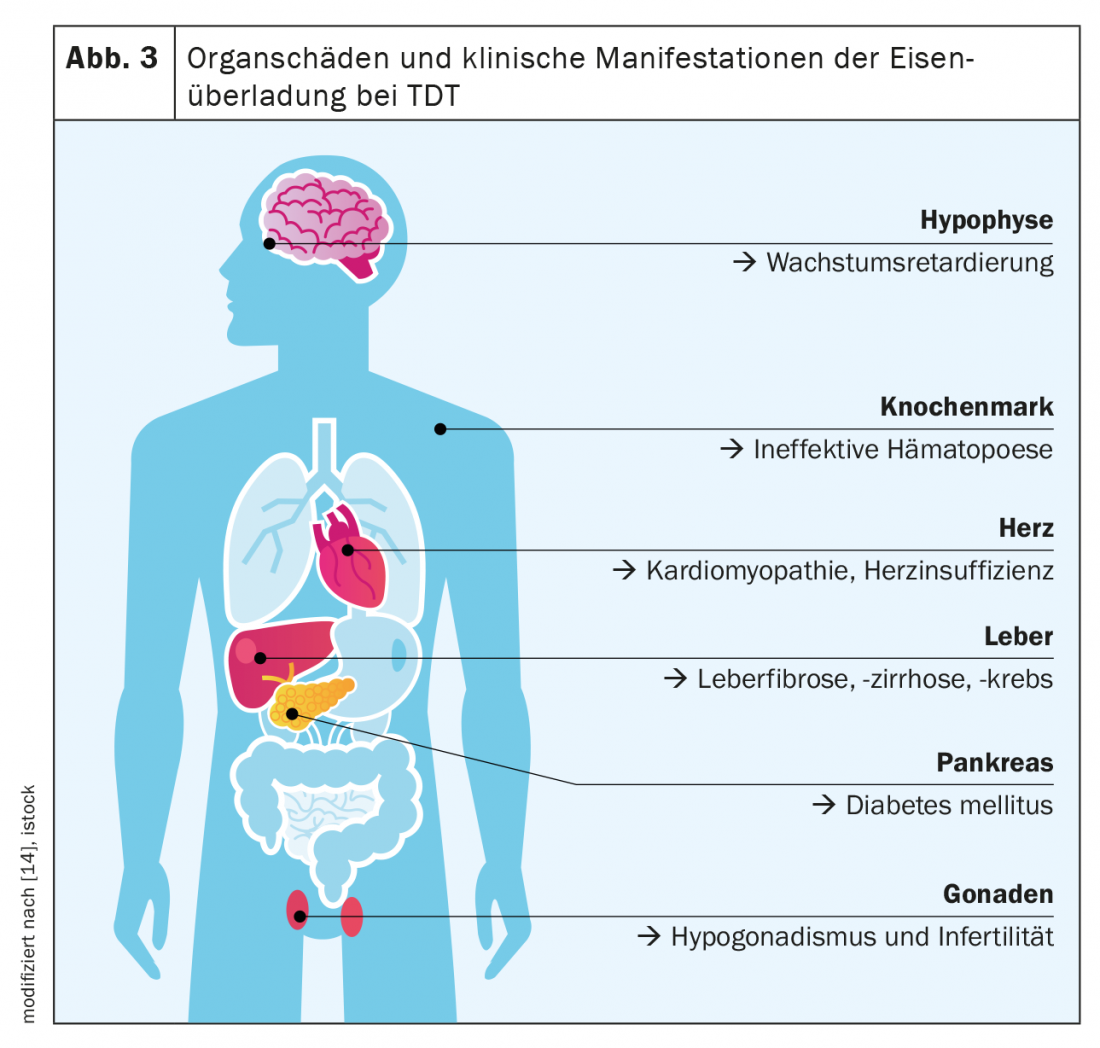
A β-talassaemia grave é considerada o paradigma das doenças por TDT e sobrecarga de ferro. A principal característica do TDT é gravemente afectada pela ausência de eritropoiese, que resulta da síntese reduzida de hemoglobina e da precipitação de cadeias de globina em excesso(α ou β). Existe anemia grave com, por um lado, uma necessidade vitalícia de transfusões desde o primeiro ano de vida e, por outro, uma absorção de ferro intestinal maximamente estimulada. Assim, uma enorme ingestão diária de ferro dos alimentos e a ingestão de ferro iatrogénico, que por si só atinge aproximadamente 0,4 mg/kg de peso corporal por dia, somam-se. Os sintomas clássicos de sobrecarga de ferro em TDT são hepatopatia (fibrose, cirrose, carcinoma hepatocelular), cardiopatia (especialmente cardiopatia ritmogénica e dilatada), endocrinopatias (diabetes mellitus, hipotiroidismo, hipogonadismo) e osteoporose (Fig. 3) .
Com a introdução da terapia transfusional nos anos 70, a esperança de vida dos pacientes com TDT foi alargada à puberdade, sendo a insuficiência cardíaca e endócrina as causas mais comuns de morte. Graças à possibilidade de quelação do ferro, os pacientes com TDT têm agora uma esperança de vida de 40-50 anos ou mais e têm formas menos graves de cardiopatias e endocrinopatias. No entanto, existe um risco aumentado de neoplasias malignas, especialmente carcinomas gastrointestinais, e um risco 5 vezes maior de neoplasias hematológicas como consequência a longo prazo da toxicidade do ferro.
No NTDT, o aumento da absorção de ferro (aproximadamente 0,01 mg/kg de peso corporal por dia) é a consequência de um grande aumento da eritropoiese e representa o principal mecanismo de deposição de ferro. Como a acumulação de ferro em NTDT se desenvolve lentamente, as manifestações clínicas só ocorrem mais tarde na infância ou mesmo no início da vida adulta. Os sintomas de sobrecarga de ferro são geralmente menos pronunciados, o envolvimento cardíaco menos frequente e o risco de neoplasia menor do que com TDT. No entanto, os pacientes com NTDT têm tendência a acumular ferro nos rins, o que pode levar a disfunções intersticiais e glomerulares. É importante notar que a NTDT pode transformar-se em TDT no decurso da vida.
Raras anemias congénitas com eritropoiese ineficaz e anemias hemolíticas crónicas congénitas
Também nas anemias congénitas, como a síndrome de Diamond-Blackfan, a gravidade da eritropoiese e da anemia ineficazes, bem como a necessidade de transfusão, determinam a extensão da sobrecarga de ferro. Os dados específicos são escassos para estas doenças raras. Dependendo da necessidade de transfusão, que pode ser relevante mesmo em crianças pequenas, os riscos e manifestações clínicas de sobrecarga de ferro são semelhantes aos dos TDT e NTDT.
As enzimopatias eritrocitárias congénitas como a deficiência de cinase pirúvel, membranopatias (por exemplo, esferocitose hereditária) e perturbações da síntese de hemorragia (por exemplo, porfírias) levam a hemólise crónica mais ou menos pronunciada e, portanto, a hiperplasia da eritropoiese. A sobrecarga de ferro pode ocorrer em indivíduos afectados mesmo sem transfusões (até 47% dos pacientes com deficiência de cinase pirúvica), com sintomas correspondentes tipicamente ocorrendo na idade adulta e apenas raramente na infância. Na esferocitose hereditária, que é a causa mais comum de hemólise crónica com uma prevalência estimada de 1:2000 a 1:2500, apenas uma proporção de doentes necessita de transfusões esporádicas ou regulares.
Doença falciforme (SCD) com necessidade de transfusão
As transfusões regulares são indicadas em doentes com DSC apenas em situações específicas, incluindo a prevenção de insultos cerebrovasculares em crianças e síndrome torácica aguda recorrente ou crises vaso-oclusivas graves. Nestes casos, são frequentemente realizadas transfusões manuais ou automáticas de troca, que não estão associadas a um aumento da ingestão de ferro relacionado com a transfusão.
Os doentes com SCD perdem frequentemente ferro através da hemoglobinúria (em quantidades equivalentes a até 10 concentrados de eritrócitos por ano) e têm baixos níveis plasmáticos de NTBI. Portanto, a sobrecarga de ferro apenas se desenvolve numa proporção relativamente pequena das pessoas afectadas e os sintomas – especialmente a hepatopatia e a fibrose hepática – aparecem classicamente mais tarde na vida. Embora os danos endócrinos ou cardíacos sejam raros nos doentes com DSC, as manifestações clínicas de sobrecarga de ferro e do próprio DSC são muitas vezes difíceis de distinguir, e os danos de órgãos relacionados com o ferro são por vezes subestimados. Estudos mostram que até 11% dos pacientes com SCD morrem em resultado de sobrecarga de ferro. Devido à esperança de vida cada vez mais longa, as complicações associadas ao ferro a longo prazo devem também aumentar no SCD, tal como no TDT e NTDT.
Anemia crónica adquirida devido a falência da medula óssea
A síndrome mielodisplásica (MDS) compreende um grupo de doenças adquiridas caracterizadas por falência da medula óssea de graus variáveis e o potencial de desenvolvimento de leucemia mielóide aguda. O MDS é uma das neoplasias hematológicas mais comuns (incidência de aproximadamente 4/100.000 na Europa) e afecta sobretudo os doentes mais idosos (idade média ao diagnóstico 71 anos).
No MDS de baixo risco (IPSS de baixo e intermédio-1), as citopénias são predominantes, com anemia devido à eritropoiese ineficaz a ocorrer em cerca de 80% dos casos. Como a maioria dos doentes com MDS se tornam dependentes da transfusão, desenvolvem frequentemente uma sobrecarga de ferro. As diferenças mais importantes para o TDT e NTDT são a idade muito mais avançada dos pacientes no diagnóstico e a alta estabilidade genómica dos clones displásicos na medula óssea. Tal como no TDT, as complicações cardíacas são comuns em doentes com MDS transfundidos regularmente (82,4% contra 67,1% em doentes não transfundidos). Um significado particular da toxicidade do ferro no MDS reside na promoção da progressão para a leucemia aguda e na influência negativa na sobrevivência após o transplante alogénico de células estaminais.
Transplante alogénico de células estaminais
O transplante alogénico de células estaminais é um tratamento potencialmente curativo para pacientes com TDT, SCD e MDS e outras doenças com deposição de ferro. A influência da sobrecarga de ferro no sucesso do transplante alogénico de células estaminais, especialmente na mortalidade associada à terapia, foi inicialmente descrita nas talassemias e é agora cada vez mais reconhecida em outros quadros clínicos.
Mesmo a toxicidade da quimioterapia pode ser parcialmente atribuída aos efeitos negativos da sobrecarga de ferro, pois durante o condicionamento há uma mobilização maciça de reservas de ferro da medula óssea com libertação de NTBI. Os requisitos de transfusão antes e depois do transplante influenciam o curso de peri-transplante. Dados mostram que 88% dos doentes com MDS e 97% dos doentes com leucemia mielóide aguda têm níveis elevados de ferritina antes do transplante e que o excesso de ferro está associado à mucosite, obstrução sinusoidal dos vasos hepáticos, septicemia e sobrevivência global mais baixa.
Perturbações genéticas do metabolismo do ferro sem anemia
O aumento da absorção de ferro intestinal é o correlato fisiopatológico das várias formas de hemocromatose hereditária. O consumo de ferro pode ser aumentado até 4 mg diários, ou seja, 2-4 vezes mais do que em indivíduos sem hemocromatose hereditária (Quadro 1) .
Na hemocromatose hereditária associada ao HFE (tipo 1), uma das doenças genéticas mais comuns na população europeia, o ferro deposita-se muito lentamente (cerca de 1 g/ano) e os sintomas aparecem tipicamente na idade adulta (entre 40 e 50 anos nos homens, frequentemente após a menopausa nas mulheres). As manifestações clínicas mais comuns são hepatopatia, artropatias e diabetes mellitus. O momento e a gravidade da acumulação de ferro diferem consoante a mutação subjacente. Algumas formas raras como a hemocromatose juvenil (tipo 2) são mais agressivas e levam ao armazenamento de ferro relevante logo na puberdade.
Devido à sua frequência, a hemocromatose hereditária, especialmente do tipo 1, não é raramente detectada em doentes com talassemia, MDS ou riscos de acumulação patológica de ferro, representando assim um factor adicional no desenvolvimento de uma sobrecarga de ferro potencialmente grave.
Mensagens Take-Home
- O aumento da absorção de ferro intestinal e a ingestão de ferro iatrogénico através de transfusões de concentrados de eritrócitos são os principais mecanismos para o desenvolvimento de uma sobrecarga de ferro.
- A acumulação patológica de ferro ocorre em doenças congénitas e hematológicas adquiridas com eritropoiese ineficaz, mesmo na ausência de transfusões regulares.
- A sobrecarga de ferro desenvolve-se mais rapidamente e em maior grau em pacientes regularmente transfundidos do que em doenças não dependentes da transfusão; em doenças genéticas do metabolismo do ferro (hemocromatose hereditária), o ferro é depositado muito mais lentamente em comparação.
- No MDS, o excesso de ferro celular pode aumentar a instabilidade do genoma nos clones celulares pré-leucémicos, promovendo a transformação em leucemia aguda.
- A sobrecarga de ferro está associada a complicações clínicas e ao aumento da mortalidade após transplante alogénico de células estaminais.
- A hemocromatose hereditária, devido à sua frequência, pode estar presente em doentes com outros riscos de sobrecarga de ferro clinicamente relevantes e pode influenciar o curso clínico.
Literatura:
- Porter JB, et al: Novos conhecimentos sobre toxicidade do ferro relacionada com a transfusão: Implicações para o oncologista. Critério Rev Oncologia/Hematologia 2016; 99: 261-271
- Camaschella C, Nai A, Silvestri L: Metabolismo do ferro e perturbações do ferro revisitadas na era da hepcidina. Haematologica 2020; 105: 260-72
- Porter JB, Garbowski M: A patofisiologia da sobrecarga de ferro transfusional. Hematol. Oncol Clin N Am 2014; 28: 683-701.
- Hahalis G, et al.: Disfunção vasomotora global e envelhecimento vascular acelerado em beta-talassemia major. Aterosclerose 2008; 198 (2): 448-457.
- Gardenghi S, et al.: A eritropoiese ineficaz na talassemia beta caracteriza-se pelo aumento da absorção de ferro mediada pela regulação da hepcidina para baixo e pela regulação da ferroportina para cima. Sangue 2007; 109(11): 5027-5035.
- Vento S, Cainelli F, Cesario F: Infecções e talassémia. Lancet Infect Dis 2006; 6(4): 226-233.
- Porter J, Garbowski M: Consequências e gestão da sobrecarga de ferro na doença falciforme. Programa Hematologia Am Soc Hematol Educ. 2013; 2013: 447-456.
- Roggero S, et al: Severe iron overload in Blackfan-Diamond anemia: um estudo de caso-controlo. Am J Hematol. 2009; 84: 729-32.
- Zanella S, Garani MC, Borgna-Pignatti C: Malignidades e talassemias: uma revisão da literatura. Ann N Y Acad Sci 2016; 1368(1): 140-148.
- Gattermann N: sobrecarga de ferro em síndromes mielodisplásticas (MDS). Int J Hematol 2018; 107: 55-63.
- Koreth J, Antin JH: sobrecarga de ferro em malignidades hematológicas e resultado de transplante alogénico de células estaminais hematopoiéticas. Haematologica 2010; 95: 364-366.
- Pilling LC, et al: Condições comuns associadas a variantes genéticas de hemocromatose hereditária: estudo de coorte no Biobank do Reino Unido. BMJ 2019; 364: k5222.
- Leuenberger N, et al.: Hepcidin como potencial biomarcador de doping sanguíneo. Drug Test Anal 2017; 9(7): 1093-1097.
- Novartis: Viver com transfusões. www.leben-mit-transfusionen.de/eisenueberladung/krankheitsbild (último acesso em 10.02.2022)
InFo ONCOLOGy & HEMATOLOGy 2022; 10(1): 12-17