De acordo com a classificação actual, a insuficiência cardíaca com fração de ejeção reduzida (HFrEF) é caracterizada por uma fração de ejeção do ventrículo esquerdo (FEVE) na faixa ≤40%, insuficiência cardíaca com fração de ejeção preservada (HFpEF) por uma FEVE na faixa ≥50%. Terapêuticamente, esta diferenciação faz uma grande diferença!
A insuficiência cardíaca (IC) não é um diagnóstico único mas uma síndrome clínica causada pela incapacidade do coração em satisfazer as exigências fisiológicas dos órgãos do corpo. Isto leva ou a sistemas de sobrecarga de volume, tais como dispneia, inchaço do tornozelo, fadiga e sinais clínicos de sobrecarga de volume, ou baixo débito cardíaco, ou ambos, devido a uma anomalia estrutural e/ou funcional do coração. Os factores de risco incluem um estilo de vida sedentário, obesidade, tensão arterial elevada, tabagismo, consumo excessivo de álcool, bem como dislipidemia, diabetes ou doença coronária (CHD). Que pode ser modificada por mudanças no estilo de vida, terapia médica óptima para hipertensão, diabetes e dislipidemia, e vacinações preventivas.
A tensão arterial elevada é um dos principais factores de risco
A tensão arterial elevada, em particular, é um dos principais factores de risco para o desenvolvimento da AF. Dois terços de todos os pacientes com IC sofrem desta situação, e até 90% dos pacientes com HFpEF. No entanto, a hipertensão não controlada em pacientes tratados com a terapia de HF ideal é bastante rara devido à sobreposição entre a HF e os medicamentos de hipertensão. Os alvos ideais da tensão arterial são ainda desconhecidos tanto para HFrEF como para HFpEF, razão pela qual os alvos individuais são geralmente tidos em conta, tendo em conta a idade e doenças concomitantes (diabetes, doença renal, CHD, doença cardíaca valvular, AVC). No entanto, como regra geral, visar alvos de medicação baseados em evidências em HFrEF, apesar de ligeira hipotensão; pelo contrário, evitar hipotensão em HFpEF com hipertrofia ventricular esquerda e reserva de pré-carga limitada.
Além disso, o diagnóstico de insuficiência cardíaca requer a presença de sintomas e/ou sinais de IC, bem como provas objectivas de disfunção cardíaca, tais como falta de ar, fadiga e inchaço do tornozelo. Se estes estiverem presentes, são recomendados os seguintes testes de diagnóstico para a avaliação de doentes com suspeita de IC crónica: O electrocardiograma (ECG) pode revelar anomalias tais como fibrilação atrial, ondas Q, hipertrofia do LVH e um complexo QRS alargado, o que pode aumentar a probabilidade de um diagnóstico de IC e também orientar a terapia. Se disponível, recomenda-se a medição de peptídeos natriuréticos (NP). Uma concentração plasmática de peptídeo natriurético tipo B (BNP) <35 pg/ml, peptídeo natriurético tipo N-terminal pró-B (NT-proBNP) <125 pg/ml ou peptídeo natriurético atrial médio-regional (MR-proANP) <40 pmol/L68 tornam o diagnóstico de HF improvável. Investigações básicas tais como ureia sérica e electrólitos, creatinina, hemograma completo e testes de função hepática e tiróide são recomendados para diferenciar a IC de outras doenças, para fornecer informação prognóstica e para orientar uma possível terapia. A ecocardiografia é recomendada como o exame mais importante para avaliar a função cardíaca. Além de determinar a FEVE, a ecocardiografia também fornece informação sobre outros parâmetros tais como tamanho ventricular, HVE excêntrica ou concêntrica, anomalias regionais do movimento da parede (que podem indicar CAD subjacente, síndrome de Takotsubo ou miocardite), função do VD, hipertensão pulmonar, função valvar e marcadores da função diastólica.
A insuficiência cardíaca pode ocorrer independentemente da fracção de ejecção do LV
As causas da IC podem variar, mas as cardiomiopatias isquémicas são relativamente comuns. A HF isquémica é causada por perturbações circulatórias no coração, por exemplo, como resultado de CHD. A questão decisiva no diagnóstico inicial de HF é, portanto, saber sempre se uma CHD previamente não detectada está presente. Um teste de isquemia não invasivo, como a ressonância magnética de stress, é frequentemente utilizado para responder a esta pergunta. É um método abrangente para avaliar a função global e regional, avaliando se a isquemia ou o enfarte do miocárdio já está presente, e caracterizando o tecido (edema miocárdico, área em risco, trombo ventricular, cardiomiopatia). A sensibilidade para detectar infarto é de 94-99%; a sensibilidade à isquemia é de 91% e a especificidade à isquemia é de 83%. Se houver uma ressonância magnética de stress positiva ou equívoca, com evidência de isquemia relevante (≥10%) ou padrões isquémicos de HF, o passo seguinte é uma angiografia invasiva. O resultado do qual ou confirma a HF isquémica e necessita de angioplastia coronária transluminal percutânea (PTCA) ou cirurgia de revascularização do miocárdio (CRM), ou demonstra a CAD de espectadores. No caso de uma RM de stress inconclusivo, com isquemia limitada (<10%), nachweislich kleinen Infarkten oder sehr jungen Patienten, sollte ein Kalzium-Score (Ca-Score) und eventuell eine computertomografische Koronarangiografie (CTCA) durchgeführt werden. Bei fortgeschrittener HF und einem Ca-Score=0, kann eine ischämische HF ausgeschlossen werden; bei einem Ca-Score>0, CTCA também deve ser realizada para excluir ou confirmar a CAD estenótica e a HF isquémica. Se a angiografia positiva e invasiva for novamente recomendada. O resultado do qual ou confirma a isquémica de HF ou comprova a isquémica de CHD e necessita das terapias apropriadas.
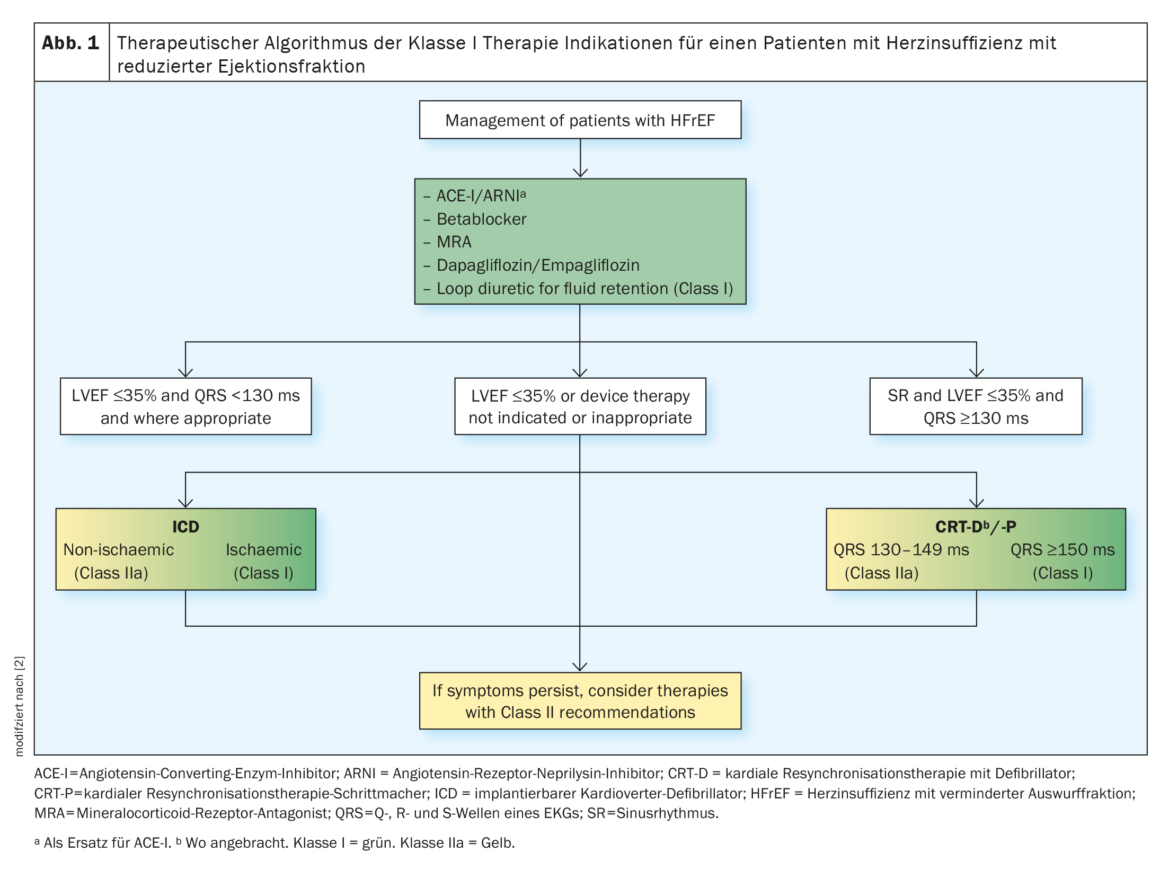
Benefício prognóstico dos medicamentos HFrEF clássicos
Actualmente, distinguem-se dois grupos principais de pacientes com base na fracção de ejecção do ventrículo esquerdo: pacientes com função de bombeamento deficiente (≤40%) do coração com insuficiência cardíaca sistólica (HFrEF) e pacientes com insuficiência cardíaca com poder de bombeamento preservado (≥50%) do coração (HFpEF). A diferenciação faz uma grande diferença terapêutica, porque para os pacientes com HFrEF, a investigação clínica desenvolveu agora um arsenal de opções de tratamento baseadas na evidência para reduzir a morbilidade e a mortalidade. Em particular, os chamados “Quatro Fantásticos” (ARNI/ACE-I/ARB, BB, MRA, SGLT2-I) reduzem a morbilidade e mortalidade no prazo de quatro semanas após o início do tratamento.
De acordo com as directrizes da Sociedade Europeia de Cardiologia , a terapia padrão comum para insuficiência cardíaca com fração de ejeção reduzida (HFrEF) inclui inicialmente a utilização de uma enzima conversora de angiotensina (ACE) ou um inibidor do receptor de angiotensina II tipo 1 (AT1) e um bloqueador beta (BB). Se a pressão arterial for adequada e eGFR ≥30 ml/min/m², pode ser mudada para sacubtril/valsartan. Os inibidores da ECA ou bloqueadores de AT1 devem ser descontinuados antes da administração. Para evitar o angioedema, deve haver pelo menos 36 horas entre a última administração de inibidores da ECA e o início da administração de ARNI. Em caso de intolerância à ACE-I ou ARNI, ARBS/Sartans pode ser utilizado. Tanto o RAAS-I, ARNI e SGLT2-I podem baixar temporariamente o eGFR. Um aumento da creatinina <50% e uma diminuição do eGFR <10% da linha de base é aceitável, a função renal recupera. SGLT2-I, em particular, mostraram um benefício de sobrevivência independente do estado de diabetes/HbA1c.
Os pacientes com IC isquémica têm em média um risco mais elevado de morte cardíaca súbita (SCD) do que os pacientes com IC não isquémica. Na presença de factores de risco de SCD tais como a classificação II-III da NYHA** e LVEF ≥3% apesar de ≥3 meses de terapia médica e sobrevivência óptima estabelecida >1 ano, existe uma indicação de CDI# classe I para pacientes com IC isquémica e uma indicação de classe IIa para todos os pacientes com IC não isquémica. Aos pacientes com classificação IV da NYHA refratários à terapia farmacológica (sobrevivência <1 ano) é dada uma indicação de classe III. A terapia de ressincronização cardíaca (CRT) é recomendada para doentes com FC sintomática, uma LVEF ≤35% apesar da terapia medicamentosa óptima e um bloco de ramo esquerdo (LBBBB) em ritmo sinusal e uma duração QRS ≥150 ms (fig. 1) [2].
** NYHA = New York Heart Association
# CDI = Desfibrilhador Cardioversor Implantável
Exames preventivos e tratamento de doenças subjacentes
Nos doentes com HFpEF, existe uma falta de terapias que melhorem o prognóstico, apesar de muitos estudos. Até agora, não foi provado nenhum tratamento para reduzir a mortalidade e a morbilidade. Aqui, a única opção que resta é ainda a tentativa empírica de aliviar os sintomas dos pacientes com diuréticos (loop) e de conseguir uma mudança para um estilo de vida saudável. A falta de uma terapia geral torna ainda mais importante o rastreio e tratamento de doenças subjacentes tais como hipertensão, diabetes, amiloidose, CHD e doença cardíaca valvular em doentes com HFpEF, explica o PD Dr Philip Haaf, médico sénior do Hospital Universitário de Basileia [1]. A grande maioria dos pacientes com HFpEF sofre de hipertensão, e muitos também têm CHD subjacentes. Fibrilação atrial, diabetes, DPOC, doença renal, terapias oncológicas anteriores, estado do ferro, doença cardíaca valvular, cardiomiopatia hipertrófica e amiloidose cardíaca devem ser procuradas, acrescentou Haaf.
Muito pouco ferro é mau – mas também é demasiado!
A cardiomiopatia devido à sobrecarga de ferro ocorre principalmente em doentes com hemocromatose primária ou hereditária, secundária a múltiplas transfusões de sangue. Uma RM cardíaca pode ajudar quantificando o conteúdo de ferro do coração e do fígado para diagnosticar e monitorizar a terapia com quelante de ferro e flebotomia. Ainda mais significativa do que a sobrecarga de ferro, porém, é a deficiência de ferro na insuficiência cardíaca. Para pacientes com IC, a deficiência de ferro está presente com uma ferritina <100 ng/ml ou ferritina <300 ng/ml com uma saturação de transferrina (TSAT) <20%. A deficiência de ferro pode apresentar-se independentemente da anemia e afectar 55% dos doentes com IC crónica e até 80% dos doentes com IC aguda. A causa exacta da deficiência de ferro em HF permanece desconhecida.
Recomenda-se que todos os pacientes com indicações de HF e classe I sejam submetidos regularmente a rastreios de anemia e deficiência de ferro através do hemograma completo, concentração de ferritina sérica e TSAT. A suplementação com ferro intravenoso com carboximaltose férrica deve ser considerada em doentes com IC sintomática recentemente hospitalizados para IC com LVEF ≤50% e deficiência de ferro, definida como ferritina sérica <100 ng/ml ou ferritina sérica 100-299 ng/ml com TSAT <20%, para reduzir o risco de hospitalização de IC. O tratamento da anemia na IC com agentes estimulantes da eritropoietina não é recomendado na ausência de outras indicações para a terapia.
Os problemas de válvulas ocorrem frequentemente
A estenose aórtica causa tensão extra no ventrículo esquerdo, que pode levar à hipertrofia cardíaca e à insuficiência cardíaca. A estenose aórtica grave é quando a área de abertura da válvula é ≤1 cm² ou quando a pressão média é ≥40 mmHg. Isto leva a um aumento da pós-carga e hipertrofia e remodelação do LV, o que por sua vez agrava a HF. Ao utilizar vasodilatadores, deve ter-se o cuidado de evitar a hipotensão. A substituição cirúrgica é recomendada para todos os pacientes <75 Jahren empfohlen, die zusätzlich ein geringes chirurgisches Risiko aufweisen. Die Transkatheter-Aortenklappen-Implantation (TAVI) wird bei Patienten>75 anos de idade que se encontram em risco cirúrgico acrescido. No entanto, devido ao procedimento suave, TAVI está também a ser cada vez mais utilizado com pacientes mais jovens.
A insuficiência aórtica pode também evoluir para insuficiência cardíaca ao longo do tempo. A regurgitação da aorta é considerada grave quando há um grande volume de regurgitação e refluxo para a aorta. Isto leva a uma dilatação progressiva do LV e subsequente disfunção, o que por sua vez agrava a AF. Os beta-bloqueadores devem ser utilizados com cautela, pois podem prolongar a diástole e agravar a regurgitação da aorta. A abordagem cirúrgica é considerada o padrão para regurgitação aórtica, mas TAVI é também cada vez mais utilizado, especialmente em risco cirúrgico elevado/proibitivo.
Regurgitação mitral severa (MR) também pode causar insuficiência cardíaca. A intervenção cirúrgica, de preferência de reparação, é recomendada em doentes com sintomas primários graves de MR e de IC. Se a cirurgia for contra-indicada ou considerada de alto risco, a reparação percutânea pode ser considerada. Em pacientes com RM secundária severa e HFrEF que requerem revascularização, a cirurgia da válvula mitral e a cirurgia de revascularização do miocárdio (RM) devem ser consideradas. A cirurgia isolada da válvula mitral pode ser considerada em doentes sintomáticos com RM secundária grave, apesar da terapia óptima e do baixo risco cirúrgico
A regurgitação tricúspide (TR) pode ser causada por ou ser uma consequência de disfunção do VR e da AF. O tratamento de HF com TR inclui a terapia medicamentosa (diuréticos, antagonistas neurohormonais). Em casos seleccionados, a transcaterioterapia e a cirurgia podem ser consideradas. A cirurgia da válvula tricúspide é recomendada para pacientes com TR grave que requerem cirurgia cardíaca do lado esquerdo. Também deve ser considerada em pacientes com TR moderada e dilatação da válvula tricúspide que requerem cirurgia cardíaca do lado esquerdo e em pacientes sintomáticos com TR grave isolada. As técnicas Transcatheter surgiram recentemente como potenciais opções de tratamento para o TR. Os resultados preliminares mostram uma melhoria na severidade e sintomas da TR com baixas taxas de complicações.

A amiloidose cardíaca ainda é uma causa subdiagnosticada
Tipicamente, um em cada seis pacientes com hipertrofia ventricular esquerda inexplicada e/ou HFpEF tem amiloidose cardíaca (CA). As duas formas mais comuns são a imunoglobulina de cadeia ligeira (AL) e a amiloidose de transtiretina (ATTR). Uma idade >65 anos e HF juntamente com a espessura da parede do LV >12 mm em ecocardiografia são os principais critérios de suspeita de AC. A imagem cardíaca e a biopsia endomiocárdica (EMB) ou a biopsia extracardíaca são necessárias para o diagnóstico de AL-CA em doentes com testes hematológicos anormais. A imagem com 99mTc-PYP## ou DPD$ ou HMDP& scintigrafia com imagem planar e SPECT*** tem uma especificidade e um valor preditivo positivo para ATTR-CA de até 100%. Em contraste, a CMR£ tem uma sensibilidade e especificidade de 85% e 92% respectivamente. Contudo, a EMB continua a ser o padrão de ouro para o diagnóstico de ATTR-CA com uma sensibilidade e especificidade de quase 100%.
## mTc-PYP=Pirofosfato de 99mTcrotulado com tecnécio
$ DPD=3,3-difosfono-1,2-ácido propanodicarboxílico
& HMDP=Hidroximetileno-difosfonato
*** SPECT = Tomografia Computadorizada por Emissão de Fótons Simples
£ CMR = ressonância magnética cardíaca
Literatura:
- PD Dr. med. Philip Haaf: Herzinsuffizienz mit reduzierter und erhaltener EF. Forum Medizin Fortbildung (FomF), Update Refresher 2023, Kardiologie I, 24.01.2023.
- McDonagh TA, et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal, Volume 42, Issue 36, 21 September 2021, Pages 3599–3726, https://doi.org/10.1093/eurheartj/ehab368.
Leitura adicional:
- Zeppenfeld K, et al.: 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. European Heart Journal, Volume 43, Issue 40, 21 October 2022, Pages 3997–4126, https://doi.org/10.1093/eurheartj/ehac262.
HAUSARZT PRAXIS 2023; 18(2): 20–21
CARDIOVASC 2023; 22(1): 26–28











