A resistência às substâncias antibióticas está a aumentar em todo o mundo. Isto leva a uma perda gradual da eficácia de muitos antibióticos e torna o tratamento de muitas infecções mais difícil. A resistência aos antibióticos de β-lactam nas bactérias Gram-negativas está frequentemente associada à produção de β-lactamases. Alguns dos esforços para ultrapassar este mecanismo de resistência comum têm sido bem sucedidos. Para além das substâncias que já foram aprovadas, várias substâncias activas estão actualmente a ser investigadas em ensaios clínicos.
A crescente resistência aos antibióticos dos agentes patogénicos bacterianos é um grande problema. Isto diz respeito tanto aos cuidados em regime de internamento como de ambulatório, especialmente porque cerca de 80% dos antibióticos são receitados em regime ambulatório [1,2]. As estratégias para combater a resistência aos antibióticos podem ser implementadas como parte de programas de administração de antibióticos ou de forma independente. A Sociedade Suíça de Doenças Infecciosas publica directrizes sobre vários tipos de infecções e foram lançados numerosos projectos sobre o tema da resistência aos antibióticos (caixa) [3]. “As bactérias Gram-negativas multi-resistentes continuam a ser as mais difíceis de tratar, porque existem apenas algumas boas opções para isso”, explicou a Profª Sarah Tschudin Sutter, MD, Clinic for Infectiology & Hospital Hygiene do Hospital Universitário de Basileia [4]. Os agentes patogénicos resistentes ao Carbapenem Acinetobacter baumannii, Pseudomonas aeruginosa resistente ao carbapenem e cefalosporina de terceira geração foram classificados pela OMS como “agentes patogénicos de primeira linha” na lista de prioridades para o desenvolvimento de novos antibióticos.
|
O Centro Suíço de Resistência Antibiótica (ANRESIS), um sistema nacional de vigilância e unidade de investigação para a resistência e o consumo de antibióticos, oferece, entre outras coisas, uma visualização interactiva dos últimos dados de resistência em [15]. O Departamento de Assuntos Internos e o Departamento de Assuntos Económicos, Educação e Investigação são responsáveis pela implementação da estratégia nacional de resistência aos antibióticos (StAR) [17]. A StAR persegue o objectivo de preservar a longo prazo a eficácia dos antibióticos para os seres humanos e animais. Entre outras coisas, são também feitas recomendações específicas relativas a medidas de higiene para melhorar a higiene na cozinha, a fim de evitar a transmissão de bactérias resistentes aos antibióticos através de alimentos vegetais ou animais. Isto está em conformidade com a abordagem “Uma Saúde” da Organização Mundial de Saúde (OMS) para combater as bactérias resistentes aos antibióticos [18]. O Centro Europeu de Controlo de Doenças (ECDC) oferece um “ATLAS de Vigilância de Doenças Infecciosas” na sua página inicial. Este instrumento torna possível o levantamento da resistência aos antibióticos em diferentes países para numerosos agentes patogénicos bacterianos importantes [16]. A investigação está a ser realizada em todo o mundo em numerosos projectos de estudo sobre os temas dos mecanismos de resistência e o desenvolvimento de novos antibióticos. |
Os mecanismos de resistência mais importantes e as necessidades não satisfeitas
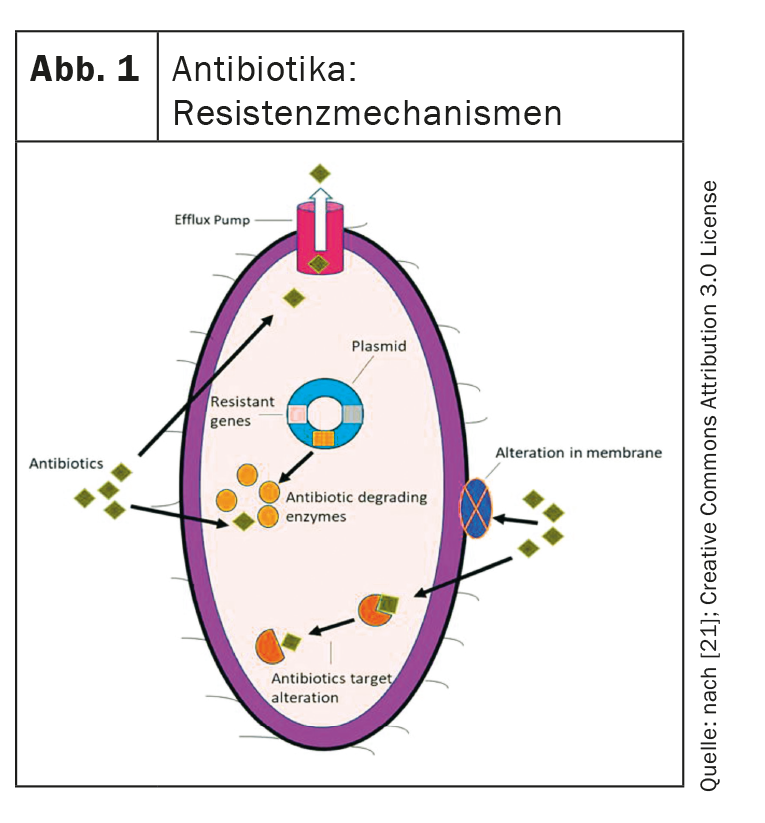
Estes são os quatro mecanismos de resistência mais importantes que as bactérias podem desenvolver e que os novos antibióticos devem ultrapassar (Fig. 1) [4,21,22]:
- Perda de poros: As mutações nos genes dos poros levam à perda de poros e, portanto, à redução da permeabilidade da membrana celular bacteriana. Isto dificulta a absorção dos antibióticos.
- Bombas de efluxo: As bombas de efluxo são também um factor importante. Estes transportam antibióticos para extracelulares e podem ser upregulados.
- Modificação do alvo: O local de ligação dos antibióticos pode ser modificado de tal forma que os antibióticos já não possam exercer o seu efeito.
- Enzimas hidrolisantes: estas podem quebrar enzimaticamente os antibióticos.
A maioria das substâncias antibióticas actualmente disponíveis são substâncias produzidas pelos próprios fungos e bactérias; existem apenas algumas substâncias sinteticamente produzidas entre elas. Nos últimos 10-15 anos, quase nenhum antibiótico novo entrou no mercado. No contexto do desenvolvimento da resistência aos antibióticos, há uma necessidade urgente de desenvolvimento de novos agentes antibióticos [5].
Resistência a β-lactamases: um problema mundial
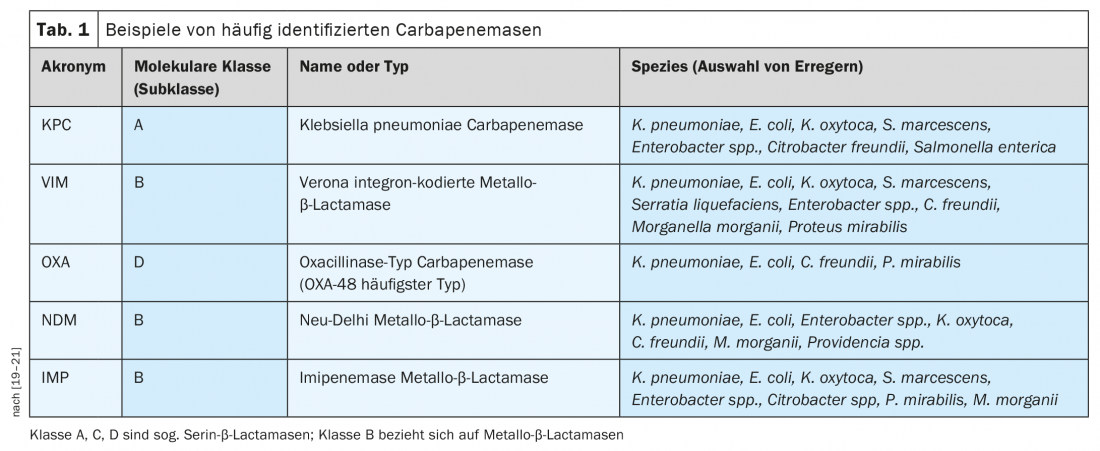
A Organização Mundial de Saúde (OMS) emitiu uma declaração sobre a prioridade do desenvolvimento de antibióticos [6]. Isto mostra que existe uma grande necessidade em particular de antibióticos com eficácia em Gram-negativos patogénicos para combater a resistência ao carbapenem [6]. A resistência aos antibióticos β-lactam em bactérias Gram-negativas está frequentemente associada à produção de β-lactamases, incluindo as lactamases de espectro alargado β-lactamases (ESBL ) e carbapenemases (Tab. 1), que pertencem a diferentes classes moleculares [7]. As carbapenemases são enzimas bacterianas cujo desenvolvimento de resistência aos antibióticos representa uma ameaça existente ou potencial para a saúde pública [8]. O grupo ESBL é homogéneo, ou seja, têm os mesmos substratos, o que é uma vantagem em termos de tratamento. Em contraste, as carbapenemases são um grupo muito heterogéneo de enzimas com diferentes propriedades químicas e diferentes substratos. “Assim, dificilmente é possível encontrar substâncias eficazes para todas as diferentes classes de carbapenemases”, disse o orador [4]. As várias carbapenemases estão generalizadas a nível mundial, incluindo na Europa. Em particular, Pseudomonas aeruginosa (CRPA) resistente ao carbapenem e Acinetobacter baumannii (CRAB) resistente ao carbapenem podem exprimir diferentes mecanismos de resistência simultaneamente.
Quais são as estratégias de solução?
Muitas das substâncias que entraram no mercado nos últimos anos são modificações de antibióticos já disponíveis ou combinações de β-lactams com inibidores de lactamase de β. Infelizmente, não há uma nova classe de antibióticos, diz o Prof. Tschudin Sutter. Em termos de β-lactams, cefiderocol – uma cefalosporina com um novo mecanismo de acção que foi aprovado pela Agência Europeia de Medicamentos (EMA) em 2020 para o tratamento de infecções causadas por agentes patogénicos Gram-negativos aeróbicos em adultos. [9]. Cefiderocol é estruturalmente uma cefalosporina à qual foi acoplada uma cadeia lateral com uma estrutura de catecol. As cadeias laterais na molécula aumentam a estabilidade contra β-lactamases. O chamado siderophore cefalosporin cefiderocol caracteriza-se pela sua capacidade de ligar ferro trivalente. As bactérias Gram-negativas aeróbias precisam de ferro e têm um sistema de transporte activo de sideróforos carregados de ferro para satisfazer as suas necessidades. A Cefiderocol utiliza isto para passar através da membrana celular externa e depois destruir a célula, perturbando a síntese da parede celular [10]. Cefiderocol tem uma elevada estabilidade hidrolítica em quase todas as beta-lactamases β, incluindo beta-lactamases de espectro alargado (ESBL), enzimas AmpC e serinas e metallo-carbapenemases.
Estão também disponíveis resultados promissores para o tebipenem antibiótico oral. Num estudo da fase III publicado no New England Journal of Medicine , o tebipenem (oral) foi considerado não-inferior ao ertapenem (i.v.) para o tratamento de infecções complicadas do tracto urinário e mostrou um perfil de efeito secundário comparável [11].
São também necessárias novas opções de tratamento que possam superar a resistência contra o patogénico Gram-negativo Pseudomonas aeruginosa. Os mecanismos mais comuns de resistência aos antibióticos β-lactam na P. aeruginosa são o aumento da expressão intrínseca de β-lactamases, a aquisição de novas β-lactamases, o aumento do efluxo da bomba de efluxo e a perda ou diminuição da expressão dos poros na membrana celular, o que reduz ou impede a absorção de antibióticos [12]. Entre outras coisas, os doentes com fibrose cística precisam de antibióticos eficazes contra infecções crónicas com P. aeruginosa. A levofloxacina inalada mostrou uma tendência para melhorar a função pulmonar e um intervalo de tempo mais longo para exacerbar esta população de doentes em comparação com a tobramicina [13].
Delafloxacina é também uma quinolona e foi aprovada na Suíça em 2020 como antibiótico de reserva para o tratamento de infecções bacterianas agudas da pele e da estrutura da pele (ABSSSI) [14] Os efeitos baseiam-se na inibição da topoisomerase bacteriana IV e da girose de ADN. A fluoroquinolona tem propriedades bactericidas contra bactérias gram-positivas e gram-negativas e é também eficaz contra germes problemáticos, tais como Klebsiella pneumoniae, MRSA, Pseudomonas aeruginosa. Delafloxacina tem um carácter aniónico a pH neutro e está principalmente na forma não carregada a pH ligeiramente ácido, o que é uma diferença de outras fluoroquinolonas, que estão presentes como cátions a pH ácido e principalmente como zwitterions a valores mais elevados e cuja actividade diminui no ambiente ácido [23].
Congresso: medArt
Literatura:
- Weber R, Chmiel C: Infektiologie – Therapieempfehlungen, Aktualisiert am: 12/2021, www.medix.ch/media/gl_infektiologie_therapieempfehlungen_06.2021_23.6.21_mh_1.pdf, (último acesso 31/08/2022).
- FOPH: Como é que os antibióticos são prescritos na Suíça actualmente? www.bag.admin.ch/bag/de/home/krankheiten/infektionskrankheiten-bekaempfen/antibiotikaresistenzen/wie-werden-heute-in-der-schweiz-antibiotika-verschrieben.html, (último acesso 31.08.2022)
- Sociedade Suíça de Infecciologia, www.ssi.guidelines.ch, (último acesso 31.08.2022)
- “New Antibiotics”, Prof. Dr. med. Sarah Tschudin Sutter, medArt 20.-24.06.2022
- BAG: Framework conditions in the field of antibiotics, www.bag.admin.ch/bag/de/home/strategie-und-politik/nationale-gesundheitsstrategien/strategie-antibiotikaresistenzen-schweiz/rahmenbedingungen-im-bereich-der-antibiotika.html, (último acesso 31.08.2022)
- Tacconelli E, et al: Discovery, research, and develop ment of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet Infect Dis 2018; 18: 318-327.
- Bush K, Bradford PA: Interacção entre β-lactamases e os novos inibidores da lactamase β-lactamase. Nat Rev Microbiol 2019; 17(5): 295-306.
- BAG: Enterobactérias produtoras de Carbapenemase- (CPE), www.bag.admin.ch/bag/de/home/krankheiten/krankheiten-im-ueberblick/antibiotikaresistente-bakterien.html, (último acesso 31.08.2022)
- Informação sobre drogas, www.ema.europa.eu/en/documents/product-information/fetcroja-epar-product-information_de.pdf, (último acesso 31.08.2022)
- Rössler A: “Cefiderocol: Novo antibiótico para vencer a resistência”, Pharmazeutische Zeitung, 19.01.2021
- Eckburg PB, et al: Hidrobromida Tebipenem Pivoxil Oral em Infecção de Trato Urinário Complicado. N Engl J Med 2022; 386(14): 1327-1338.
- Poole K: Pseudomonas aeruginosa: Resistência ao máximo. Microbiol frontal 2011(2): 1-13.
- Elborn JS, et al: Um ensaio fase 3, open-label, randomizado para avaliar a segurança e eficácia da solução inalatória de levofloxacina (APT-1026) versus solução inalatória de tobramicina em doentes estáveis com fibrose cística. J Cyst Fibros 2015; 14(4): 507-514.
- Informação sobre drogas, www.swissmedicinfo.ch/default.aspx, (último acesso 31.08.2022)
- ANRESIS, www.anresis.ch/de, (último acesso 31.08.2022)
- Centro Europeu de Prevenção e Controlo das Doenças (CEPCD), www.ecdc.europa.eu/en/surveillance-and-disease-data, (acedido pela última vez em 31.08.2022)
- Estratégia Antibiotic Resistance Switzerland (StAR), https://www.blv.admin.ch/blv/de/home/das-blv/strategien/nationale-strategie-antibiotikaresistenzen.html, (último acesso 31.08.2022)
- Walsh TR: Uma abordagem de saúde única à resistência antimicrobiana. Nat Microbiol. 2018; 3: 854-855.
- Magiorakos AP, et al: Medidas de Prevenção e Controlo de Infecções e Ferramentas para a Prevenção da Entrada de Carbapenem-Resistente. Antimicrob Resistam Controlo de Infecções 2017; 6: 113. https://dx.doi.org/10.1186/s13756-017-0259-z.
- Tzouvelekis LS, et al: Carbapenemases in Klebsiella Pneumoniae and Other Enterobacteriaceae: An Evolving Crisis of Global Dimensions. Clin Microbiol Rev 2012; 25(4): 682-707. https://dx.doi.org/10.1128/CMR.05035-11.
- Swissnoso, www.swissnoso.ch/fileadmin/swissnoso/Dokumente/5_Forschung_und_Entwicklung/8_Swissnoso_Publikationen/211115_StAR_Teil_II_DE_MDRO-non-outbreak_FINAL.pdf, (último acesso 31.08.2022)
PRÁTICA DO GP 2022; 17(9): 20-21