A mudança do estilo de vida é o primeiro passo no tratamento da diabetes tipo 2. A dieta e os hábitos alimentares desempenham, por isso, um papel muito importante neste domínio. Tendo em conta o grande número de dietas, coloca-se a questão de saber qual delas pode combater eficazmente a doença. Cientistas holandeses investigaram a forma como a aplicação regular de uma dieta que imita o jejum de 5 dias (FMD ) nos cuidados primários regulares da diabetes tipo 2 afecta o controlo metabólico e a prevenção de complicações.
Os programas regulares de FMD com a duração de 4-7 dias consecutivos são concebidos para imitar os efeitos fisiológicos do jejum só de água, minimizando o seu impacto. Permitem que os participantes façam refeições ligeiras durante o período de jejum e restringem-no a um número limitado de dias. Esta dieta de baixa energia, baseada em plantas, consiste principalmente em hidratos de carbono complexos e gorduras saudáveis. Devido à natureza vegetal da dieta, é pobre em proteínas, aminoácidos essenciais e açúcar e relativamente rica em fibras e gorduras insaturadas. Para além do baixo teor energético, estas caraterísticas são importantes para os efeitos pretendidos da dieta que imitam o jejum (ou seja, redução dos níveis séricos de glicose, IGF-1 e insulina, aumento da proteína-1 de ligação ao fator de crescimento semelhante à insulina e dos corpos cetónicos, e redução dos marcadores inflamatórios). Em indivíduos saudáveis (sem diabetes), foi demonstrado que três ciclos mensais de 5 dias de dieta da febre aftosa reduzem a massa gorda, a pressão sanguínea, os triglicéridos e a glicemia em jejum, particularmente em indivíduos com níveis elevados destes factores de risco na linha de base.
A Dr.ª Elske L. van den Burg do Departamento de Saúde Pública e Cuidados Primários, Centro Médico da Universidade de Leiden (LUMC), Países Baixos, e colegas realizaram um ensaio aleatório, controlado e cego para investigar a resposta clínica a ciclos mensais de febre aftosa de 5 dias como adjuvante dos cuidados regulares em comparação com os cuidados regulares isolados em pessoas com diabetes tipo 2 num contexto real, ou seja, sob supervisão e tratamento regulares do médico de família [1]. > <Os participantes elegíveis eram pessoas com diabetes tipo 2, um IMC ≥27 kg/m2 e uma idade entre os 18 e os 75 anos. >Para serem incluídos no estudo, os participantes também tinham de ter um valor de HbA1c de 48 mmol/mol (6,5%) e, independentemente do seu valorde HbA1c, ser tratados apenas com aconselhamento sobre o estilo de vida e/ou aconselhamento sobre o estilo de vida mais metformina como único agente de redução da glucose no sangue.
Controlos após 6 e 12 meses
Tanto o grupo de controlo como o grupo da febre aftosa receberam os cuidados habituais do seu médico de clínica geral. Estes incluíam uma avaliação clínica e bioquímica de três meses, aconselhamento sobre o estilo de vida, com a opção de consultar um nutricionista, e o ajustamento da medicação, se necessário. O ajuste da dose da medicação para baixar a glicose no sangue ficou inteiramente ao critério dos médicos de clínica geral, que se orientaram pelas diretrizes holandesas para o tratamento da diabetes tipo 2. O grupo de intervenção recebeu 12 ciclos de FMD em cinco dias consecutivos por mês, como complemento ao seu tratamento habitual. Os participantes foram contactados por telefone uma vez durante cada período de FMD para apoiar o seu cumprimento. A FMD (disponível comercialmente) consistia em produtos completos de substituição de refeições. Os ingredientes eram todos de origem vegetal e são geralmente considerados seguros. O conteúdo energético e a composição em macronutrientes eram os seguintes
- O primeiro dia continha cerca de 4600 kJ (cerca de 1100 kcal; 10% de proteínas, 56% de gorduras, 34% de hidratos de carbono complexos);
- Os dias 2-5 foram idênticos e forneceram cerca de 3150 kJ (cerca de 750 kcal; 9% de proteínas, 44% de gorduras, 47% de hidratos de carbono complexos).
A dieta dos participantes que pesavam mais de 100 kg foi complementada com uma barra de chocolate crocante por dia (aprox. 375 kJ/90 kcal) com uma composição de macronutrientes semelhante. O grupo de controlo recebeu apenas a alimentação habitual. O cumprimento do plano experimental foi verificado verbalmente todos os meses. Os resultados primários e secundários foram medidos na linha de base, 6 e 12 meses, e 3 semanas após o último ciclo de exercício físico para os participantes do exercício físico.
Os resultados primários foram as alterações na HbA1c e a dose de medicação para baixar a glucose no sangue em comparação com a linha de base. A pontuação do efeito da medicação (EEM) foi utilizada como uma medida indireta do tratamento com medicação para baixar a glicose no sangue. Os resultados secundários foram o peso corporal, o IMC, a gordura corporal total, o perímetro da cintura, a pressão arterial, a glucose plasmática em jejum, a insulina e os perfis lipídicos. Além disso, as concentrações plasmáticas de glicose e insulina em resposta a um teste oral de tolerância à glicose (oGTT) foram utilizadas para calcular o índice de Matsuda (que reflecte a sensibilidade à insulina) e o índice de disposição (que reflecte a secreção endógena de insulina). Os eventos adversos (EAs) foram registados em duas visitas presenciais aos 6 e 12 meses ou, no caso de EAs graves, comunicados imediatamente.
16% conseguiram interromper completamente a medicação para baixar a glicose
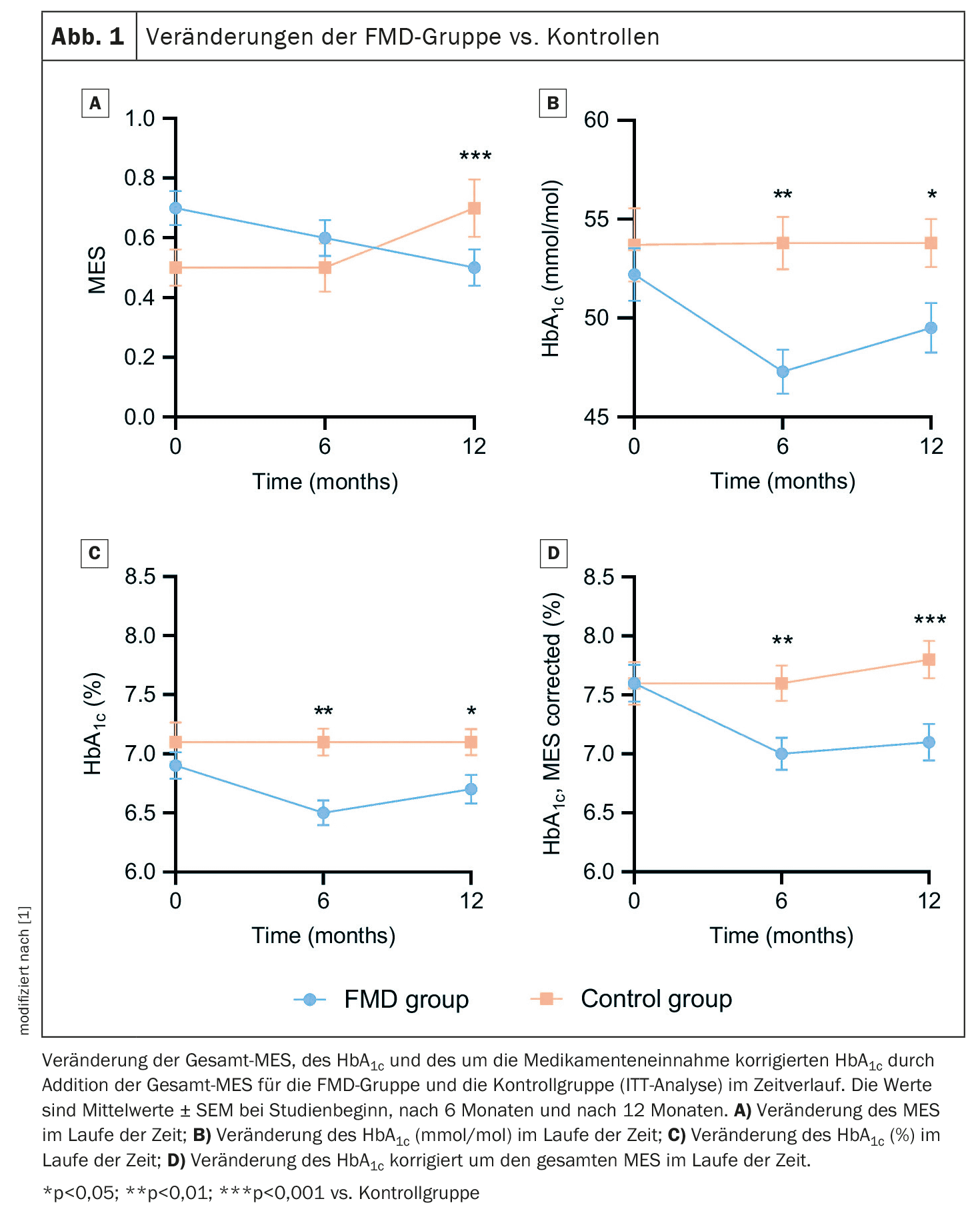
Estavam disponíveis dados de 49 participantes na FMD e 43 indivíduos de controlo para a análise de intenção de tratamento (ITT). O uso de medicação para baixar a glicose, medido pelo MES, diminuiu no grupo FMD de 0,7 ± 0,4 (média ± desvio padrão, DP) na linha de base para 0,5 ± 0,4 aos 12 meses, enquanto aumentou de 0,5 ± 0,4 para 0,7 ± 0,6 no grupo de controlo. <Isto resultou num efeito de tratamento estimado ajustado de -0,3 (IC 95% -0,4 a -0,2; p 0,001)(Fig. 1A). Os resultados após 6 meses foram semelhantes. Os medicamentos para baixar a glicose foram completamente descontinuados em 16% (n=7) dos participantes no grupo da FMD e em 5% (n=2) dos participantes do controlo (p=0,16), enquanto que foram prescritos medicamentos adicionais em 2% (n=1) do grupo da FMD e em 26% (n=10) dos controlos (p=0,006). Os níveis de HbA1c diminuíram de 52,2 ± 9,3 mmol/mol (6,9 ± 0,8%) (média ± DP) na linha de base para 49,5 ± 8,2 mmol/mol (6,7 ± 0,8%) aos 12 meses no grupo FMD. Estes aumentaram no grupo de controlo, resultando em efeitos de tratamento estimados ajustados de -3,2 mmol/mol (IC 95% -8,0 a -2,0) e -0,3% (IC 95% -0,6 a -0,0) (p=0,04) (Fig. 1B+C).
Como as medidas de resultados primários, a medicação para baixar a glicose no sangue e a HbA1c, se influenciam mutuamente, foram combinadas de duas formas diferentes para refletir melhor o controlo glicémico, explicam os autores. <A HbA1c ajustada para o tratamento medicamentoso (%) diminuiu de 7,6 ± 1,1% (média ± DP) na linha de base para 7,1 ± 1,0% aos 12 meses no grupo FMD adicionando a TRS total, mas aumentou de 7,6 ± 1,2% na linha de base para 7,8 ± 1,0% no grupo de controlo, dando um efeito de tratamento estimado ajustado de -0,6% (IC 95% -0,9 a -0,3; p 0,001) (Fig. 1D). <Além disso, a gestão glicémica melhorou em 53% dos participantes na FMD vs. 8% nos controlos, manteve-se estável em 23% vs. 33% e piorou em 23% vs. 59% (p 0,001).
Melhoria da resistência à insulina
Os autores sublinham que a proporção de participantes em que a medicação para baixar a glicose foi reduzida foi oito vezes maior no grupo FMD (40%) do que no grupo de controlo (5%). Curiosamente, os níveis de HbA1c diminuíram em ≥5 mmol/mol (0,5%) em 42% dos participantes do grupo FMD, apesar da redução da medicação, enquanto o mesmo aconteceu em apenas 15% dos controlos. Além disso, o peso corporal médio, a percentagem de gordura corporal e o perímetro da cintura diminuíram mais nos participantes do programa FMD do que nos participantes do grupo de controlo, enquanto a massa isenta de gordura não se alterou. As alterações antropométricas foram acompanhadas por uma melhoria da resistência à insulina, tal como demonstrado pelo índice de Matsuda.
Em geral, o programa de dieta foi bem tolerado, como demonstrado pelo número semelhante de eventos adversos (ligeiros a moderados) e taxas de interrupção nos grupos. No entanto, é de salientar que foram comunicadas algumas queixas (ligeiras) durante as chamadas telefónicas efectuadas durante a dieta, o que levou cinco participantes a interromperem a dieta. De acordo com os autores, poderá ser aconselhável avisar os participantes da dieta FMD sobre possíveis sinais transitórios de défice de energia (fadiga, tonturas, dores de cabeça). Apesar destes problemas, a maioria dos participantes manteve-se motivada e aderiu ao programa.
Os autores concluem que a integração de um programa mensal de DFA, sem conselhos adicionais sobre o estilo de vida, nos cuidados regulares de pessoas com diabetes tipo 2 que tomam metformina, reduz a necessidade de medicação para baixar a glicose no sangue e diminui os níveis de HbA1c.
Mensagens para levar para casa
- A utilização regular de FMD reduz significativamente a necessidade de medicação para baixar a glucose no sangue e melhora o valor de HbA1c em comparação com o tratamento padrão regular.
- A utilização regular de FMD melhora o controlo da glicemia em comparação com o tratamento regular numa proporção significativa de participantes.
- A utilização regular de FMD reduz o peso corporal, o IMC, o perímetro da cintura e a percentagem de gordura corporal em comparação com os cuidados regulares isolados.
- A integração de programas de FMD nos cuidados primários de rotina para a diabetes tipo 2 melhora as leituras antropométricas, facilita o controlo glicémico e reduz o peso da medicação sem a necessidade de alterações (adicionais) do estilo de vida diário.
Literatura:
- van den Burg EL, Schoonakker MP, van Peet PG, et al.: Integration of a fasting-mimicking diet programme in primary care for type 2 diabetes reduces the need for medication and improves glycaemic control: a 12-month randomised controlled trial. Diabetologia 2024; 67: 1245–1259; doi: 10.1007/s00125-024-06137-0.
InFo DIABETOLOGIE ENDOKRINOLOGIE 2024; 1(3): 18–20