Passaram quarenta anos desde a publicação histórica de Warren e Marshall sobre a importância da Helicobacter pylori como factor desencadeante da gastrite. Durante este tempo, a compreensão da relação entre a infecção por H. pylori da mucosa gástrica e as doenças inflamatórias e malignas do estômago e as doenças extragástricas tem crescido de forma constante. Em 2022, foi publicada a quarta versão da directriz S2k “Helicobacter pylori e úlcera gastroduodenal” da Sociedade Alemã de Doenças Digestivas e Metabólicas. As inovações mais relevantes são aqui resumidas de forma breve, concisa e clinicamente aplicável.
Passaram quarenta anos desde a publicação histórica de Warren e Marshall sobre a importância da Helicobacter pylori como factor desencadeante da gastrite. Durante este tempo, a compreensão da relação entre a infecção da mucosa gástrica pelo H. pylori e as doenças inflamatórias e malignas do estômago e as doenças extragástricas tem crescido de forma constante. As indicações para a realização de testes e as modalidades de terapia de erradicação têm sido continuamente desenvolvidas. Paralelamente, os conhecimentos actuais foram resumidos em orientações para o clínico. Em 2022, foi publicada a quarta versão da directriz S2k “Helicobacter pylori e úlcera gastroduodenal” da Sociedade Alemã de Doenças Digestivas e Metabólicas [1]. Este artigo tem como objectivo resumir as inovações mais relevantes de uma forma breve, concisa e clinicamente aplicável.
Evolução histórica
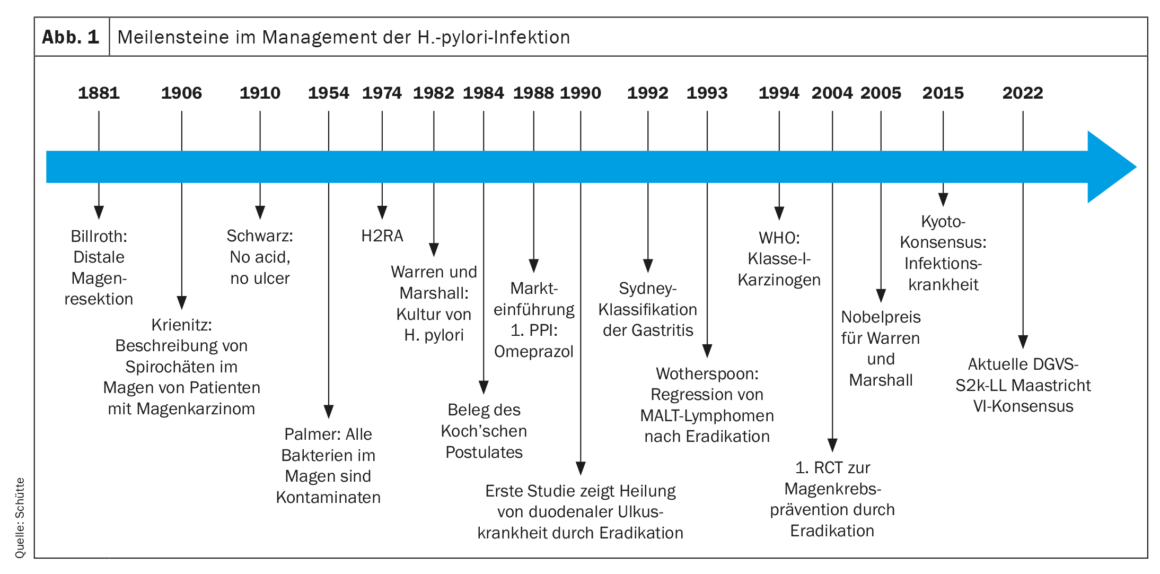
O patologista W. Krienitz de Halberstadt já tinha descrito espiroquetas no estômago de pacientes com carcinoma gástrico em 1906. No entanto, até aos anos 80, a úlcera péptica era considerada uma doença provocada exclusivamente pelo ácido (sem ácido, sem úlcera, Schwarz 1910) e as bactérias descobertas no estômago por outros patologistas nas décadas seguintes eram consideradas contaminantes. Finalmente, em 1982, Warren e Marshall conseguiram cultivar a H. pylori e, na auto-experimentação que se seguiu, conseguiram provar o papel desta bactéria no desenvolvimento da gastrite, cumprindo os postulados de Koch. Finalmente, nos anos noventa do século XX, os primeiros estudos demonstraram a cura da úlcera duodenal através da terapia de erradicação. Em 1993, foi demonstrado que a terapia de erradicação também pode curar os linfomas MALT. Com base em experiências com animais e em dados clínicos epidemiológicos, a H. pylori foi classificada como agente cancerígeno de classe I pela OMS pela primeira vez em 1994. Depois de as indicações para a terapia de erradicação terem sido alargadas para incluir doenças extragástricas nos anos seguintes, o efeito positivo da terapia de erradicação na prevenção do cancro gástrico foi demonstrado pela primeira vez num ensaio clínico aleatório em 2004. Finalmente, a Conferência de Consenso de Quioto de 2015 assistiu a uma nova mudança de paradigma [2]. Desde então, a infecção da mucosa gástrica com H. pylori tem sido considerada uma doença infecciosa, mesmo que as pessoas infectadas não apresentem quaisquer sintomas ou complicações da infecção (Fig. 1). Isto implica a indicação de uma terapia de erradicação se o agente patogénico for detectado. Consequentemente, a indicação para a terapêutica de erradicação deve sempre preceder o exame da presença de uma infecção por H. pylori. Embora a prevalência da H. pylori varie significativamente a nível mundial e esteja a diminuir significativamente, especialmente nos países industrializados, 30-40% da população da Europa Central está infectada e quase metade da população mundial. Cerca de 80% dos indivíduos infectados permanecem assintomáticos, embora todos os indivíduos infectados desenvolvam gastrite com potencial para desenvolver complicações [3].
Factores de risco para a doença ulcerosa
A infecção do estômago com H. pylori e o uso de AAS ou AINEs não selectivos (ns) são os factores de risco mais importantes para o desenvolvimento de úlceras ventriculares ou duodenais [4]. Por conseguinte, na presença de uma úlcera péptica ventricular ou duodenal, devem ser efectuados testes para detectar a presença de infecção por H. pylori. A terapia de erradicação é superior a outros tratamentos medicamentosos para úlceras duodenais positivas para H. pylori. Também previne eficazmente as recorrências de úlceras gástricas e duodenais [5]. Além disso, existem outros factores de risco não relacionados com o H. pylori para o desenvolvimento de úlceras gastroduodenais ou das suas complicações. Os factores de risco estabelecidos para o desenvolvimento de úlceras gastroduodenais são uma idade superior a 60 anos, uma história de úlceras, a utilização de nsNSAR ou AAS, bem como doenças concomitantes graves, stress psicossocial grave e tabagismo. Além disso, a utilização de SSRIs, P2Y12-inibidores, esteróides sistémicos e anticoagulantes (DOAK, VKA, heparinas, inibidores selectivos do factor X), bem como doenças concomitantes graves, como factores de risco para a ocorrência de complicações da úlcera. A directriz actualizada recomenda a procura de outras causas raras de úlcera gastroduodenal na ausência de infecção por H. pylori ou de medicação com AAS e/ou AINE. O diagnóstico diferencial de possíveis causas adicionais para a ocorrência de úlceras gastroduodenais é amplo e inclui doenças inflamatórias (por exemplo, gastroenterite eosinofílica, doença de Crohn, doença de Behçet), outras infecções (por exemplo, CMV, HSV, micobactérias, Treponema pallidum), isquémia ou necrose (por exemplo após terapias transarteriais, como a quimioterapia ou a radioembolização), outros medicamentos com risco acrescido (por exemplo, bisfosfonatos, quimioterapia, espironolactona), tumores neuroendócrinos (por exemplo, gastrinoma), obstrução, condições pós-operatórias, doenças graves (por exemplo, ARDS ou choque) ou infiltração tumoral, por exemplo, por um carcinoma pancreático.
Outras indicações para diagnóstico e terapia
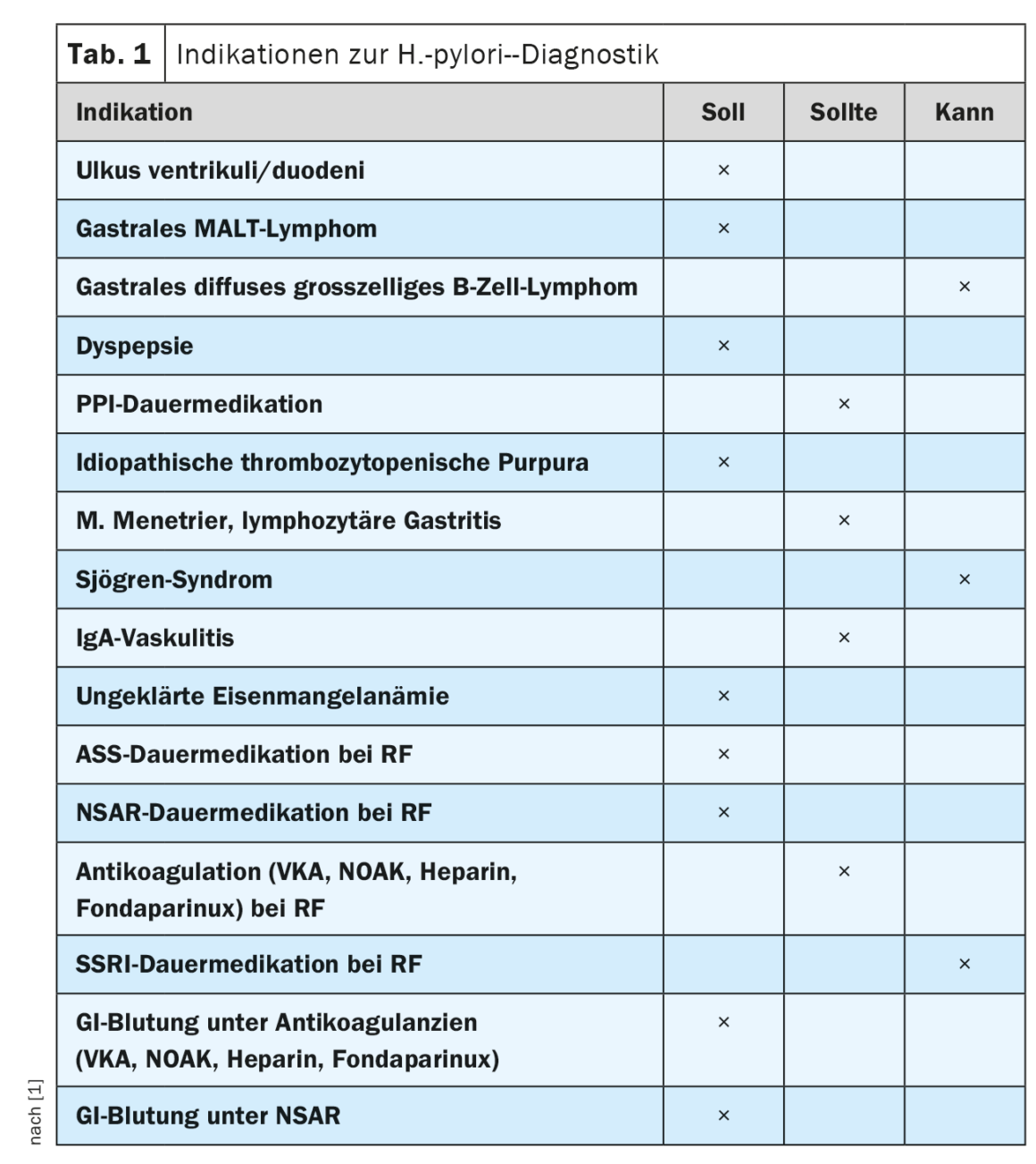
Devido ao aumento do risco de desenvolvimento de úlcera, a directriz actualizada confirma a recomendação de testar a infecção por H. pylori antes da medicação planeada a longo prazo com AAS ou nsNSAR na presença de outros factores de risco. Como nova recomendação, o teste para a infecção por H. pylori foi incluído como parte do esclarecimento de queixas dispépticas. Este pode ser efectuado de forma não invasiva em doentes com menos de 50 anos e que não apresentem quaisquer sintomas de alarme, como perda de peso, disfagia ou sinais de hemorragia. A razão para tal é que a eliminação da infecção por H. pylori em doentes com sintomas dispépticos prolongados e achados endoscópicos negativos leva a uma melhoria sustentada dos sintomas em até 10% dos casos. No entanto, em doentes com mais de 50 anos de idade ou com sintomas de alarme, a esofagogastroduodenoscopia está indicada para excluir dispepsia orgânica, especialmente maligna [6].
Foi também incluída uma nova recomendação para testar a H. pylori em doentes com terapêutica PPI planeada ou em curso a longo prazo. A razão para tal é que podem desenvolver-se alterações atróficas na mucosa do corpo gástrico e gastrite dominante por H. pylori durante a terapêutica prolongada com IBP. Em doentes positivos para H. pylori, foi observada uma progressão acrescida das alterações inflamatórias pré-existentes durante a terapêutica prolongada com IBP. Além disso, os efeitos sinérgicos da terapêutica com IBP e da infecção por H. pylori resultam no aumento da presença de germes não-H. pylori na mucosa gástrica. Postula-se que estes factores aumentam o risco de ocorrência de carcinoma gástrico. As indicações actuais das directrizes para o teste de H. pylori estão resumidas no Quadro 1.
A infecção da mucosa gástrica com H. pylori é o factor de risco mais importante para o desenvolvimento de carcinoma gástrico e causa mais de um terço dos tumores malignos provocados por infecções. Cerca de 90% dos carcinomas gástricos não-cárdicos estão associados à infecção por H. pylori [7]. Neste contexto, os carcinomas gástricos desenvolvem-se através de um processo de várias etapas que progride de gastrite induzida por H. pylori para gastrite atrófica multifocal, metaplasia intestinal e, finalmente, displasia para carcinoma (cascata de Correa). Por conseguinte, as directrizes internacionais recomendam a vigilância endoscópica de doentes com lesões de alto risco (directrizes MAPS [8]). No entanto, uma estratégia de rastreio e tratamento só provou ser rentável em regiões do mundo com elevada prevalência de H. pylori e incidência intermédia ou elevada de carcinoma gástrico [9]. Estas condições não se aplicam à Europa Central. No entanto, existem populações de risco para as quais o rastreio da infecção por H. pylori está indicado. Só recentemente, um ensaio clínico prospectivo e aleatório que incluiu familiares de primeiro grau positivos para H. pylori de doentes com cancro gástrico confirmou que uma terapia de erradicação bem sucedida reduz o risco de cancro gástrico em 73%. [10]. A terapia de erradicação é igualmente eficaz na prevenção do carcinoma metacrónico em doentes que tenham sido tratados curativamente para o carcinoma gástrico no passado através de ressecção gástrica parcial ou procedimentos endoscópicos. Uma terapia de erradicação bem sucedida reduz o risco de cancro gástrico metacrónico em 50% num recente ensaio clínico prospectivo e aleatório [11]. Como nova recomendação, foi, portanto, incluído na directriz actualizada que todas as pessoas com um risco aumentado de cancro gástrico devem ser testadas para o H. pylori, que deve ser oferecido principalmente por biópsia endoscópica a partir dos 40 anos de idade. Esta estratégia de rastreio e tratamento destina-se a abranger como população de risco os familiares em primeiro grau de doentes com cancro gástrico, pessoas nascidas e/ou criadas em áreas de elevada prevalência de H. pylori e áreas de elevada incidência de cancro gástrico (Ásia, Europa de Leste, América Central e do Sul), doentes com gastrite atrófica avançada com ou sem metaplasia intestinal e doentes com neoplasia gástrica prévia.
Como diagnosticar?
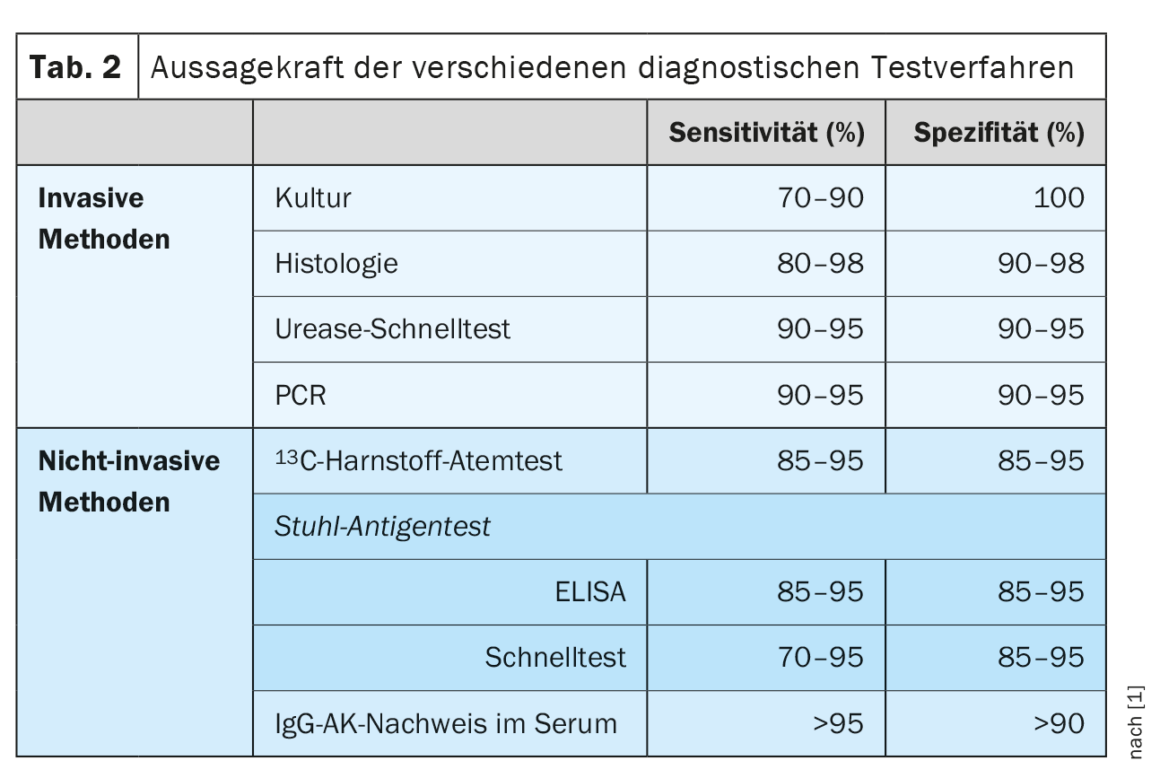
Para testar a presença de infecção por H. pylori, são utilizados testes invasivos (histologia, teste rápido da urease, cultura, PCR) e não invasivos (Estão disponíveis testes respiratórios com 13C-urease, detecção de antigénio nas fezes, anticorpos IgG no soro). Nenhum método isolado é absolutamente exacto e o risco de resultados falsos positivos aumenta com a diminuição da prevalência da infecção por H. pylori nos países industrializados. (Tab. 2). Por conseguinte, as directrizes anteriores exigiam a detecção da infecção por H. pylori através de dois testes. A directriz actualizada define agora situações especiais que tornam desnecessário um segundo teste positivo. A detecção histológica de H. pylori em combinação com gastrite crónica activa é quase 100% específica. Da mesma forma, devido à elevada prevalência de H. pylori na presença de úlcera duodenal, um resultado positivo do teste é suficiente para diagnosticar a infecção por H. pylori. Uma cultura positiva de H. pylori a partir de biopsias gástricas é 100% específica por si só e é suficiente para indicar uma terapia de erradicação. No entanto, é importante conhecer as limitações dos métodos de teste. Por exemplo, os testes serológicos para detecção de anticorpos IgG contra a H. pylori não conseguem distinguir entre uma infecção activa e uma infecção já ocorrida, pelo que só têm valor em situações clínicas excepcionais. Do mesmo modo, as condições que conduzem a uma densidade bacteriana reduzida (por exemplo, terapêutica com IBP, utilização de antibióticos activos contra a H. pylori, atrofia da mucosa, hipocloridria e hemorragia digestiva alta aguda) conduzem a uma sensibilidade reduzida do teste. Para um diagnóstico fiável da H. pylori, recomenda-se, por conseguinte, manter um intervalo de duas semanas após a terapêutica com IBP e um intervalo de quatro semanas após a erradicação anterior ou outra terapêutica antibiótica antes da realização do teste.
Como tratar?
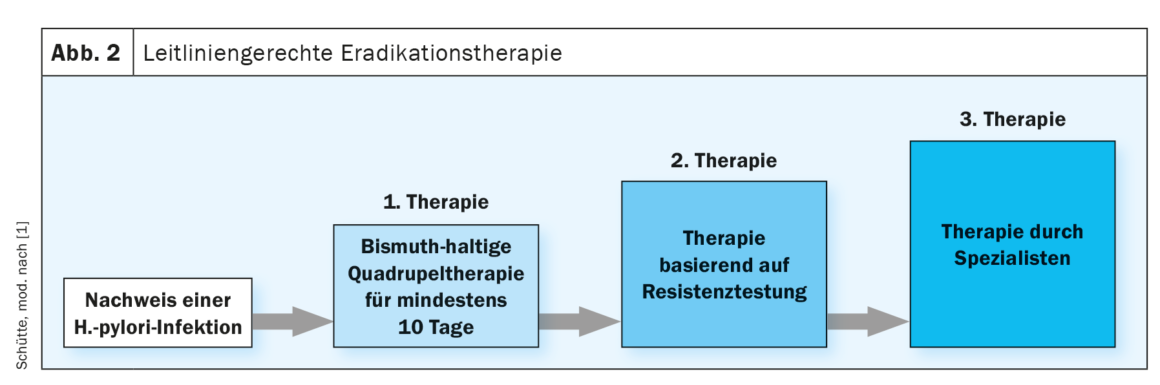
Desde a década de 1990, a terapêutica tripla com IBP, inicialmente durante sete dias, e desde 2010 durante 14 dias, tem sido considerada a terapêutica padrão estabelecida para a erradicação da H. pylori. O aumento da resistência aos antibióticos utilizados nas terapias triplas, especialmente a claritromicina, o metronidazol e as quinolonas, já teve influência nas recomendações terapêuticas da última directriz. Aqui, o conhecimento da taxa local de resistência à claritromicina foi assumido como um estrato para a selecção da terapêutica de erradicação de primeira linha. O novo aumento das taxas de resistência e a falta de dados clínicos sobre a situação de resistência local levaram agora a uma alteração relevante das recomendações terapêuticas na directriz actualizada. Assim, a terapia quádrupla contendo bismuto é agora recomendada durante pelo menos dez dias como terapia empírica de primeira linha. O mais tardar a partir da segunda linha, deve ser efectuada uma terapêutica de erradicação controlada pela susceptibilidade, o que, por conseguinte, exige a realização de testes de resistência. (Fig. 2). A actualização das directrizes sublinha agora a exclusão bióptica fiável do carcinoma gástrico na presença de uma úlcera ventricular através de um controlo endoscópico da cicatrização após 6-8 semanas. Do mesmo modo, as directrizes reforçam a recomendação de controlar o sucesso da erradicação, o que pode ser feito através de um teste respiratório com 13C-ureiaou de um teste de antigénio nas fezes, a não ser que haja indicação para controlar a OGD.
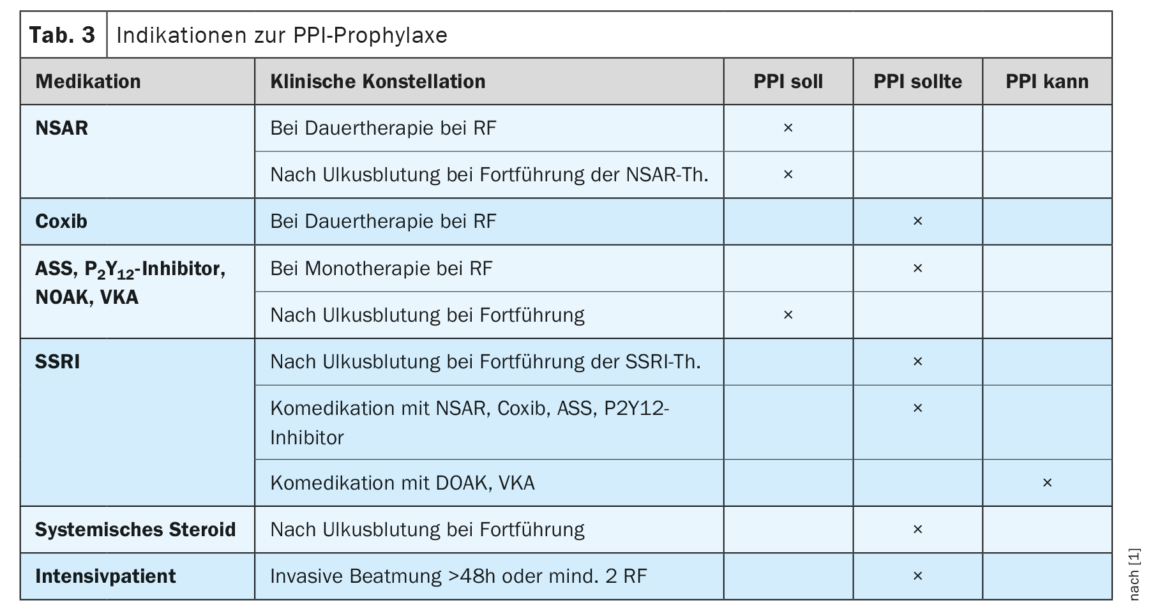
Prevenção da doença ulcerosa através da terapêutica com IBP em constelações de risco
Em situações clínicas seleccionadas, existe uma indicação para a terapêutica com IBP a longo prazo para prevenir a ocorrência de úlceras ou complicações de úlceras. A directriz actualizada concretiza agora estas recomendações (Tab. 3) . Neste contexto, a avaliação individual do risco para cada doente, em função do seu perfil de risco, é de importância crucial. Mesmo que se prove que a idade superior a 60 anos é um factor de risco, só isso não é suficiente como indicação para a profilaxia com IBP. Pelo contrário, devem ser acrescentados outros factores para o justificar. A recomendação de profilaxia com IBP é feita para os doentes que já sofreram uma complicação de úlcera enquanto tomavam AINE, AAS,inibidorP2Y12 ou outra anticoagulação. Do mesmo modo, se estiverem presentes outros factores de risco, a profilaxia com IBP deve ser administrada a doentes que estejam a fazer terapêutica prolongada com AINE. Os doentes que tomam dois anticoagulantes devem ser tratados profilaticamente com um IBP. São feitas recomendações menos fortes para outras constelações de risco. Estas incluem a terapêutica a longo prazo com um coxib na presença de factores de risco clínicos, a terapêutica a longo prazo com um AAS, uminibidorP2Y12, um NOAK ou um antagonista da vitamina K na presença de outros factores de risco, a utilização a longo prazo de um SSRI após uma complicação de úlcera ou em co-medicação com AINE, coxib, AAS ouinibidorP2Y12. Do mesmo modo, os doentes que tenham sofrido uma úlcera complicada durante a terapêutica com esteróides sistémicos e que necessitem de continuar a terapêutica com esteróides devem receber um IBP como medida profiláctica. > Para os doentes em cuidados intensivos, deve ser administrado um tratamento profiláctico com um IBP se a ventilação invasiva for efectuada durante mais de 48 horas ou se estiverem presentes pelo menos dois outros factores de risco (internamento de uma semana, sépsis, SDRA, insuficiência hepática ou renal, politraumatismo, queimadura, terapêutica com doses elevadas de esteróides).
Resumo
As directrizes alemãs actualizadas sobre a infecção por H. pylori e a doença ulcerosa seguem as directrizes internacionais e avaliam agora a infecção da mucosa gástrica por H. pylori como uma doença infecciosa, mesmo sem a presença de sintomas ou complicações [2,12]. Isto representa uma mudança de paradigma decisiva. A detecção de uma infecção por H. pylori implica uma indicação para a terapêutica. Formalmente, não existem contra-indicações para a terapêutica. A falta de convicção da necessidade de uma terapia de erradicação deve agora ser ponderada antes do diagnóstico. Para além de uma estratégia de rastreio e tratamento para prevenir o cancro gástrico em doentes com risco aumentado de o desenvolver, é feita uma recomendação rigorosa para testar a H. pylori em determinados grupos de doentes para prevenir úlceras ou complicações de úlceras. Do mesmo modo, as doenças extragástricas, como a púrpura trombocitopénica idiopática ou a anemia por deficiência de ferro inexplicada, indicam a realização de testes para detectar a presença de H. pylori.
Em consequência do aumento das taxas de resistência aos grupos de antibióticos utilizados na terapêutica de erradicação e da insuficiência de dados epidemiológicos a nível nacional sobre a situação local em matéria de resistência, as directrizes sublinham a necessidade de um tratamento com controlo da susceptibilidade a partir da segunda linha, o mais tardar. Reconhecendo a elevada taxa de resistência à claritromicina, a terapia de primeira linha deve ser efectuada com uma terapia quádrupla à base de bismuto durante pelo menos dez dias. Independentemente da infecção por H. pylori, grupos seleccionados de doentes beneficiam de uma terapêutica profilática com IBP para prevenir úlceras ou complicações de úlceras. Neste caso, a avaliação individual do perfil de risco de cada doente continua a ser crucial.
Mensagens Take-Home
- A infecção do estômago por Helicobacter pylori é uma doença infecciosa, mesmo sem sintomas ou complicações.
- A detecção da infecção indica uma terapia de erradicação.
- Para os doentes com um risco aumentado de carcinoma gástrico, recomenda-se
ser-lhe-á proposta uma estratégia de rastreio e tratamento. - A terapia de erradicação empírica deve ser efectuada na primeira linha com
Terapia quádrupla à base de bismuto. - Apenas em determinadas constelações de risco é recomendado um tratamento profiláctico com IBP.
A terapia para prevenir a doença ulcerosa é útil.
Literatura:
- Directriz S2k actualizada Helicobacter pylori e úlcera gastroduodenal da Sociedade Alemã de Gastroenterologia, Doenças Digestivas e Metabólicas (DGVS) 2022. Número de registo no AWMF: 021-001. Z Gastroenterol 2023; 61(5): 544-606.
- Sugano K, Tack J, Kuipers EJ, et al: Relatório de consenso global de Quioto sobre gastrite por Helicobacter pylori. Gut 2015; 64(9): 1353-1367.
- Malfertheiner P, Camargo MC, El-Omar E, et al: Infecção por Helicobacter pylori. Nat Rev Dis Primers 2023; 9(1): 19.
- Huang JQ, Sridhar S, Hunt RH: Role of Helicobacter pylori infection and non-steroidal anti-inflammatory drugs in peptic-ulcer disease: a meta-analysis. Lancet 2002; 359(9300): 14-22.
- Ford AC, Gurusamy KS, Delaney B, et al: Terapia de erradicação para úlcera péptica em pessoas Helicobacter pylori positivas. Cochrane Database Syst Rev 2016; 4(4): CD003840.
- Koletzko L, Macke L, Schulz C, Malfertheiner P: Erradicação da Helicobacter pylori na dispepsia: novas provas de benefício sintomático. Best Pract Res Clin Gastroenterol 2019; 40-41: 101637.
- Plummer M, de Martel C, Vignat J, et al: Peso global dos cancros atribuíveis a infecções em 2012: uma análise sintética. Lancet Glob Health 2016; 4(9): e609-e616.
- Pimentel-Nunes P, Libanio D, Marcos-Pinto R, et al: Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy 2019; 51(4): 365-388.
- Lee YC, Lin JT, Wu HM, et al: Análise custo-eficácia entre estratégias preventivas primárias e secundárias para o cancro gástrico. Cancer Epidemiol Biomarkers Prev 2007; 16(5): 875-885.
- Choi IJ, Kim CG, Lee JY, et al: História familiar de cancro gástrico e tratamento de Helicobacter pylori. N Engl J Med 2020; 382(5): 427-436.
- Choi IJ, Kook MC, Kim YI, et al: Terapia Helicobacter pylori para a prevenção do cancro gástrico metacrónico. N Engl J Med 2018; 378(12): 1085-1095.
- Malfertheiner P, Megraud F, Rokkas T, et al: Gestão da infecção por Helicobacter pylori: o relatório de consenso de Maastricht VI/Florença. Gut 2022; doi: 10.1136/gutjnl-2022-327745.
GP PRACTICE 2023; 18(5): 4-8