Os programas de rastreio aumentam a incidência das fases iniciais do cancro do pulmão. A cirurgia é ainda a primeira escolha de tratamento. Com uma linfadenectomia profunda, a ressecção anatómica do segmento é uma alternativa equivalente à lobectomia.
O cancro do pulmão é o segundo cancro mais comum na Suíça, com uma incidência de 11,9% nos homens e o terceiro mais comum nas mulheres, com uma incidência de 8,7%. A taxa de mortalidade é a mais elevada nos homens (21,9%) e a segunda mais elevada nas mulheres (15,4%) – e a tendência é ascendente [1]. Isto deve-se principalmente ao facto de o diagnóstico inicial ser muitas vezes feito numa fase avançada e de prognóstico pobre. É por esta razão que os programas de detecção precoce têm vindo à tona.
I-ELCAP (International Early Lung Cancer Action Program), o programa internacional para a detecção precoce do cancro do pulmão, existe desde 1992. Na Suíça, o Programa Nacional de Rastreio do Cancro do Pulmão faz parte do I-ELCAP e é implementado pela Fundação para o Diagnóstico do Pulmão, que foi criada em 2011 [2]. A ferramenta mais importante deste programa de rastreio é realizar um TAC de “baixa dose” em doentes de alto risco sem sintomas tais como tosse, hemoptise, dispneia, rouquidão, disfagia ou dores no peito. Isto inclui todos os doentes que anteriormente tiveram cancro do pulmão e que são agora considerados curados, todos os fumadores com mais de 50 anos, e ex-fumadores com pelo menos 20 packyears (py). Além disso, todos os doentes com mais de 50 anos de idade que já tenham tumores no nariz e garganta ou que estejam expostos a substâncias cancerígenas (amianto, fumo passivo, crómio, arsénico, etc.) ou que tenham pelo menos dois familiares em primeiro grau que sofram de cancro do pulmão (Tab. 1) [3].

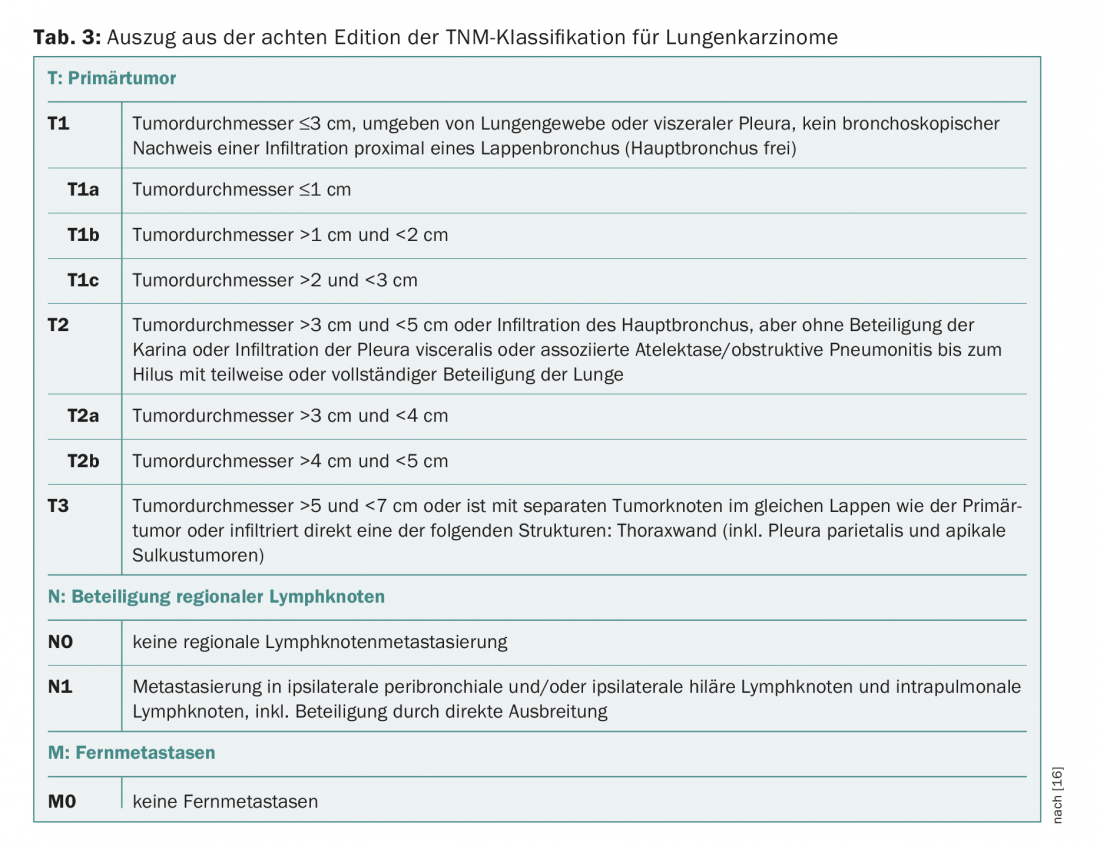
Caso se suspeite de cancro do pulmão de células não pequenas (NSCLC) como parte deste programa de rastreio, são efectuados outros esclarecimentos, tais como broncoscopia com EBUS e PET-CT. Os resultados são utilizados para a classificação na classificação TNM (“tumour node metastasis”). Dependendo da fase TNM, a fase clínica é IA, IB, IIA, IIB, IIIA, IIIB ou IV, classificada de acordo com a oitava edição do AJCC.
Uma vez que este artigo se destina a tratar da terapia das fases iniciais do carcinoma pulmonar, limitar-nos-emos a seguir a uma visão geral das fases IA, IB, IIA e IIB e a sua correspondente classificação TNM (Tab. 2 e 3).

Opções terapêuticas
Com base nesta encenação, os passos terapêuticos adicionais podem agora ser planeados no âmbito do conselho interdisciplinar obrigatório de tumores. Existem duas opções de tratamento diferentes para as fases iniciais I e II: Cirúrgica e não cirúrgica ou radioterapia. A fim de tomar uma decisão entre os dois, exames como os testes de função pulmonar, ergometria e, em casos críticos, espiroergometria em combinação com cintilografia de perfusão são realizados para avaliar o estado geral do paciente. Recomenda-se que se siga as directrizes da OMPE [4].
Radioterapia
A radioterapia é recomendada para pacientes que não são adequados para opções cirúrgicas devido a comorbilidades ou função pulmonar deficiente (VEF1 pós-operatório mínimo <1 litros). Dentro deste espectro terapêutico, há radioterapia estereotáxica (SBRT), radioterapia de ablação estereotáxica (SABR) e ablação por radiofrequência (RFA).
Embora a radioterapia tenha ganho consideravelmente em precisão e precisão nos últimos anos devido ao progresso técnico, tem uma desvantagem importante para além do perfil de efeito secundário conhecido: o tratamento só é realizado com base no estadiamento clínico sem confirmação patanatómica ou confirmação de diagnóstico. Ter em conta que a fase clínica é frequentemente incorrecta e a fase clínica não corresponde frequentemente à fase patológica [5]: Em 11-14% dos casos, são encontrados gânglios linfáticos ocultos afectados que não são detectados apenas com radioterapia [6]. Sem ressecção cirúrgica e amostragem de gânglios linfáticos ou linfadenectomia radical, estes pacientes não serão correctamente encenados e, consequentemente, receberão também cuidados terapêuticos inadequados. Por conseguinte, a cirurgia continua a ser a primeira escolha para os pacientes NSCLC em estado geral operável.
Cirurgia
As opções cirúrgicas incluem lobectomias e ressecções sublobares (ressecção de segmento anatómico e ressecção em cunha) (Fig. 1) . Geralmente, escolhe-se uma abordagem minimamente invasiva (VATS) ou aberta (toracotomia), dependendo da localização do tumor e das condições intra-operatórias. Na nossa própria população de pacientes, é escolhida uma técnica minimamente invasiva em bons 70% dos casos, oferecendo assim também opções terapêuticas para pacientes com uma condição geral reduzida.
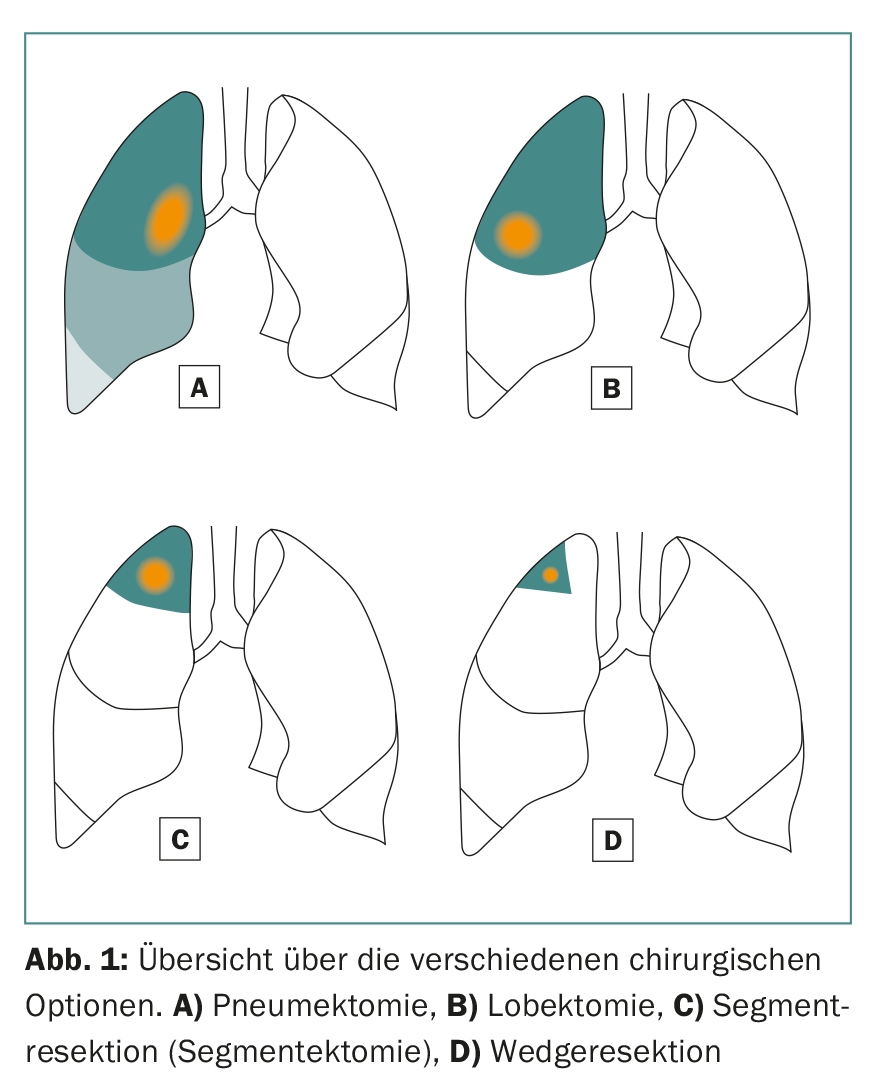
Numa lobectomia, como o nome sugere, pelo menos um lóbulo inteiro do pulmão direito ou esquerdo é removido. Isto é recomendado para tumores maiores que 3 cm. Este procedimento também tem uma grande desvantagem: perde-se muito tecido pulmonar saudável e vital no processo.
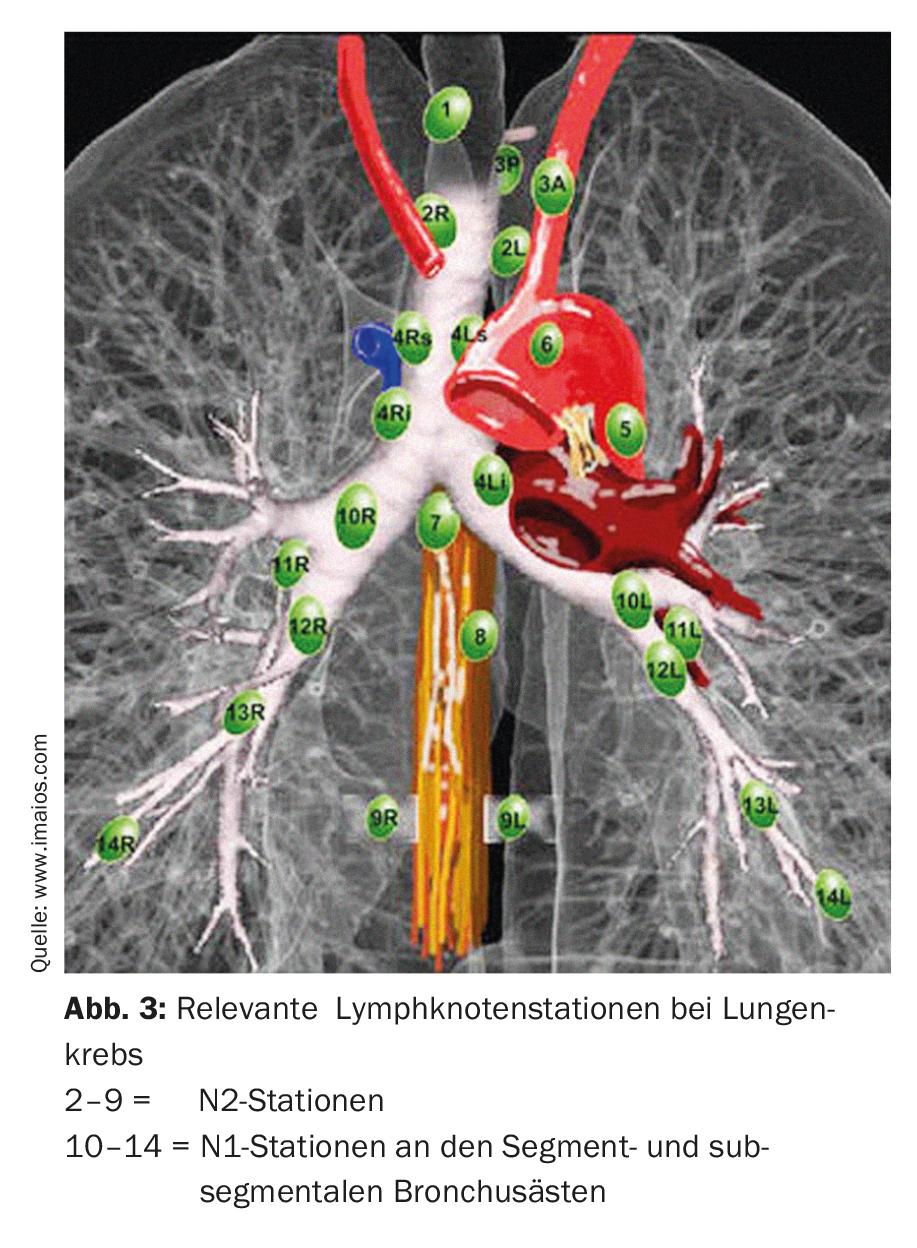
Na ressecção de segmentos anatómicos (segmentectomia), são ressecados um ou até três segmentos (ressecção de trissegmento) de lóbulos individuais, o que permite a preservação de tecido pulmonar consideravelmente mais vital do que numa lobectomia. Isto é particularmente importante para pacientes com função pulmonar deficiente ou para possíveis ressecções adicionais no caso de um segundo ou terceiro carcinoma pulmonar primário [7]. A fim de realizar com sucesso uma ressecção de segmento anatómico, é importante para o cirurgião conhecer as relações anatómicas exactas, ou seja, o pulmão e a sua divisão em dez ou nove segmentos por pulmão (Fig. 2).
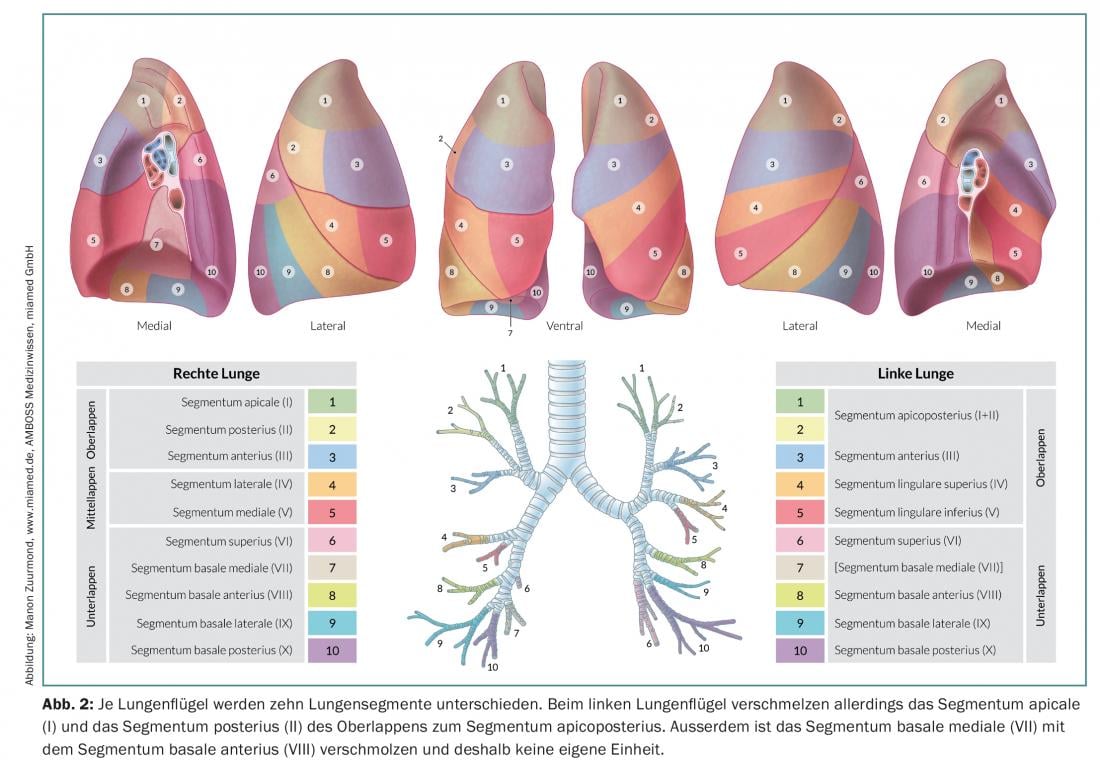
Dependendo da localização e tamanho do tumor, é tomada uma decisão entre segmentectomia ou lobectomia. Em qualquer caso, é importante confirmar o estado N0 com uma dissecção completa dos gânglios linfáticos mediastinais (desde o hilo até ao ramo segmentar e subsegmentar do brônquio) com análise da secção congelada. Se os resultados intra-operatórios mostrarem envolvimento N1 ou N2, a terapia cirúrgica deve ser imediatamente alterada e deve ser realizada uma lobectomia completa com linfadenectomia radical. A idade e o estado geral do paciente também devem ser tidos em conta. Além disso, o cirurgião deve conhecer os factores prognósticos para o tratamento cirúrgico do NSCLC. Segundo os conhecimentos actuais, os seguintes factores são factores de prognóstico independentes (ponderados pela importância) [8]:
- Número de estações de gânglios linfáticos afectados
- Classificação e diferenciação histológica
- Lymphangioinvasion na histologia definitiva
- Número total de gânglios linfáticos afectados
- Resposta com terapia neoadjuvante
- O sexo e a idade do paciente
- Tamanho do tumor.
Se um paciente tiver sido submetido a uma ressecção de segmento e se se verificar no pós-operatório que existem muitos dos factores de risco prognósticos acima mencionados, é necessária uma lobectomia completa no sentido de uma segunda operação e uma quimioterapia aditiva deve ser discutida no conselho tumoral.
Comparação da lobectomia vs. segmentectomia e linfadenectomia
No passado, discutiu-se várias vezes se a ressecção do segmento anatómico poderia substituir a lobectomia como padrão de ouro para a terapia de carcinomas IA de fase. A maior vantagem da segmentectomia anatómica é a possibilidade de ressecção do tumor, preservando ao mesmo tempo a reserva funcional do paciente, o que também poderia deslocar opções não cirúrgicas como tratamento para o cancro do pulmão em pacientes com baixa função pulmonar. Estudos anteriores mostraram taxas de sobrevivência mais baixas com ressecção sublobar em comparação com a lobectomia [9]. Deve notar-se, contudo, que as ressecções não anatómicas e anatómicas foram agrupadas e que a recolha de dados foi realizada há 25 anos.
Estudos anteriores mostraram que uma vantagem de sobrevivência está associada a um número crescente de gânglios linfáticos ressecados: Ludwig et al. mostrou que o benefício de sobrevivência atingiu o pico de 13-16 gânglios linfáticos ressecados e Gulack et al. encontrou resultados semelhantes (onze gânglios linfáticos ressecados) [10,11].
Um artigo recente de Stiles et al. investigou o papel da linfadenectomia na fase IA NSCLC e foi capaz de mostrar uma vantagem significativa para a sobrevivência a longo prazo e a sobrevivência local sem recorrência em doentes com ressecção sublobar (segmentectomia ou ressecção em cunha) e linfadenectomia em comparação com a ressecção sublobar sem linfadenectomia [12].
Assim, se a ressecção sublobar for escolhida, a linfadenectomia sistemática é crucial para o resultado pós-operatório e a sobrevivência a longo prazo.
Radioterapia vs. cirurgia
A radioterapia pode ser considerada o procedimento de escolha em casos de cancro do pulmão das fases I e II em pacientes que não são candidatos à ressecção cirúrgica devido a comorbilidades ou redução da função pulmonar.
A desvantagem mais importante da radioterapia é o facto de não haver um diagnóstico histológico e de não se efectuar uma linfadenectomia de encenação antes de ser tomada a decisão de tratamento. Isto pode ser fatal para o futuro da saúde do paciente, porque as fases clínica e patológica divergem, como demonstrado num estudo de quase 3000 pacientes realizado por López-Encuentra et al. mostrado. Aí, a concordância foi de apenas 47% [5]. Os gânglios linfáticos ocultamente afectados não são detectados durante a ablação estereotáxica, embora, como já mencionado, estes estejam presentes em 11-14% dos casos [6]. Isto resulta na atribuição de uma TNM incorrecta e eventualmente de uma fase clínica incorrecta.
Por outro lado, hoje em dia quase todas as fases iniciais são tratadas cirurgicamente usando métodos minimamente invasivos (com toracoscopia e/ou procedimentos assistidos por robôs). A histologia é sempre obtida, a ressecção anatómica segmentar e a linfadenectomia N1/N2 são sistematicamente realizadas. Além disso, os diagnósticos rápidos intra-operatórios (tumor primário e gânglios linfáticos) criam a possibilidade de ajustar a estratégia terapêutica óptima na mesma anestesia – se necessário (extensão da ressecção em caso de envolvimento de gânglios linfáticos). Todos os factores relevantes e determinantes do prognóstico estarão também disponíveis para o procedimento pós-operatório e a reapresentação no quadro do tumor, que é completamente desprovido de procedimentos de rádio ablativo estereotáxico.
Procedimento pós-operatório
Se a histologia definitiva mostrar T1a/b/c N0 M0 ou T2a N0 M0 e, consequentemente, a fase IA ou IB, não são recomendadas mais terapias adjuvantes. Estão planeados exames físicos e TAC de “baixa dose” a intervalos de seis meses durante os dois primeiros anos de pós-operatório como seguimento. Posteriormente, serão realizadas inspecções anuais. A partir da fase II, as opções de terapia adjuvante devem ser discutidas num quadro interdisciplinar de tumores [13].
Terapias Adjuvantes
As terapias baseadas na cisplatina demonstraram ser agentes adjuvantes de sucesso em termos de sobrevivência a longo prazo na fase II em três ensaios clínicos. Estas vantagens não puderam ser demonstradas para os pacientes na fase I; pelo contrário, a quimioterapia adjuvante provou ser bastante prejudicial aqui [14].
As terapias sistémicas mais recentes, tais como a terapia do cancro com anticorpos monoclonais, não são actualmente estabelecidas fora dos ensaios clínicos. Actualmente, vários ensaios clínicos aleatórios estão a avaliar o papel das terapias orientadas para EGFR- ou ALK no contexto adjuvante de doentes EGFR- ou ALK-positivos. Até agora, há provas de que os pacientes com mutações EGFR têm um maior tempo de sobrevivência sem recaídas com erlotinibe. No entanto, ainda não é claro se isto também aumenta a sobrevivência a longo prazo ou se apenas prolonga o tempo até que ocorra uma recaída.
A radioterapia pós-operatória só é recomendada nos casos em que uma situação R0 não pôde ser criada cirurgicamente [15].
Resumo
No contexto da detecção precoce, cada vez mais carcinomas pulmonares têm sido diagnosticados numa fase precoce nos últimos anos. Dependendo da fase clínica e do estado geral do paciente, uma decisão de tratamento entre a radioterapia e a cirurgia deve ser cuidadosamente ponderada. A cirurgia é ainda o tratamento de escolha para as fases iniciais do NSCLC. Neste campo, com a crescente experiência e perícia, a ressecção anatómica segmentar com linfadenectomia completa está a tornar-se cada vez mais importante, devido à sua exactidão anatómica e à economia da reserva funcional do paciente. Com o rigor adequado da linfadenectomia, é uma alternativa equivalente à lobectomia e uma melhor terapia em comparação com a radioterapia.
Mensagens Take-Home
- Os programas de detecção precoce estão a aumentar a incidência das fases iniciais do cancro do pulmão. Isto pode reduzir significativamente a mortalidade.
- A taxa de sobrevivência de 5 anos poderia ser aumentada de cerca de 17% (todas as fases do cancro do pulmão) para mais de 50%.
- A cirurgia é ainda a primeira escolha para o tratamento das fases iniciais do cancro do pulmão, com os conhecimentos adequados do cirurgião
- quase três quartos de todos os procedimentos podem ser realizados utilizando as mais recentes técnicas minimamente invasivas.
- A ressecção do segmento anatómico é ideal para ressecção em pacientes com função pulmonar comprometida devido à escassez de tecido pulmonar vital.
- Com o devido rigor da linfadenectomia, a ressecção do segmento anatómico é uma alternativa equivalente à lobectomia.
- A radioterapia estereotáxica e outros procedimentos ablativos são procedimentos de segunda escolha devido à falta habitual de confirmação diagnóstica patogénica.
Literatura:
- Krebsliga: Cancro na Suíça: figuras importantes. 2016. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- I-ELCAP: Fundação para o Diagnóstico dos Pulmões. %C3%diagnósticos.
- Foundation for Lung Diagnostics: Perguntas Frequentes. www.lungendiagnostik.ch/index.php/haufige_fragen.html.
- Vansteenkiste J, et al.: 2nd ESMO Consensus Conference on Lung Cancer: early-stage non-small-cell lung cancer consensus on diagnosis, treatment and follow-up. Ann Oncol 2014; 25(8): 1462-1474.
- López-Encuentra A, et al: Comparação entre o estadiamento clínico e patológico em 2.994 casos de cancro do pulmão. Ann Thorac Surg 2005; 79(3): 974-979.
- Stiles BM, et al.: Ponto: A fase clínica IA do cancro do pulmão de células não pequenas determinado por tomografia computorizada e tomografia por emissão de pósitrons não é frequentemente cancro do pulmão de células não pequenas patológico IA: o problema da subestimação. J Thorac Cardiovasc Surg 2009; 137(1): 13-19.
- Hattori A, et al: Resultados oncológicos da ressecção sublobar para doentes com cancro do pulmão de alto risco IA em fase clínica e não de pequenas células com um aspecto radiologicamente sólido na tomografia computorizada. Gen Thorac Cardiovasc Surg 2016; 64(1): 18-24.
- Schöb O: Terapia cirúrgica para o cancro do pulmão. Os factores de encenação, operabilidade e prognóstico determinam a indicação. InFo ONCOLOGY & HEMATOLOGY 2015; 3(1): 13-17.
- Ginsberg RJ, et al: Ensaio aleatório de lobectomia versus ressecção limitada para cancro do pulmão T1 N0 de células não pequenas. Ann Thorac Surg 1995; 60(3): 615-622.
- Ludwig MS, et al: Sobrevivência pós-operatória e o número de gânglios linfáticos amostrados durante a ressecção do cancro do pulmão não negativo de pequenas células. Peito 2005 Set; 128(3): 1545-1550.
- Gulack BC, et al: The Impact of Tumour Size on the Association of the Extent of Lymph Node Resection and Survival in Clinical Stage I Non-Small Cell Lung Cancer. Cancro do pulmão 2015; 90(3): 554-560.
- Stiles BM, et al: A importância da dissecção dos gânglios linfáticos que acompanha a ressecção da cunha para a fase clínica do pulmão IA cancer†. Eur J Cardiothorac Surg 2017; 51(3): 511-517.
- Nenhum autor listado: Quimioterapia em cancro de pulmão não pequeno: uma meta-análise utilizando dados actualizados sobre pacientes individuais de 52 ensaios clínicos aleatórios. Grupo Colaborativo Não Pequeno de Câncer de Pulmão. BMJ 1995; 311(7010): 899-909.
- Pignon JP, et al: Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559.
- Wang EH, et al: A radioterapia pós-operatória está associada a uma melhoria da sobrevivência global na fase II e III de ressecção incompleta do cancro do pulmão de células não pequenas. J Clin Oncol 2015; 33(25): 2727-2734.
- Thomas KW, Gould MK: Sistema de encenação de tumor, nó, metástase (TNM) para cancro de pulmão de células não pequenas. UpToDate 2017 Jan 16.
InFo ONCOLOGy & HaEMATOLOGy 2017; 5(3): 8-12