Após a implantação do stent, a trombose do stent é uma das complicações agudas mais importantes. A inibição efectiva da agregação plaquetária é portanto indicada. Mas como é que isto se parece?
Nos primeiros dias da angiografia coronária, as lesões eram inicialmente tratadas apenas por dilatação por balão. Foi apenas em meados dos anos 80 que foram desenvolvidas as primeiras stents [1,2]. Desde então, a tecnologia dos stents, mas também as possibilidades no campo da inibição da agregação plaquetária, têm-se desenvolvido de forma constante.
Papel da dupla terapia antiplaquetária (DAPT) e o seu desenvolvimento
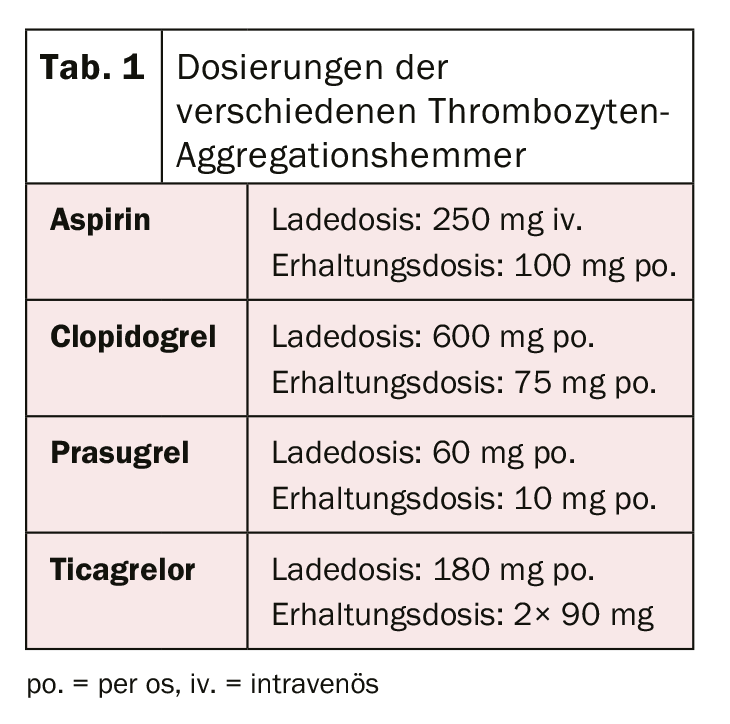
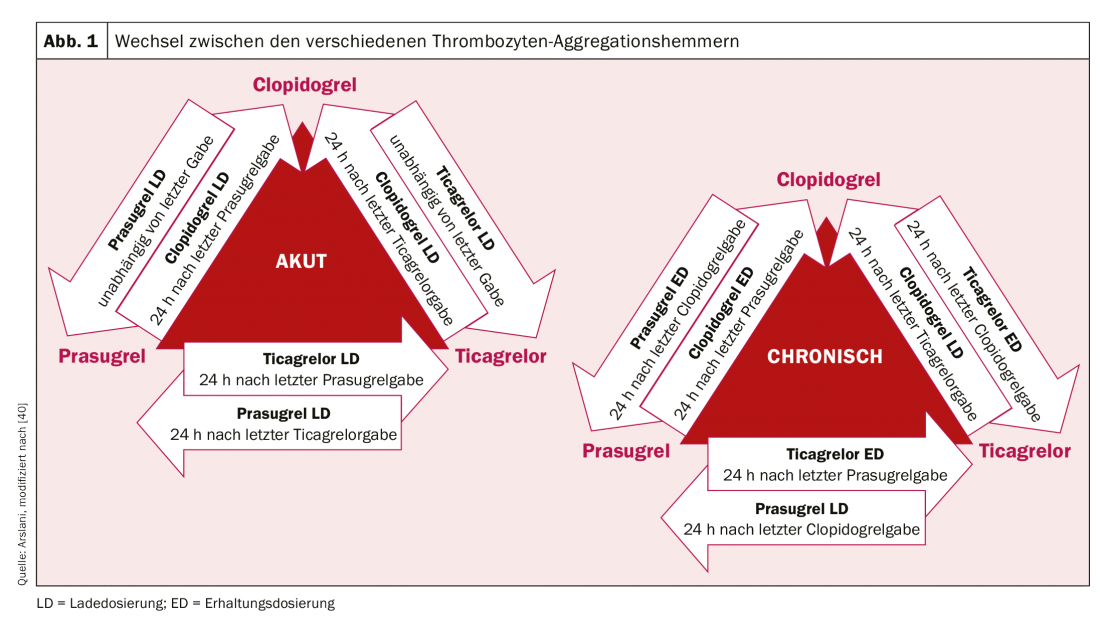
Após a revolução da primeira implantação do stent em 1986 por Sigwart et al. [2], as primeiras dificuldades e complicações associadas tornaram-se aparentes de forma relativamente rápida. A complicação aguda mais importante após a implantação do stent é e continua a ser a trombose do stent, que ocorreu a uma taxa de quase 20% nos primeiros dias. A fim de prevenir isto, várias terapias para o desbaste do sangue ou inibição da agregação plaquetária após a implantação do stent foram avaliadas. Após tratamento com dextrano de baixo peso molecular, aspirina (ASA), dipiridamole e heparina intravenosa não terem alcançado os resultados desejados, os pacientes foram sistematicamente anticoagulados oralmente com warfarina após a implantação do stent. Embora isto tenha resultado numa redução significativa da trombose aguda e subaguda do stent para 3,5%, também foi associado a um aumento significativo de complicações hemorrágicas. [3–5]. Na busca do equilíbrio ideal entre a prevenção da temida trombose do stent e o aumento do risco de hemorragia, vários outros regimes terapêuticos foram subsequentemente investigados. A dupla (dupla) inibição de agregação plaquetária parecia ser a mais eficaz. Por exemplo, um estudo de Leon et al. mostrou que uma redução significativa da trombose do stent e das complicações associadas poderia ser alcançada através de uma terapia combinada com ASA e ticlopidina. [6,7]. Como ocorreram efeitos secundários graves com a ticlopidina (incluindo alergias, úlceras, diarreia, disfunção hepática e neutropenia), este medicamento foi rapidamente substituído pelo clopidogrel muito mais bem tolerado [8]. A ASA previne a activação de plaquetas mediada por ADP, em que ambos os bloqueios actuam aditivamente e, portanto, a inibição e, portanto, também a redução da formação de trombos é significativamente mais eficaz do que com a monoterapia. Clopidogrel é um pró-fármaco que é primeiro metabolizado no fígado pelo citocromo P450 2C19 e outras enzimas CYP, e o seu metabolito activo liga-se subsequentemente de forma irreversível aos receptores P2Y12 das plaquetas, reduzindo assim a activação plaquetária mediada por ADP. Uma vez que as enzimas que activam o clopidogrel no fígado são geneticamente diferentes, o efeito inibidor das plaquetas do clopidogrel não é igualmente pronunciado em todas as pessoas. Na sequência de pacientes com endopróteses eletivas, a eficácia da terapia antiplaquetária dupla com ASA e clopidogrel também foi demonstrada em pacientes com enfarte agudo do miocárdio sem elevação do T por uma redução significativa dos eventos cardiovasculares [9]. Foi alcançada uma maior optimização da inibição da agregação plaquetária através da utilização de novos inibidores dos receptores P2Y12. Prasugrel é também um pró-fármaco do grupo das tienopiridinas, também é metabolizado (ou activado) no fígado e também se liga irreversivelmente, mas mais rápida e mais fortemente, aos ditos receptores. Além disso, ao contrário do clopidogrel, não existem diferenças geneticamente determinadas na activação do prasugrel. O estudo TRITON-TIMI 38 [10] mostrou que o prasugrel levou a uma maior redução dos eventos cardiovasculares em comparação com o clopidogrel. Apesar do aumento das complicações hemorrágicas, o benefício clínico foi claramente demonstrado a favor do prasugrel com uma redução significativa dos parâmetros isquémicos (excepto em pacientes com ≥75 anos, baixo peso corporal (<60 kg) e em pacientes após eventos cerebrovasculares). Devido ao maior risco de hemorragia, o estado coronário também deve ser conhecido antes da administração do prasugrel ou a intenção de implante do stent deve estar presente. A carga pré-intervencional é actualmente apenas recomendada para o enfarte do miocárdio de elevação do segmento ST [11]. Ticagrelor pertence à classe das ciclopentiazolopyrimidinas e é um inibidor P2Y12 competitivo e portanto reversível que é tomado como um metabolito activo (sem activação enzimática). No estudo PLATO [12], o ticagrelor também demonstrou ser superior ao clopidogrel. Foi demonstrada uma redução na morte cardiovascular, enfarte do miocárdio e trombose do stent e não houve evidência de aumento de complicações hemorrágicas. No entanto, em comparação com outros estudos, foram utilizadas diferentes definições de hemorragia em alguns casos. Em contraste com o prasugrel, o efeito positivo também foi observado em pacientes tratados de forma conservadora (sem intervenção e stent) ou por cirurgia de bypass [12,13]. Em doentes com enfarte do miocárdio com supradesnivelamento do ST, o pré-tratamento com ticagrelor antes da angiografia coronária também demonstrou resultar em taxas mais baixas de trombose do stent [14]. Infelizmente, ainda não foi efectuada uma comparação entre as substâncias ticagrelor e prasugrel. A dose inicial de carregamento e a dose de manutenção dos diferentes fármacos estão resumidas no quadro 1. Na prática clínica diária, pode ser necessário alternar entre as preparações (por exemplo, no caso de intolerância aos medicamentos). O algoritmo para alternar entre as preparações de acordo com o cenário clínico (crónico versus agudo) é mostrado na figura 1 .
Desenvolvimento das stents
Como mencionado anteriormente, nos primeiros dias da intervenção coronária, o vaso era tratado apenas por dilatação por balão. No entanto, devido à dissecação, recuo elástico em caso de sobrealongamento e remodelação tardia com proliferação intimal, isto resultou frequentemente na renovação da oclusão e reestenose dos vasos. Para contrariar isto e para manter os vasos abertos após a dilatação, foram desenvolvidas malhas vasculares de balão ou auto-expansíveis (stents), as quais foram implantadas após o pré-tratamento por dilatação de balão. No início, estas endopróteses eram difíceis de utilizar devido à sua natureza, ao material utilizado, bem como à técnica de implantação ainda jovem (principalmente aço inoxidável com suportes de endopróteses grossos). Ao longo do tempo, contudo, estes stents metálicos (hoje também conhecidos como stents metálicos nus, BMS) foram sendo mais desenvolvidos de modo a serem agora muito mais fáceis de utilizar (implantação por meio de expansão de balões, suportes de stents mais finos, ligas mais leves). Embora tenha sido demonstrado nos primeiros tempos que as BMS são superiores à simples dilatação por balão [3,4], o curso a longo prazo mostrou taxas relevantes de reestenose instintiva devido à proliferação excessiva da intimidade. Para contrariar esta proliferação, foram desenvolvidas as chamadas endopróteses com efeito de droga (DES). A primeira geração de DES foi feita com as mesmas ligas que a BMS, mas foram revestidas com um fármaco antiproliferativo com polímero, como o sirolimus ou o paclitaxel. Isto levou a uma redução na formação da neo-intima e, portanto, a uma diminuição significativa da reestenose instintiva [15–17]. No entanto, devido à endotelização tardia causada pelos medicamentos antiproliferativos e, portanto, ao contacto mais prolongado das hastes de stent com a corrente sanguínea, vários estudos mostraram um aumento significativo da taxa de trombose tardia do stent e de enfarte do miocárdio [18,19]. Em resposta, não só a inibição da agregação plaquetária, mas também a composição do stent foi mais desenvolvida. Na segunda e terceira gerações de DES, polímeros biocompatíveis e fármacos mais eficientes, como o everolimus, têm sido utilizados em doses mais baixas para revestimento, resultando numa endotelização mais rápida e melhor dos stents. Juntamente com o DAPT melhorado, foi possível demonstrar uma segurança significativamente melhorada com a mesma eficácia com o DES actualmente em uso em comparação com a primeira geração de DES [20,21], o que praticamente levou ao desaparecimento do BMS não revestido. Em mais um passo, além dos novos stents, a dilatação de balões também se desenvolveu e é possível tratar vasos mais pequenos usando balões revestidos com drogas (DCB) sem a implantação de stents [22].
Duração do DAPT após a implantação do stent
Relativamente à duração do DAPT, deve ser feita uma distinção clara entre pacientes com enfarte agudo do miocárdio e pacientes com doença arterial coronária estável. Em pacientes com doença arterial coronária estável, foi demonstrado que não há diferença nos eventos cardiovasculares e morte entre uma duração de tratamento de 6 meses e ≥12 meses [23,24]. Por outro lado, houve um aumento significativo das complicações hemorrágicas relevantes com uma duração de tratamento superior a 12 meses e houve provas de aumento da mortalidade [25,26]. Uma vez que não foram realizados estudos com DAPT consistindo em ASA e ticagrelor ou prasugrel em pacientes com doença arterial coronária estável, recomenda-se o DAPT com clopidogrel neste cenário. No entanto, em doentes seleccionados de alto risco isquémico, um dos outros medicamentos pode ser escolhido. Em resumo, a terapia antiplaquetária dupla com ASA e clopidogrel durante 6 meses é recomendada em doentes com doença arterial coronária estável após intervenção, independentemente do tipo de stent, e também após tratamento apenas com um DCB [27]. Se houver um risco acrescido de hemorragia (pontuação Precise-DAPT [28], ≥25) ≥25 , a duração da terapia pode ser reduzida para 3 meses [29,30] e, em casos seleccionados, também para 1 mês [31,32]. No entanto, se a duração da terapia for reduzida (especialmente para 1 mês), o risco de recorrência de eventos cardiovasculares deve ser cuidadosamente ponderado contra o risco de hemorragia.
As recomendações para pacientes após uma síndrome coronária aguda baseiam-se nos estudos comparativos de prasugrel ou ticagrelor com clopidogrel. Estes estudos são a base para a recomendação actual de que os doentes devem receber terapia antiplaquetária dupla com ASA e ticagrelor ou prasugrel durante 12 meses após um evento agudo, também independentemente do tipo de stent [9,10,12]. De acordo com os dados actuais, em particular o estudo PEGASUS [33] A terapia antiplaquetária dupla prolongada só deve ser utilizada em doentes com risco isquémico aumentado (idade ≥50 anos e mais de um dos seguintes factores: >65 anos, diabetes mellitus que requer tratamento, mais infarto do miocárdio, doença coronária multivascular ou insuficiência renal com uma depuração de <60 ml/min) e sem complicações hemorrágicas prévias devem ser consideradas. A terapia com Ticagrelor 60 mg duas vezes por dia é preferível [27]. Também é possível uma redução da duração da terapia para 6 meses com um risco aceitável no caso de um aumento do risco de hemorragia (pontuação Precise-DAPT [28] ). Nos dados até à data, apenas uma redução para <6 meses mostrou um aumento substancial dos eventos cardiovasculares.
Anticoagulação e DAPT
Outro desafio é colocado pelos pacientes com indicação de anticoagulação oral. Também aqui é importante encontrar o equilíbrio ideal entre o risco de hemorragia e os riscos de trombose de stent ou de eventos cardiovasculares. Recomenda-se a tripla terapia com ASA, clopidogrel e anticoagulação oral estabelecida com um antagonista de vitamina K (VKA) ou um dos novos anticoagulantes orais (NOAK). O valor de INR a visar deve ser seleccionado no limite inferior (INR 2-2,5) e a dose mais baixa aprovada para a prevenção de eventos cerebrovasculares deve ser seleccionada para os NOAKs (dabigatran 110 mg 2× ao dia, rivaroxaban 15 mg 1× ao dia, apixaban 5 mg 2× diariamente ou 2,5 mg se se aplicarem 2 dos seguintes factores de risco: idade ≥80 anos, peso ≤60 kg, creatinina ≥133 umol/l). [27]. Anticoagulação oral combinada com ASA e clopidogrel [34], uma vez que há poucos dados sobre os outros inibidores P2Y12 e um risco acrescido de hemorragia foi descrito nos dados de registo [35]. Ao determinar a duração da terapia tripla, o risco de hemorragia (pontuação HAS-BLED [hipertensão, função renal/fígado anormal, historial de AVC, historial de hemorragia, instabilidade do INR, idade superior a 65 anos, abuso/medicações de álcool, por exemplo, AINEs; alto risco de hemorragia com pontos ≥3) [36] deve ser novamente ponderado em relação ao risco de trombose. Se o risco de hemorragia for elevado, a terapia tripla deve ser limitada a um mês, seguida de terapia dupla (ASA ou clopidogrel + anticoagulação oral em dose normal) por um total de um ano [34,37]. Se o risco de trombose for elevado, recomenda-se uma extensão da terapia tripla até 6 meses [38], após o que a terapia dupla com ASA ou clopidogrel também deve ser seguida por mais 6 meses. Após um ano, a monoterapia com anticoagulação oral pode então ser continuada na maioria dos casos [39].
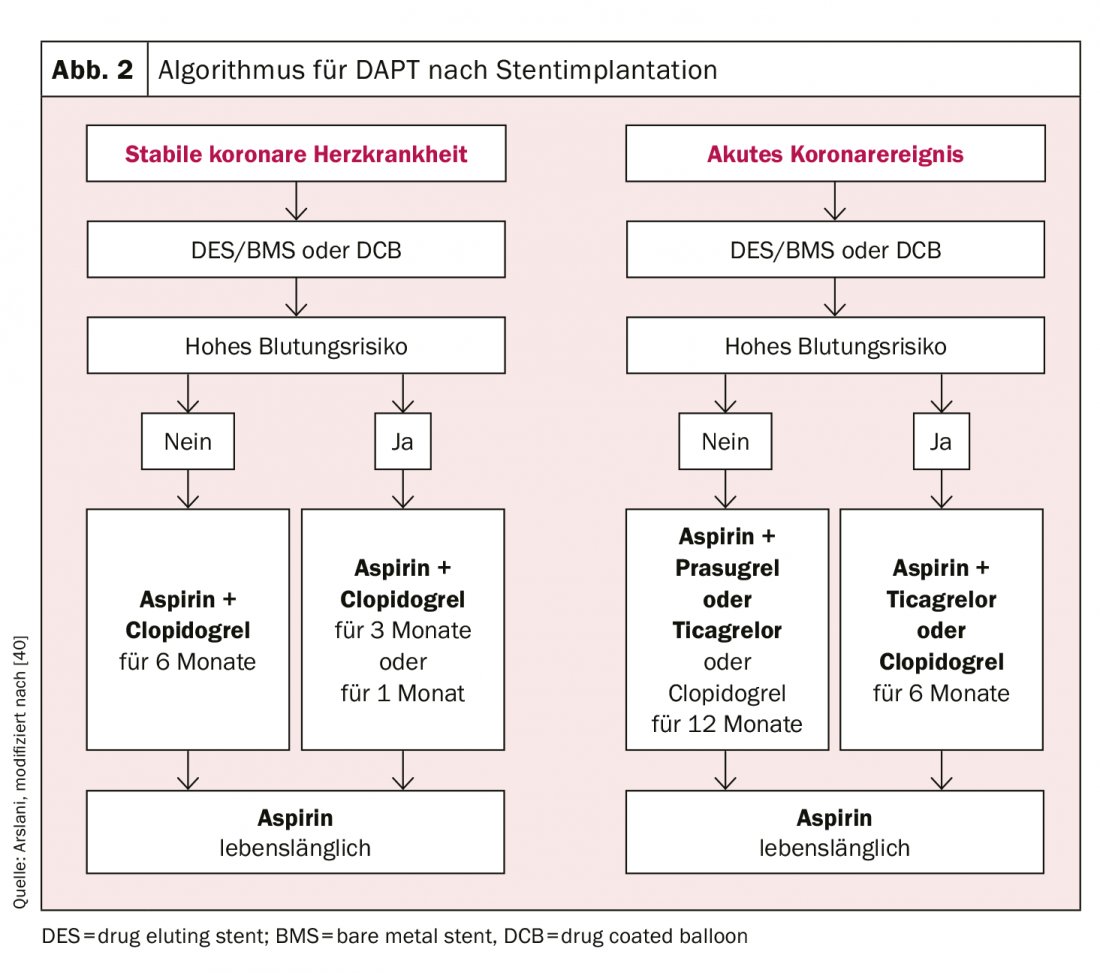
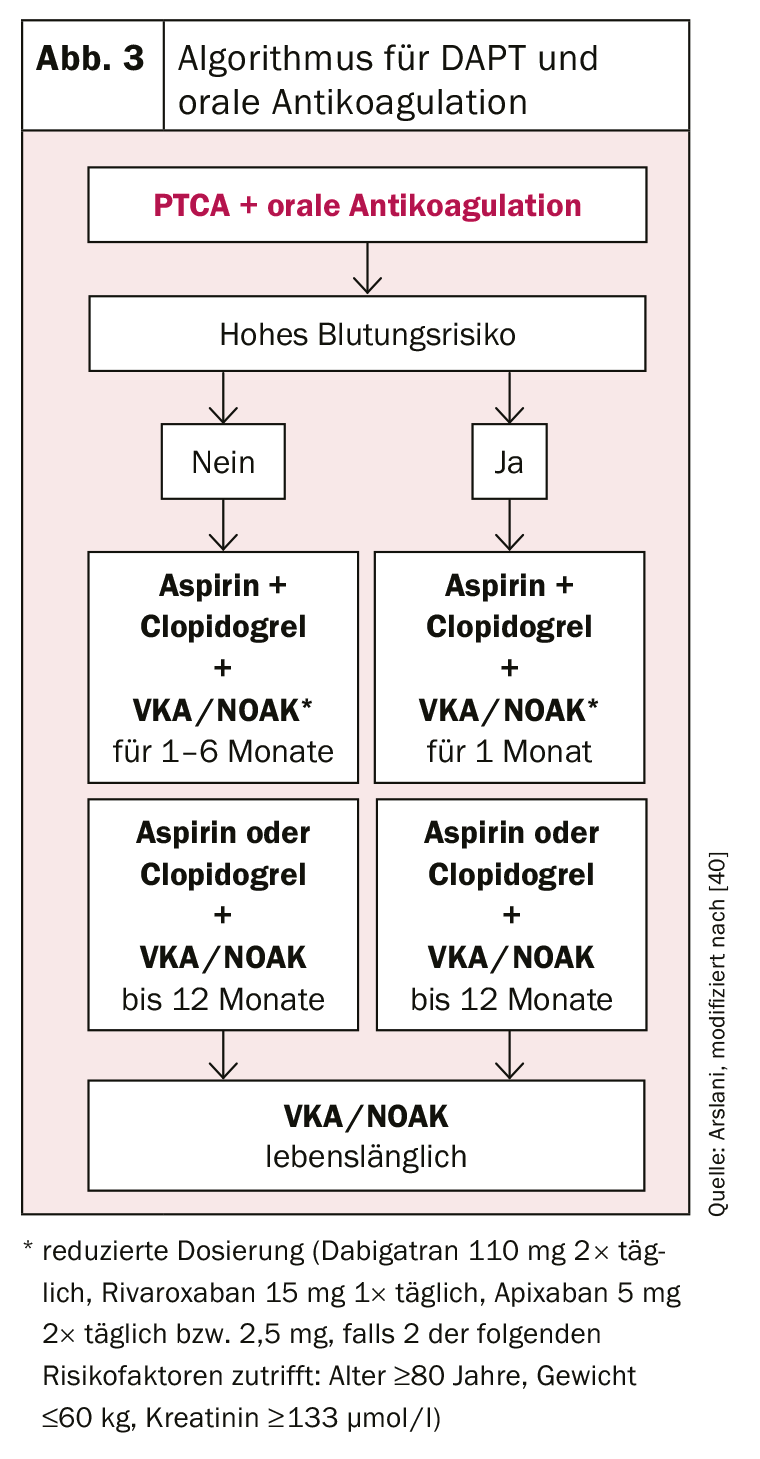
A utilização dos diferentes inibidores de agregação plaquetária de acordo com as recomendações actuais da Sociedade Europeia de Cardiologia estão resumidas na figura 2 e 3 .
Literatura:
- 1 Gruntzig A: Dilatação transluminal da estenose de artéria coronária. Lancet, 1978. 1(8058): 263.
- 2 Sigwart U, et al: Stents intra-vasculares para prevenir a oclusão e a reestenose após a angioplastia transluminal. N Engl J Med, 1987. 316(12): 701-706.
- Fischman DL, et al: Uma comparação aleatória entre a colocação de coronária-stente e a angioplastia com balão no tratamento da doença arterial coronária. Stent Restenosis Study Investigators. N Engl J Med, 1994. 331(8): 496-501.
- Serruys PW, et al: Uma comparação de implante de stent balão-expansível com angioplastia de balão em pacientes com doença arterial coronária. Benestent Study GrouN Engl J Med, 1994. 331(8): 489-495.
- Cohen DJ, et al: Resultados económicos hospitalares e de um ano após a endoprótese coronária ou angioplastia com balão. Resultados de um ensaio clínico aleatório. Stent Restenosis Study Investigators. Circulação, 1995. 92(9): 2480-2487.
- Leon MB, et al: Um ensaio clínico comparando três regimes de medicamentos antitrombóticos após a endoprótese de artéria coronária. Stent Anticoagulation Restenosis Study Investigators. N Engl J Med, 1998. 339(23): 1665-1671.
- Schomig A, et al: Uma comparação aleatória da terapia antiplaquetária e anticoagulante após a colocação de stents de artéria coronária. N Engl J Med, 1996. 334(17): 1084-1089.
- Bertrand ME, et al: Estudo duplo-cego da segurança do clopidogrel com e sem dose de carga em combinação com aspirina em comparação com a ticlopidina em combinação com aspirina após stent coronário: o estudo cooperativo internacional sobre o stent de aspirina clopidogrel (CLASSICS). Circulação, 2000. 102(6): 624-629.
- Yusuf S, et al: Efeitos do clopidogrel para além da aspirina em doentes com síndromes coronárias agudas sem elevação do segmento ST. N Engl J Med, 2001. 345(7): 494-502.
- Wiviott SD, et al: Prasugrel versus clopidogrel em doentes com síndromes coronárias agudas. N Engl J Med, 2007. 357(20): 2001-2015.
- Montalescot G, et al: Pré-tratamento com prasugrel em síndromes coronárias agudas de elevação não-ST. N Engl J Med, 2013. 369(11): 999-1010.
- Wallentin L, et al: Ticagrelor versus clopidogrel em doentes com síndromes coronárias agudas. N Engl J Med, 2009. 361(11): 1045-57.
- Roe MT, et al: Prasugrel versus clopidogrel para síndromes coronárias agudas sem revascularização. N Engl J Med, 2012. 367(14): 1297-1309.
- Montalescot G, et al: Ticagrelor pré-hospitalar no infarto do miocárdio de elevação do segmento ST. N Engl J Med, 2014. 371(11): 1016-1027.
- Morice MC, et al: Uma comparação aleatória de um stent sirolimus-eluting com um stent padrão para revascularização coronária. N Engl J Med, 2002. 346(23): 1773-1780.
- Moses JW, et al: Sirolimus-eluting stents versus stents padrão em pacientes com estenose numa artéria coronária nativa. N Engl J Med, 2003. 349(14): 1315-1323.
- Stone GW, et al: Um stent à base de polímero, em paclitaxel, em pacientes com doença arterial coronária. N Engl J Med, 2004. 350(3): 221-231.
- McFadden EP, et al: Trombose tardia em stents coronários com eluição de fármacos após a descontinuação da terapia antiplaquetária. Lancet, 2004. 364(9444): 1519-1521.
- Lagerqvist B, et al: Stent thrombosis in Sweden: a report from the Swedish Coronary Angiography and Angioplasty Registry. Circ Cardiovasc Interv, 2009. 2(5): 401-408.
- Stone GW, et al: Everolimus-eluting versus paclitaxel-eluting stents na doença arterial coronária. N Engl J Med, 2010. 362(18): 1663-1674.
- Planer D, et al: Comparação de stents everolimus e paclitaxel-eluting em pacientes com síndromes coronárias agudas e estáveis: resultados conjuntos dos ensaios SPIRIT (A Clinical Evaluation of the XIENCE V Everolimus Eluting Coronary Stent System) e COMPARE (A Trial of Everolimus-Eluting Stents and Paclitaxel-Eluting Stents for Coronary Revascularization in Daily Practice). JACC Cardiovasc Interv, 2011. 4(10): 1104-1115.
- Jeger RV, et al: Balões revestidos com fármacos para pequenas doenças coronárias (BASKET-SMALL 2): um ensaio de não-inferioridade aleatorizado de marca aberta. Lancet, 2018. 392(10150): 849-856.
- Gwon HC, et al: Terapia dual antiplaquetária de seis meses versus 12 meses após a implantação de stents farmacológicos: a Eficácia de Xience/Promus Versus Cypher para Reduzir a Perda Tardia após Stenting (EXCELENTE), estudo randomizado e multicêntrico. Circulação, 2012. 125(3): 505-513.
- Valgimigli M, et al: Duração curta versus longa da terapia dual-antiplaquetária após stent coronário: um ensaio multicêntrico randomizado. Circulação, 2012. 125(16): 2015-2026.
- Costa F, et al: Impact of clinical presentation on ischaemic and bleeding outcomes in patients receiving 6- or 24-month duration of dual-antiplatelet therapy after stent implantation: a pre-specified analysis from the PRODIGY (Prolonging Dual-Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia) trial. Eur Heart J, 2015. 36(20): 1242-1251.
- Bittl JA, et al: Duration of Dual Antiplatelet Therapy: A Systematic Review for the 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol, 2016. 68(10): 1116-1139.
- Valgimigli M, et al: [2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS.]. Cardiol Pol, 2017. 75(12): 1217-1299.
- Costa F, et al: Derivação e validação da previsão de complicações hemorrágicas em pacientes submetidos a implante de stents e subsequente dupla terapia antiplaquetária (PRECISE-DAPT) pontuação: uma análise conjunta de conjuntos de dados individuais de pacientes de ensaios clínicos. Lancet, 2017. 389(10073): 1025-1034.
- Kim BK, et al: Uma nova estratégia para a interrupção da terapia antiplaquetária dupla: o ensaio RESET (REal Safety and Efficacy of 3 months dual antiplatelet Therapy followin Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol, 2012. 60(15): 1340-1348.
- Feres F, et al: Três contra doze meses de terapia antiplaquetária dupla após stents zotarolimus-eluting: o ensaio aleatório OPTIMIZE. JAMA, 2013. 310(23): 2510-2522.
- Urban P, et al: Stents Coronários sem Polímeros em Pacientes em Alto Risco de Sangramento. N Engl J Med, 2015. 373(21): 2038-47.
- Valgimigli M, et al: Zotarolimus-eluting versus stents de metal nu em candidatos a stents incertos. J Am Coll Cardiol, 2015. 65(8): 805-815.
- Bonaca MP, Braunwald E, Sabatine MS: Uso a longo prazo do Ticagrelor em Pacientes com Infarto do Miocárdio Prévio. N Engl J Med, 2015. 373(13): 1274-1275.
- Dewilde WJ, et al: Utilização de clopidogrel com ou sem aspirina em doentes em terapia anticoagulante oral e submetidos a intervenção coronária percutânea: um ensaio aberto, aleatorizado e controlado. Lancet, 2013. 381(9872): 1107-1115.
- Sarafoff N, et al: Tripla terapia com aspirina, prasugrel, e antagonistas de vitamina K em pacientes com implante de stent farmacológico e uma indicação para anticoagulação oral. J Am Coll Cardiol, 2013. 61(20): 2060-2066.
- Roldan V, et al: A pontuação HAS-BLED tem melhor precisão de previsão para grandes hemorragias do que a pontuação CHADS2 ou CHA2DS2-VASc em doentes anticoagulados com fibrilação atrial. J Am Coll Cardiol, 2013. 62(23): 2199-2204.
- Gibson, C.M, et al: Prevenção da Hemorragia em Pacientes com Fibrilação Atrial ICP em Curso. N Engl J Med, 2016. 375(25): 2423-2434.
- Fiedler KA, et al: Duration of Triple Therapy in Patients Requiring Oral Anticoagulation After Drug-Eluting Stent Implantation: The ISAR-TRIPLE Trial. J Am Coll Cardiol, 2015. 65(16): 1619-1629.
- Lamberts M, et al: Antiplatelet therapy for stable coronary artery disease in atrial fibrillation patients taking an oral anticoagulant: um estudo de coorte a nível nacional. Circulação, 2014. 129(15): 1577-1585.
- Valgimigli M, et al: 2017 A actualização do ESC centrou-se na dupla terapia antiplaquetária na doença arterial coronária, desenvolvida em colaboração com a EACTS. European Heart Journal, 2018; 39: 213-254.
CARDIOVASC 2019; 18(4): 16-18