A doença renal crónica (CKD) é classificada de acordo com o tipo de doença subjacente, taxa de filtração e extensão da proteinúria. Os doentes com CKD são doentes de risco cardiovascular. A morbilidade cardiovascular aumenta com o aumento da proteinúria e com a diminuição da taxa de filtração. A base terapêutica para retardar a progressão da insuficiência renal continua a ser a terapia antiproteinúrica, inibindo o RAS. Relativamente à hipertensão arterial e renovascular: Um controlo demasiado intensivo da pressão arterial tende a ser desaconselhável. A hipertensão renal é a causa mais comum de hipertensão secundária em pacientes com mais de 50 anos de idade com hipertensão resistente e está associada a uma mortalidade cardiovascular mais elevada e a uma perda mais rápida da função renal. A denervação renal não deve ser utilizada como método padrão de tratamento de pacientes com hipertensão “refractária”.
A primeira parte deste artigo centra-se na insuficiência renal crónica. Qual é o curso do diagnóstico e o que pode ser dito sobre o risco de progressão?
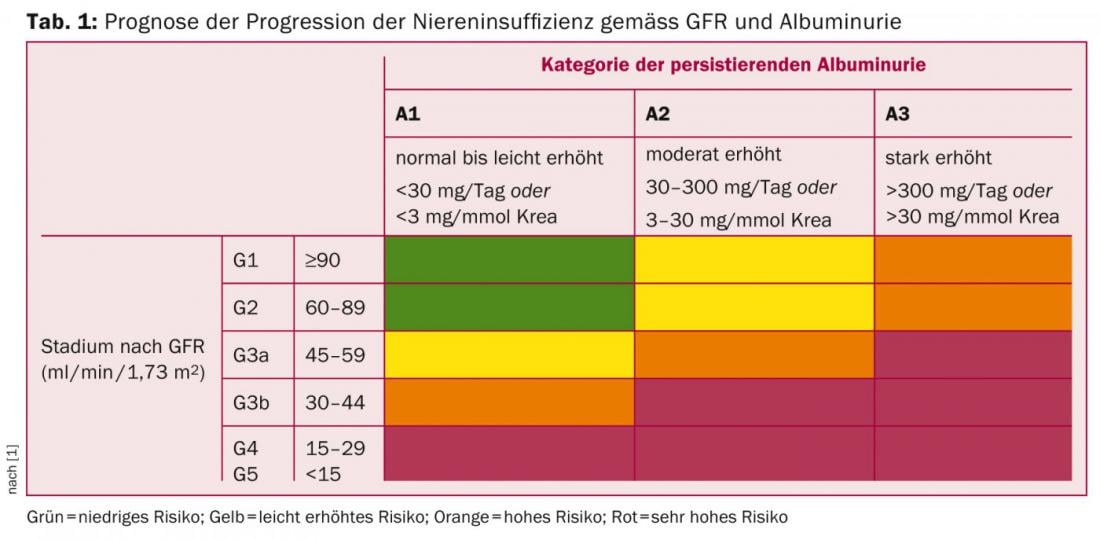
A doença renal crónica (CKD) é definida por uma taxa de filtração (eGFR) ≤60 ml/min/1,73 m2 ou por sinais de lesão renal (na urina, soro ou por imagem) durante três meses, de acordo com as directrizes KDIGO de 2012 [1]. A classificação do CKD deve ser orientada de acordo com o tipo de doença subjacente, taxa de filtração e extensão da proteinúria [1], uma vez que estes parâmetros não só são relevantes para a progressão (Tab. 1), mas também para a estimativa da morbilidade e mortalidade cardiovascular.
A estimativa do eGFR deve ter lugar na vida quotidiana através da fórmula 2009-CKD-EPI [1]. Cistatina C juntamente com creatinina sérica para determinação eGFR (2012-CKD-EPI fórmula creatinina-cistatina C) deve ser utilizada em situações especiais [2]. Isto é especialmente verdade quando a creatinina sérica não se correlaciona com a taxa de filtração glomerular estimada pela creatinina sérica [1] (por exemplo, perda muscular, cirrose hepática, gravidez, uso de trimetoprina) e quando não há outras evidências de doença renal, excepto para uma diminuição da taxa de filtração glomerular estimada pela creatinina sérica. Ambas as fórmulas estão disponíveis na Internet em www.mdrd.com.
A presença de microalbuminúria é um factor de risco cardiovascular não relacionado [3], embora nem sempre esteja associado à progressão da doença renal, uma vez que a microalbuminúria também pode ser regressiva no decurso da doença [4]. A diminuição da taxa de filtração em doentes idosos até CKD 3a (eGFR 45 ml/min/1,73 m2) pode ser considerada como um processo de envelhecimento normal se o eGFR for estável e a proteinúria estiver ausente [1].
Complicações cardiovasculares (prevenção)
Os doentes com CKD são doentes de risco cardiovascular. A morbilidade cardiovascular aumenta com o aumento da proteinúria e com a diminuição da taxa de filtração. O efeito parece ser aditivo [5]. Os factores de risco podem ser divididos em tradicionais (idade, colesterol LDL, hipertensão, sexo, etc.) e não tradicionais (albuminúria, anemia, carga volúmica, desordem do equilíbrio ósseo mineral). As novas directrizes KDIGO recomendam uma redução moderada do colesterol LDL com uma dose fixa de estatina após uma única medição de colesterol em pacientes com mais de 50 anos de idade que não necessitam de diálise, sem mais controlos do perfil lipídico de acordo com a estratégia “fogo e esquecimento” [6]. Em pacientes com menos de 50 anos de idade, a terapia medicamentosa não é recomendada até à doença coronária, diabetes mellitus, acidente vascular cerebral ou um risco calculado de dez anos de eventos coronários >10%. Neste caso, aplicam-se os valores-alvo da doença subjacente [6].
Progressão de retardamento da insuficiência renal
A terapia antiproteinúrica, inibindo o sistema renina-angiotensina-aldosterona (RAS) continua a ser a pedra angular do abrandamento da progressão da insuficiência renal. Uma vez que mais de uma classe de compostos está disponível para inibir o SAR, está a ser investigada a medida em que o bloqueio duplo do SAR tem benefícios em termos de mortalidade cardiovascular e progressão para a insuficiência renal.
O ensaio ONTARGET é o maior estudo até à data que investigou a combinação de um inibidor da ECA com um inibidor de sartan versus um tratamento com sartan apenas em doentes de alto risco. A terapia combinada não mostrou qualquer benefício na mortalidade cardiovascular. No que diz respeito aos pontos terminais renais, a terapia de combinação mostrou mesmo um resultado pior [7]. Uma grande desvantagem do ONTARGET foi que apenas alguns pacientes com proteinúria foram incluídos. O estudo ALTITUDE [8] (combinação do inibidor de renina aliskiren com ACE-I ou ARB) e mais recentemente o estudo NEPHRON-D [9] (combinação de losartan com lisinopril vs. losartan sozinho) em doentes com diabetes tipo 2 e proteinúria mostrou que os efeitos secundários graves (hipercalemia, insuficiência renal aguda) ocorreram mais frequentemente com a terapia combinada, de modo que os estudos foram terminados prematuramente. O bloqueio duplo de RAS já não é recomendado em doentes com diabetes e proteinúria. Ainda não está claro se os pacientes com nefropatia proteinúrica devido à glomerulonefrite beneficiam do duplo bloqueio RAS.
Equilíbrio cálcio-fosfato e perturbação do equilíbrio mineral-ósseo
A fisiopatologia dos desequilíbrios minerais e ósseos é classicamente percebida como desenvolvendo hiperparatiroidismo secundário devido à deficiência progressiva de calcitriol e retenção de fosfatos. Novas descobertas sobre o sistema FGF-23/Klotho alteraram esta percepção.
Mesmo nas fases iniciais, verifica-se um aumento do FGF-23, que inibe simultaneamente a síntese da hormona calcitriol e paratiróide [10]. É possível que, nas fases iniciais da insuficiência renal, o FGF-23 regule um balanço positivo de fosfato que é invisível no soro. Ao mesmo tempo, o FGF-23 serve para manter o equilíbrio do cálcio estável. Com a perda adicional de energia renal, o efeito do co-receptor FGF-23 Klotho diminui. A hormona paratiróide e o FGF-23 sobem depois em paralelo. No entanto, a fisiopatologia exacta permanece pouco clara.
De acordo com as directrizes do KDIGO, os valores normais para a hormona fosfato e paratiróide no soro devem ser dirigidos a doentes que não necessitem de diálise [11]. A utilização de ligantes de fosfato em doentes não sujeitos a diálise com insuficiência renal avançada foi recentemente questionada [12,13]. Com base na informação acima referida, o foco na prática clínica deve ser a redução da ingestão de fosfatos o mais cedo possível – a importância do aconselhamento nutricional com o objectivo de redução de fosfatos está a aumentar [1]. Contudo, deve-se evitar alcançar a redução do fosfato através da restrição proteica e da desnutrição [1]. No caso de deficiência de vitamina D (25[OH]vitamina D <50 nmol/l), que está frequentemente presente em doentes com CKD [14], recomenda-se a sua substituição.
Hipertensão arterial e renovascular
A segunda parte deste artigo é sobre hipertensão arterial e renovascular: Quais são os actuais alvos da tensão arterial? E que novidades há nesta área?
As directrizes para o tratamento da hipertensão arterial têm mudado nos últimos anos. Em 2012, foram publicadas as directrizes do KDIGO, que abordam especificamente o controlo da tensão arterial em doentes não sujeitos a diálise com insuficiência renal crónica. Os valores da tensão arterial alvo foram aumentados para doentes sem albuminúria (<30 mg/dia) com a tensão arterial alvo <140/90 mmHg. No entanto, para os doentes com albuminúria, os alvos agressivos são mantidos sem provas concretas [15].
Em 2013, as directrizes ESH/ESC foram actualizadas (Tab. 2 e 3), recomendando a redução da tensão arterial sistólica para <140 mmHg em todos os doentes com elevado risco cardiovascular, incluindo os que têm proteinúria manifesta (com e sem diabetes) [16].

A tensão arterial diastólica durante a terapia deve ser inferior a 90 mmHg. Apenas em pacientes com diabetes é recomendada uma redução adicional para 85 mmHg [16]. A tendência actual é de desaconselhar uma redução demasiado intensiva da tensão arterial. Isto deve-se em particular a estudos em diabéticos do tipo 2 com elevado risco cardiovascular, que tiveram uma mortalidade cardiovascular mais elevada como resultado de um controlo intensivo da tensão arterial [17,18].

Hipertensão Renovascular
A hipertensão renal é a causa mais comum de hipertensão secundária em pacientes com mais de 50 anos de idade com hipertensão resistente (até 45%). A prevalência da hipertensão renovascular é de 1-5% dos pacientes com hipertensão [19] e está associada a uma mortalidade cardiovascular mais elevada e a uma perda mais rápida da função renal. Grandes ensaios randomizados (STAR e ASTRAL) não conseguiram demonstrar um benefício terapêutico da endoprótese da artéria renal [20,21]. Estes resultados foram agora confirmados pelo estudo CORAL, o maior ensaio aleatório no terreno até à data [22]. Na análise de subgrupos de doentes com estenose de grau mais elevado (>80%), função renal prejudicada (eGFR <45 ml/min/1,73 m2), diabetes mellitus, estenose bilateral ou tensão arterial basal elevada (>160 mmHg), o implante de stents também não mostrou qualquer benefício. CORAL foi o primeiro ensaio em que muitos pacientes tratados no braço conservador receberam uma combinação de aspirina, inibidores da ECA ou ARBs e estatinas. Uma crítica ao estudo CORAL é que a relevância hemodinâmica da estenose foi determinada apenas pela angiografia e não confirmada pela medição da pressão intra-arterial. Além disso, não tinha sido realizada nenhuma medição do índice de resistência sonográfica duplex, o que poderia indicar a relevância da estenose como causa da hipertensão [23]. A decisão de implantar um stent em casos de estenose hemodinâmica comprovadamente relevante da artéria renal só deve ser tomada após uma avaliação ultra-sonográfica e clínica duplex abrangente por angiologistas e nefrologistas.
Hipertensão resistente
Calhoun et al. abordou o problema da hipertensão refratária num grande colectivo (estudo REGARDS). Após modificação da terapia, exclusão de causas secundárias e controlo da adesão dos doentes, apenas 0,5% tinham hipertensão refractária [24]. A denervação renal tem sido objecto de muito debate nos últimos anos, na sequência dos resultados positivos dos estudos Simplicity 1 [25] e Simplicity 2 [26]. O estudo de Fadl et al. (um pequeno estudo que exigia a aderência garantida de medicamentos) questionou a eficácia da denervação renal [27]. Portanto, os resultados do ensaio Simplicity-3 (ensaio de aprovação pela FDA) foram aguardados com expectativa (denervação vs. punção artero-arterial fraudulenta e inserção de um cateter sem denervação). O estudo não mostrou nenhuma vantagem significativa da intervenção em relação ao tratamento falso [28]. Assim, a denervação renal não deve ser utilizada como um método padrão para o tratamento de pacientes com hipertensão “resistente à terapia” no momento actual.
Prof. Dr. med. Michael Dickenmann
Literatura:
- KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidn Int Suppl 2013 3(1).
- Shlipak MG, et al: N Engl J Med 2013 Set 5; 369(10): 932-943.
- Go AS, et al: N Engl J Med 2004 Set 23; 351(13): 1296-1305.
- Glassock RJ, Winearls C: Curr Opinião Nephrol Hypertens 2010 Mar; 19(2): 123-128.
- Matsushita K, et al. (Chronic Kidney Disease Prognosis Consortium): Lancet 2010 Jun 12; 375(9731): 2073-2081.
- KDIGO Clinical Practice Guideline for Lipid Management in CKD: resumo das declarações de recomendação e abordagem clínica ao paciente. Kidney Int 2014 Fev. 19. doi: 10.1038/ki.2014.31.
- Mann JF, et al: Lancet 2008 Ago 16; 372(9638): 547-553.
- Parving HH, et al: N Engl J Med 2012; 367: 2204-2213.
- Fried LF, et al: N Engl J Med 2013; 369: 1892-1903.
- Isakova T, et al: Kidney Int 2011 Jun; 79(12): 1370-1378.
- KDIGO Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl 2009 Ago; 113: 1-130.
- Hill KM, et al: Kidney Int 2013 Maio; 83(5): 959-966.
- Bloco GA, et al: J Am Soc Nephrol 2012 Ago; 23(8): 1407-1415.
- LaClair RE, et al: Am J Kidney Dis 2005; 45: 1026-1033.
- KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney International Supplements 2012; 2.
- Mancia G, et al: Journal of Hypertension 2013, 31: 1281-1357.
- Cooper-DeHoff RM, et al: JAMA 2010 Jul 7; 304(1): 61-68.
- Cushman WC, et al: N Engl J Med 2010 Abr 29; 362(17): 1575-1585.
- Dworkin LD, Cooper CJ: N Engl J Med 2009 12 de Novembro; 361(20): 1972-1978.
- Wheatley K, et al. (ASTRAL Investigadores): N Engl J Med 2009; 361: 1953-1962.
- Bax L, et al: J Nephrol 2003; 16: 807-812.
- Cooper CJ, et al: N Engl J Med 2014; 370: 13-22.
- Radermacher J, et al: N Engl J Med 2001 344: 410-417.
- Calhoun DA, et al: Hypertension 2014 Mar; 63(3): 451-458.
- Symplicity HTN-1 Investigadores: Hipertensão 2011 Maio; 57(5): 911-917.
- Esler MD, et al: Circulação 2012 Dez 18; 126(25): 2976-2982.
- Fadl Elmula FE, et al: Hypertension 2014 May; 63(5): 991-999.
- Bhatt DL, et al. (SYMPLICITY HTN-3 Investigadores): N Engl J Med 2014 Abr 10; 370(15): 1393-1401.
CARDIOVASC 2014; 13(4): 16-20