Uma criança com uma citopenia pouco clara e sintomas adicionais tais como febre, linfadenopatia ou hepatoesplenomegalia deve ser generosa e rapidamente encaminhada para um centro. Hiperleucocitose, síndrome de lise tumoral e tumor mediastinal são complicações que ameaçam a vida na fase inicial de clarificação e terapia. A taxa de sobrevivência é superior a 80% para a leucemia linfoblástica aguda (ALL) e 60% para a leucemia mielóide aguda (AML). Aqui, a resposta precoce à terapia e a citogenética das explosões são prognosticalmente decisivas – no caso de TODOS, a idade, a contagem de leucócitos e o imunofenótipo são também decisivos. Os sobreviventes a longo prazo da leucemia infantil têm um risco significativamente aumentado de efeitos neuropsicológicos, endocrinológicos, metabólicos e cardíacos tardios, bem como de segundos tumores.
A leucemia infantil aguda é um exemplo impressionante da história de sucesso da hematologia e oncologia pediátrica ao longo dos últimos 40 anos. A leucemia infantil aguda, por exemplo, desenvolveu-se de uma doença quase sempre letal nos anos 60 para uma doença que é agora frequentemente curável com uma taxa de sobrevivência a longo prazo superior a 80%. A história do tratamento da leucemia mostra a importância dos ensaios clínicos aleatórios, que constituem uma base para a melhoria contínua do tratamento da leucemia. No futuro, novos conhecimentos sobre a biologia das células de leucemia permitirão uma terapia mais direccionada e adaptada ao risco [1].
Epidemiologia
Na Suíça, entre 50 – 60 crianças (0 a 14 anos de idade) desenvolvem todos os anos leucemia aguda (incidência 5/100 000 habitantes) [2]. A leucemia aguda é a doença maligna mais comum da infância (30%) e está dividida em 80% de leucemia linfoblástica aguda (ALL) com células B e T ALL e 20% de leucemia mielóide aguda (AML). Os pacientes com TODOS têm uma taxa de sobrevivência a longo prazo de 80% e os pacientes com LMA de 55 – 60%. Os rapazes são afectados um pouco mais frequentemente do que as raparigas. A distribuição etária mostra um pico de frequência entre o segundo e o quinto ano de vida para TODOS e no primeiro e segundo ano de vida e a partir da adolescência para a AML [1].
Apresentação clínica
Na leucemia aguda, a expansão clonal de células progenitoras hematopoiéticas imaturas na medula óssea resulta no deslocamento da hematopoiese normal. Esta insuficiência de medula óssea leva a anemia, neutropenia e trombocitopenia com os sintomas listados abaixo (Tab. 1). Além disso, a infiltração leucémica da medula óssea pode resultar em hiperleucocitose e coagulopatia com risco de vida. Além disso, vários órgãos como o fígado, baço, gânglios linfáticos, timo, testículos, pele/mucosa e SNC podem ser infiltrados (Tab. 1) [3]. Na maioria das vezes, os sintomas persistem durante alguns dias a semanas.
Diagnóstico e classificação
Se houver uma suspeita clínica de leucemia aguda (ver sintomas Separador. 1) um hemograma deve ser feito por um pediatra ou clínico geral registado. Se o hemograma mostrar monocitopenia, bicitopenia ou tricitopenia e/ou leucocitose, a criança deve ser generosa e rapidamente encaminhada para uma clínica pediátrica especializada, se possível.

Aqui, após o diagnóstico inicial para detecção precoce de uma síndrome de lise tumoral ou de uma massa mediastinal (hemograma diferencial com diferenciação microscópica, valores hepáticos, valores renais, electrólitos, ácido úrico, LDH, coagulação e tórax de raios X), são iniciados os seguintes exames específicos da leucemia na medula óssea (aspiração de medula óssea e biopsia).
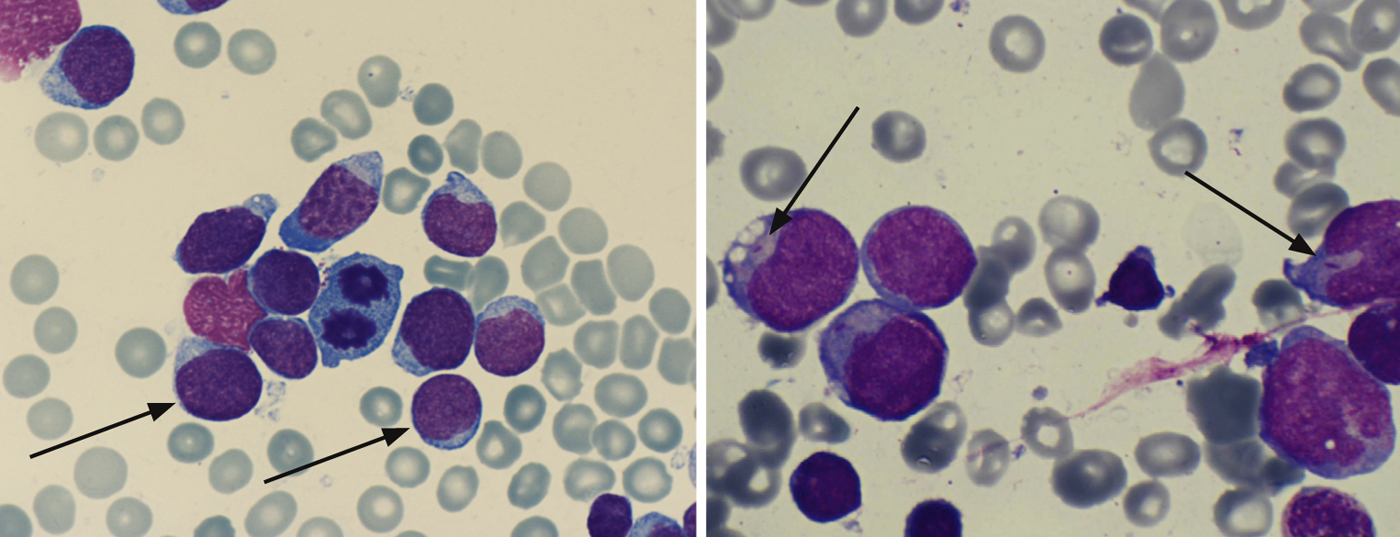
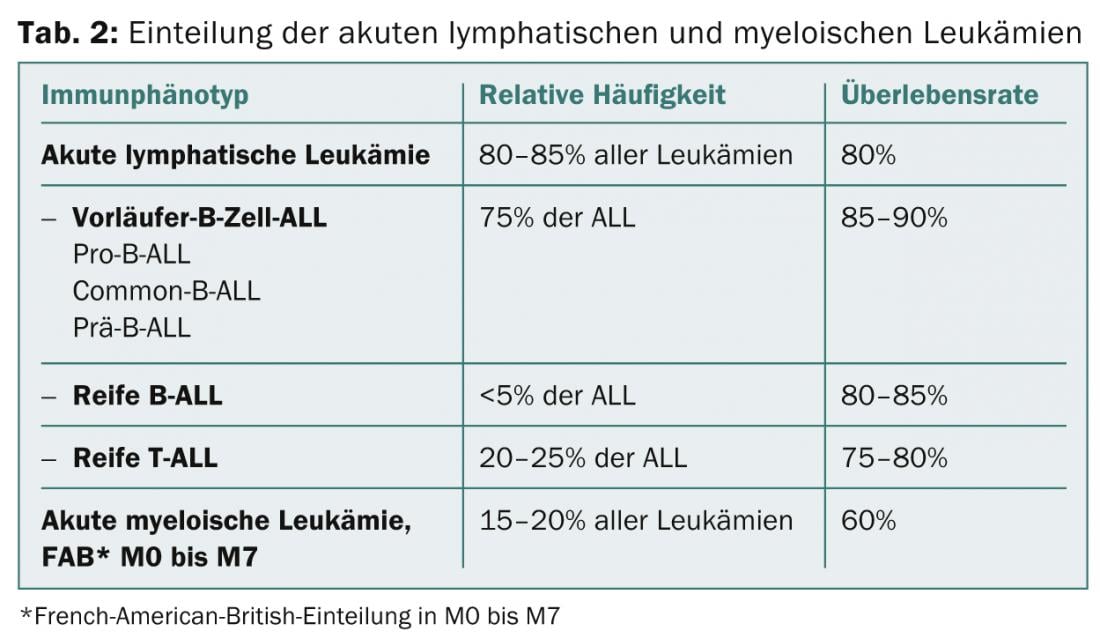
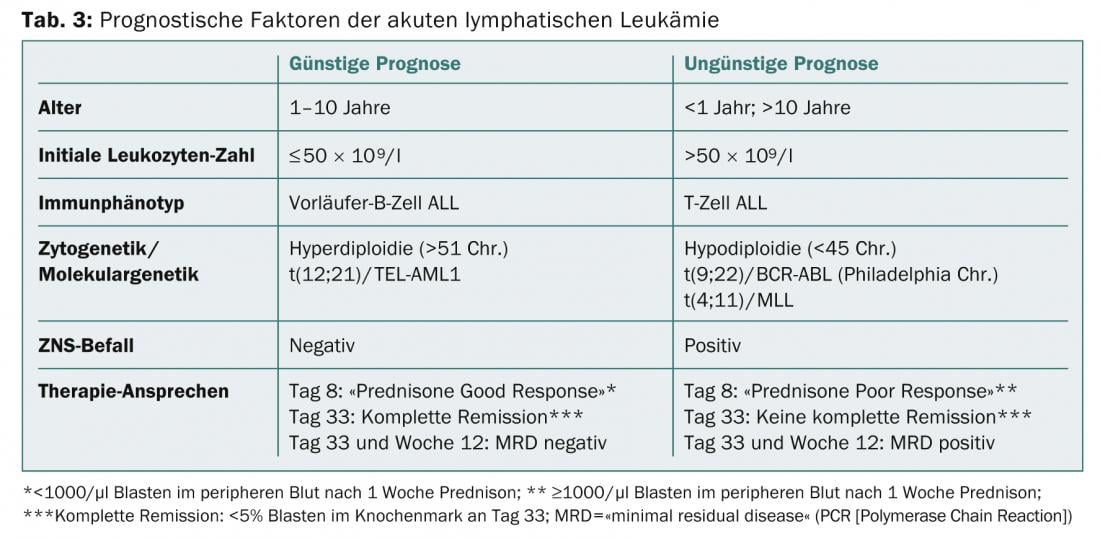
Citologia/morfologia: Aqui, a medula óssea é avaliada sob um microscópio ligeiro no que diz respeito à sua morfologia. Por definição, ALL tem ≥ 25 e AML ≥ 30% de explosões na medula óssea. A coloração citoquímica adicional (mieloperoxidase, fosfatase ácida, etc.) pode dar indicações iniciais dos tipos de leucemia (Tab. 2; Figs. 1 e 2) .
As varas Auer provam AML e são uma expressão do distúrbio de maturação da célula de leucemia (Fig. 2).
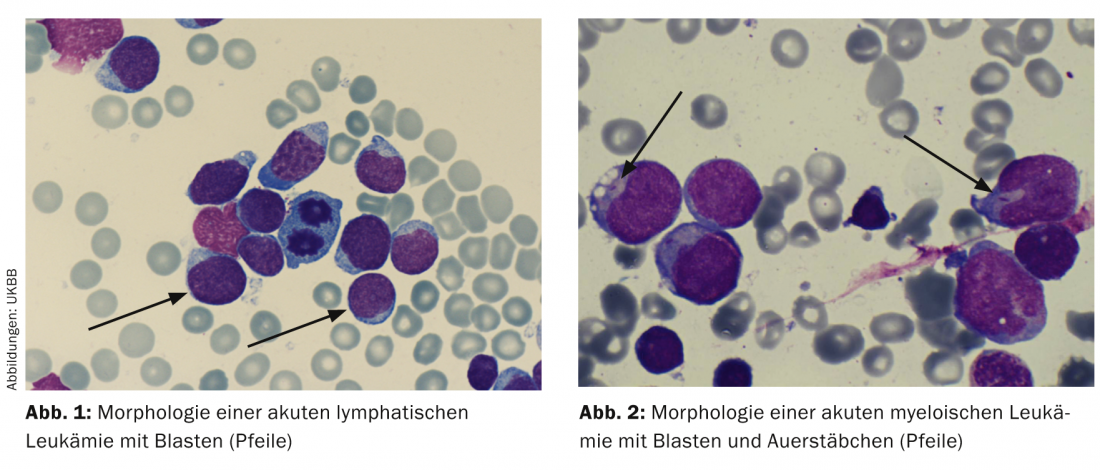
Imunofenotipagem: Com base em marcadores de superfície específicos das explosões leucémicas, as células leucémicas caracterizam-se pela imunofenotipagem citométrica de fluxo no que diz respeito à sua maturidade e afiliação à série de células B ou T ou à série mielóide (Tab. 2).
Citogenética e genética molecular: Além disso, as leucemias agudas podem ser caracterizadas com base nas aberrações cromossómicas das explosões e divididas em diferentes grupos de risco. Prognosticamente favoráveis em B-ALL são, por exemplo, a hiperdiploidia e a translocação t(12;21)(p13;q21) com o gene transfusional TEL-AML1; prognosticamente desfavoráveis são a hipodiploidia e a translocação t(9;22)(q34;q11) (= cromossoma de Filadélfia) com o gene transfusional BCR-ABL (Tab. 3) .
No diagnóstico da LMA, a detecção das translocações t(8;21) e t(15;17) ou a detecção da inversão 16 significa um prognóstico mais favorável, enquanto a detecção da monossomia 5 ou 7 está associada a um mau prognóstico (Quadro 4) [1,4,5].
Terapia
Como mencionado acima, o prognóstico da leucemia infantil aguda melhorou de forma impressionante nos últimos 40 anos. Em primeiro lugar, o sistema nervoso central foi identificado como um local frequente de recorrência e foi iniciado o tratamento profilático do SNC. Por outro lado, foram desenvolvidos protocolos de quimioterapia complexos e adaptados ao risco. Além disso, a terapia de apoio melhorou significativamente, de modo que a morbilidade e mortalidade associadas à terapia diminuíram [1].
Actualmente, a terapia para a infância TODOS consiste em poli-quimioterapia, que inclui esteróides, bem como vários outros agentes quimioterápicos (metotrexato, vincristina, asparaginase, ciarabina, ciclofosfamida, antraciclinas, 6-mercaptopurina). Uma criança com TODOS recentemente diagnosticados começa com a quimioterapia de indução, na qual uma combinação de cinco a seis agentes quimioterápicos é administrada durante cinco semanas com o objectivo de minimizar a carga celular de leucemia a um nível que já não é clinicamente e hematologicamente detectável. A indução é seguida de quimioterapia de consolidação para tratar o compartimento extramedular (SNC e testículos). Consiste na administração de metotrexato sistémico intratecal e em doses elevadas, que se destina a prevenir as recorrências do SNC e substitui a irradiação preventiva do SNC que costumava ser realizada rotineiramente. A quimioterapia de reindução conclui então a fase de tratamento inicial intensivo após cerca de seis meses. Uma grande parte das fases de quimioterapia intensiva pode ser levada a cabo em regime ambulatório. Posteriormente, a quimioterapia de manutenção ambulatória com 6-mercaptopurina e metotrexato é administrada por mais 18 meses.
O transplante hematopoiético de células estaminais (TCTH) é utilizado em pacientes pediátricos com um perfil de alto risco (má resposta à terapia, genética molecular prognosticalmente desfavorável, recidiva) e um doador adequado. A irradiação do SNC é indicada se as células de leucemia forem inicialmente detectadas no líquido cefalorraquidiano [5].
O parâmetro prognóstico mais importante no tratamento da leucemia infantil é a resposta à terapia. Uma redução de explosões no sangue periférico para <1000/µl após uma semana de tratamento com esteróides (dia 8), uma remissão hematológica completa com <5% de explosões na medula óssea no final da indução (dia 33) e um valor negativo de MRD (“doença residual mínima” por PCR) no dia 33 e semana 12 são os mais fortes preditores de sobrevivência sem recaídas (Tab. 3) [5].
No tratamento da LMA infantil, é necessária uma poli-quimoterapia muito intensiva que consiste em blocos quimioterápicos curtos com antraciclinas, citarabina, etoposida, 6-tioguanina e possivelmente ATRA (“all-trans-retinoid acid”) [3]. A quimioterapia começa com a indução, seguida de consolidação e intensificação, e termina com aproximadamente um ano de quimioterapia de manutenção com 6-tioguanina e citarabina. Além disso, a terapia extramedular com metotrexato intratérmico, citarabina e prednisona é realizada a intervalos regulares [6].
De acordo com o estado actual dos estudos internacionais, a irradiação craniana preventiva está actualmente dispensada [6,7]. Os doentes com citogenética desfavorável, uma má resposta à terapia ou uma recaída qualificam-se para o TCTH [6].
Tal como em TODOS, a resposta à terapia é também um factor de prognóstico decisivo na LMA. A remissão em AML é definida com<5% de explosões na medula óssea, regeneração da medula óssea normocelular e nenhuma evidência de leucemia extramedular. Isto é normalmente conseguido após quatro a seis semanas de terapia de indução [4].
Complicações
Um importante e frequente efeito secundário associado à terapia do tratamento da leucemia é a mielototoxicidade induzida pela quimioterapia com pancitopenia. Conduz, via neutropenia, a uma tendência crescente para a infecção com febre em neutropenia, infecções bacterianas, fúngicas e virais, que muitas vezes requerem hospitalização. Há também um risco aumentado de infecções oportunistas (Pneumocystis jirovecii), razão pela qual é dada profilaxia antibiótica com trimetoprim-sulfamethoxazole. Além disso, ocorrem anemia e trombocitopenia, de modo que podem ser necessárias transfusões regulares. Para além da medula óssea, outras séries de células com uma elevada taxa de divisão também são danificadas. Consequentemente, há mucosite enoral e gastrointestinal devido a danos na mucosa e alopecia devido a danos no folículo piloso. As náuseas e vómitos são também efeitos secundários comuns que podem normalmente ser bem tratados com antieméticos. Além disso, existem muitos, mas menos frequentes, efeitos secundários específicos das drogas.
Efeitos tardios
Com o aumento da taxa de sobrevivência das crianças que desenvolvem leucemia aguda, o número de antigos doentes com cancro infantil com efeitos tardios devido à doença e ao tratamento também está a aumentar [1]. Estes incluem problemas neurológicos, endocrinológicos, metabólicos e cardíacos, bem como segundos tumores.
Os efeitos neurológicos tardios incluem défices neuropsicológicos, que são principalmente o resultado da irradiação craniana. Foi possível demonstrar que a substituição da irradiação craniana profiláctica por quimioterapia intratecal levou a uma redução dos efeitos neuropsicológicos tardios [8]. Os problemas neuropsicológicos incluem dificuldades em aritmética, memória verbal de curto prazo, funções executivas, atenção e concentração.
Os efeitos endocrinológicos e metabólicos tardios afectam principalmente crianças com irradiação craniana e incluem deficiência de hormonas de crescimento, disfunção da tiróide, atraso puberal ou síndrome pubertas praecox e metabólico. As perturbações da fertilidade são quase exclusivamente observadas em pacientes transplantados.
Devido a doses relativamente elevadas de anthraciclina acumulada, especialmente no tratamento AML, a cardiomiopatia dilatada pode ocorrer após anos ou décadas como uma consequência cardíaca tardia.
A irradiação craniana aumenta o risco de desenvolver tumores cerebrais secundários benignos e malignos (meningiomas, gliomas), bem como adenomas ou carcinomas da tiróide. Os pacientes após quimioterapia exclusiva têm um risco aumentado de síndromes mielodisplásicas ou LMA secundária como expressão da degeneração pré-maligna ou maligna da medula óssea induzida pela quimioterapia [1].
Christina Schindera, MD
Literatura:
- Orkin S, et al: Leucemia Linfoblástica Aguda e Leucemia Mielóide, Mielodisplasia, e Doença Mieloproliferativa em Crianças. Oncologia da Infância e da Infância 2009; 297-402. Saunders Elevier.
- Kuehni C: Registo Suíço do Cancro na Infância, Relatório Anual 2011/2012. 2013 www.kinderkrebsregister.ch/fileadmin/KKR08/uploads/pdf/AnnualReport_SCCR_2011_2012_FINAL.pdf.
- Bailey S, Skinner R: Oxford Specialist Handbooks in Paediatrics: Paediatric Haematology and Oncology. 2010. Oxford Medical Publications, Oxford, Reino Unido.
- Creutzig U, Reinhardt D: Estudo de optimização da terapia multicêntrica AML-BFM 2004. 2010.
- Schrappe M, AIEOP-BFM ALL 2009: Protocolo internacional de tratamento colaborativo para crianças e adolescentes com leucemia linfoblástica aguda. 2013.
- Creutzig U, Dworzak M, Reinhardt D: Leucemia mielóide aguda na infância. 2013. %C3%.
- Pui CH, Howard SC: Gestão actual e desafios da doença maligna no SNC na leucemia pediátrica. Lancet Oncol 2008; 9(3): 257-268.
- Von der Weid N, et al: Resultado intelectual em crianças e adolescentes com leucemia linfoblástica aguda tratados apenas com quimioterapia: diferenças relacionadas com a idade e o sexo. Eur J Cancer 2003; 39(3): 359-365.
InFo Oncologia & Hematologia 2014; 2(5): 4-7